2型糖尿病足溃疡患者外周血miR-155表达水平的改变及其临床意义
赵天琦,赵晓彤,许慕蓉,唐 颖,荚泽国,罗 莉,唐松涛,章 秋,陈明卫
糖尿病足是糖尿病常见的严重慢性并发症之一。糖尿病足溃疡(diabetic foot ulcer,DFU)为糖尿病足最常见的表现形式,是导致非创伤性截肢最常见的原因[1]。微小RNAs(miRNAs)是一类内源性非编码小RNA,长度约为18~25个核苷酸,通过与下游靶mRNA的3’端非翻译区域特异性结合,调控靶基因表达[2]。近年来越来越多的研究[3]表明,miRNAs异常表达与DFU的发生与预后密切相关。miR-155是miRNAs家族中的重要成员,广泛参与机体免疫细胞的发育分化、炎症反应、免疫应答等许多生物过程,并可对参与皮肤创面愈合过程的角质形成细胞、成纤维细胞、真皮间充质干细胞等细胞功能产生显著影响[4-5]。抑制局部创面组织中miR-155的表达可促进糖尿病大鼠皮肤伤口的愈合[6-7]。目前有关miR-155与DFU发病的相关关系的临床研究尚未见报道。因此,该研究旨在了解DFU患者外周血中miR-155表达水平的改变及其与DFU发病之间的关系。
1 材料与方法
1.1 病例资料选取的研究对象来自课题组先前研究[8]报道的受试者,为2018年1月至2019年12月在安徽医科大学第一附属医院内分泌科住院治疗的2型糖尿病(type 2 diabetes mellitus,T2DM)合并DFU患者112例(DFU组),足溃疡病程≥4周,溃疡面积在2~20 cm2,Wagner分级 2~4级,踝肱比(ankle-brachial index,ABI)0.7~1.3,糖尿病病程3~18年。选择同期在本院内分泌科就诊的60例新诊断T2DM患者为糖尿病组 (T2DM组),无DFU。选择同期在本院健康管理中心体检的健康人群60例作为正常对照组(NC组),均行75g口服葡萄糖耐量试验,证实为糖耐量正常。所有受试者无严重心、肝、肾功能不全,非癌性溃疡创面,无自身免疫疾病,无严重脓毒血症。本研究经医院医学伦理委员会批准,并获得受试者知情同意。
1.2 主要仪器与试剂全自动生化分析仪(MODULE P800,瑞士罗氏公司),数码照相结合Image J医学图像分析软件(Image J-ij133-jdk15,美国国立卫生研究院),多普勒血流探测仪(DPL-03,杭州远想医疗),经皮氧分压检测仪(TCM 400,丹麦雷度公司),miRcute miRNA提取分离试剂盒、miRcute miRNA cDNA第一链合成试剂盒(北京天根生化科技有限公司)。
1.3 方法
1.3.1DFU的治疗过程 所有DFU均给予常规的全身治疗,包括抗感染、降压、降糖、纠正低蛋白血症、营养神经、改善下肢创面血液供应等。并行创面清除术,去除变黑坏死软组织以及骨组织。可根据DFU具体情况,给予减压、持续负压吸引治疗等。随访DFU病情变化,由糖尿病足多学科团队会商决定是否行截肢治疗,记录患者治疗8周后创面完全愈合情况。
1.3.2临床指标的检测 所有受试者禁食10 h后于次日早晨8 ∶00~8 ∶30空腹状态从肘部抽取静脉血至抗凝管(抗凝剂为氟化钠/EDTA/肝素,可根据检查项目不同选择不同抗凝剂)或非抗凝采集试管中,供测定血清白蛋白(albumin,ALB)、血糖、血脂、糖化血红蛋白A1c(glycosylated hemoglobin A1c, HbA1c)、白细胞(white blood cell, WBC)计数、血红蛋白(hemoglobin, Hb)、C反应蛋白(C-reactive protein, CRP)、红细胞沉降率(erythrocyte sedimentation rate, ESR)等指标。采用全自动生化分析仪测定血糖、血脂、ALB。其中空腹血糖(fasting plasma glucose, FPG)检测采用葡萄糖氧化酶法,总胆固醇(total cholesterol, TCH)、三酰甘油(triglyceride, TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)检测采用氧化酶联比色法。此外,采用高压液相色谱法检测HbA1c,采用乳胶增强散射免疫比浊法测定CRP,采用魏氏法测定ESR。采用数码照相结合Image J医学图像分析软件测量皮肤溃疡面积,使用多普勒血流探测仪测定ABI,应用经皮氧分压检测仪测定溃疡周围的经皮氧分压(percutaneous oxygen partial pressure, TcPO2)。
1.3.3外周血miR-155表达的检测 应用实时定量PCR(qRT-PCR)测定外周静脉血中miR-155的表达。将2 ml静脉血置于EDTA抗凝管中,离心后将获得的血浆移入无RNA酶的1.5 ml EP管中,置于-80 ℃冻存。按miRcute miRNA提取分离试剂盒说明书操作,进行RNA的提取。并使用超微量紫外分光光度计测定RNA浓度和纯度。随后按照miRcute miRNA cDNA第一链合成试剂盒说明书操作,进行cDNA的合成。最后按miRcute miRNA荧光定量检测试剂盒说明书操作,进行qRT-PCR。
miR-155引物序列:上游5′-CGGCGGTTAATGCTAATTGTGAT-3′;下游5′-GTGCAGGGTCCGAGGT-3′;U6引物序列:上游5′-GCTTCGGCAGCACATATACTAAAA-3′,下游5′-CGCTTCACGAATTTGCCTGTCAT-3′。设置的反应条件:95 ℃预变性5 min,95 ℃变性20 s,58 ℃退火15 s,72 ℃延伸10 s,共42个循环。以U6为内参,采用2-ΔΔCt法分别计算miR-155相对表达量。每例样本均重复3次,取平均值为最终结果。

2 结果
2.1 三组间临床参数指标比较三组间性别构成、年龄、TCH、LDL-C水平差异均无统计学意义(P>0.05)。T2DM组和DFU组的FPG、HbA1c、TG水平均高于NC组,HDL-C水平则低于NC组,差异均有统计学意义(P<0.05)。T2DM组外周血miR-155表达水平低于NC组,DFU组外周血miR-155表达水平高于NC组,差异均有统计学意义(P<0.05)。另外,NC组与T2DM组间TcPO2、ABI、CRP、ESR、ALB、WBC计数、Hb差异均无统计学意义(P>0.05)。DFU组糖尿病病程、FPG、HbA1c、CRP、ESR、WBC计数以及外周血miR-155表达水平均高于T2DM组,而TcPO2、ABI、ALB、Hb均低于T2DM组,差异均有统计学意义(P<0.05),两组间TG、HDL-C水平差异均无统计学意义(P>0.05),见表1。
2.2 外周血miR-155表达水平与DFU临床特征之间的关系以112例DFU患者外周血miR-155表达水平的中位数作为切割点,将DFU组再分为两个亚组,其中外周血miR-155表达水平低于中位数者列为低表达组,将高于或等于中位数者列为高表达组。对高表达组与低表达组间足溃疡的临床特征进行比较,结果显示DFU患者外周血miR-155表达水平与8周后足溃疡愈合率呈负相关(P=0.04),与足溃疡病程、足溃疡Wagner分级呈正相关(P=0.02,P=0.01),未见到miR-155表达水平与足溃疡其他临床特征之间存在相关性,见表2。

表2 DFU患者外周血miR-155表达水平与足溃疡临床特征之间的关系[n (%)]
2.3 三组中外周血miR-155表达与其他临床参数指标之间的相关性在NC组中,未观察到外周血miR-155表达与其他临床参数指标之间存在明显相关性(P>0.05);在T2DM组中,外周血miR-155表达与FPG、HbA1c水平呈负相关(P<0.05),与其他指标无显著相关性(P>0.05);在DFU组中,外周血miR-155表达与足溃疡病程、足溃疡Wagner分级、CRP、白细胞计数呈正相关(P<0.05),与其他指标无显著相关性(P>0.05)。见表3。
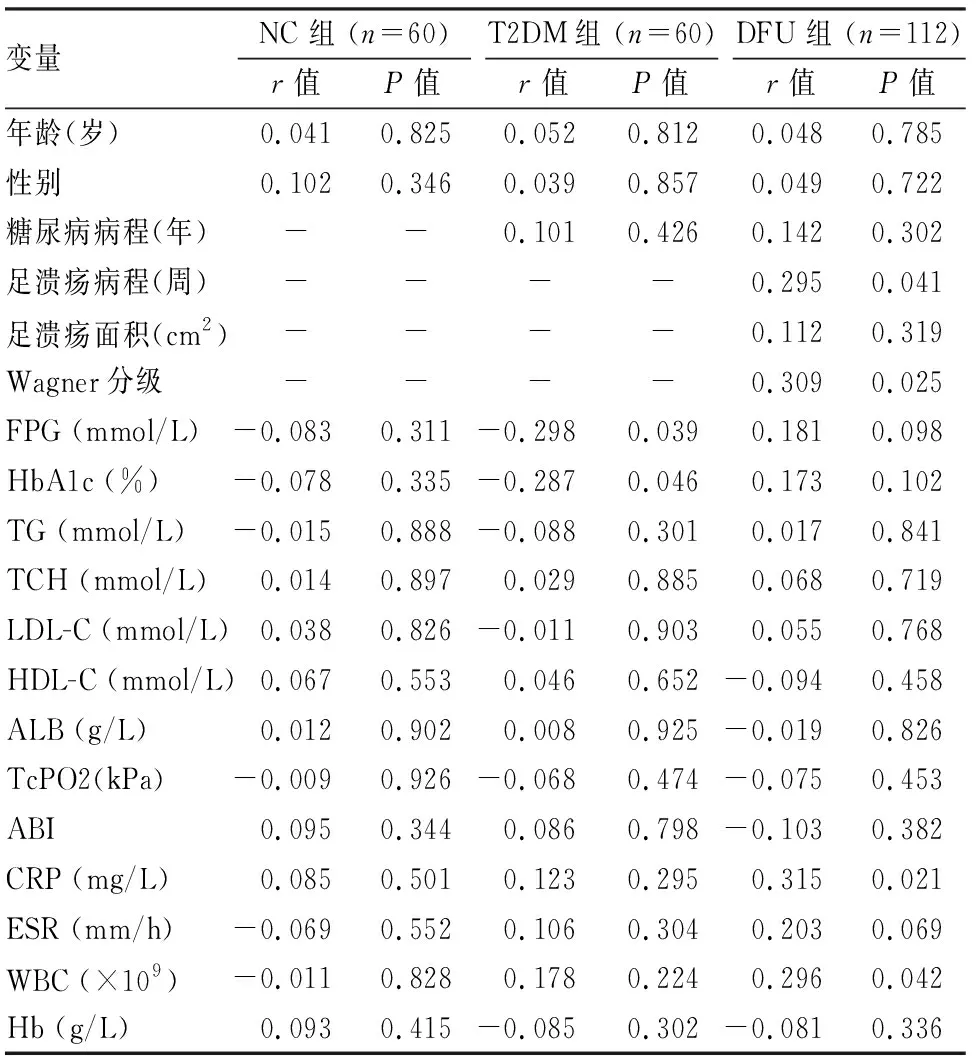
表3 三组中外周血miR-155表达与其他临床参数指标之间的相关性(r)
2.4 DFU的危险因素分析在糖尿病患者中,以DFU作为因变量,分别以性别、年龄以及单因素Logistic回归分析中获得的所有P值<0.1的变量(包括糖尿病病程、FPG、HbA1c、TG、 LDL-C、HDL-C、ALB、TcPO2、ABI、CRP、WBC、 Hb、ESR、miR-155)为自变量进行多元逐步Logistic回归分析,发现糖尿病病程、HbA1c、CRP、低TcPO2 、高表达miR-155均为DFU的独立危险因素,见表4。

表4 DFU危险因素的多元逐步Logistic回归分析
3 讨论
本研究显示,与无DFU的T2DM患者比较,DFU患者外周血中miR-155表达水平明显升高,高表达的miR-155不仅为DFU发病的独立危险因素,也与DFU的Wagner分级、愈合率密切相关,miR-155高表达者DFU病情程度较重,愈合率较低。提示miR-155的高表达,不仅是DFU发病的强危险因素,还可作为DFU病情评估、治疗预后的潜在生物标志物。
本组资料显示,与糖耐量正常的对照人群比较,T2DM患者外周血miR-155表达水平明显降低。相关分析显示,在T2DM患者中,miR-155与FPG、HbA1c成负相关。动物研究[9]显示,miR-155的整体转基因过度表达可改善小鼠的糖耐量和胰岛素敏感性,导致低血糖。相反,小鼠miR-155缺乏会导致高血糖、糖耐量受损和肝脏、肌肉、脂肪细胞的胰岛素抵抗。临床研究[10-11]显示在T2DM患者的外周血浆以及单核细胞中,miR-155表达水平均较性别年龄匹配的糖耐量正常人群显著降低。本研究结果与之一致。然而,在DFU组中,外周血miR-155表达水平与FPG、HbA1c无明显相关性,推测原因可能是DFU患者中其他因素对miR-155表达的影响超过FPG、HbA1c所致。本研究还表明,在DFU组中,miR-155表达水平与反应炎症状态指标的CRP、ESR、WBC计数显著正相关,提示DFU患者外周血miR-155的高表达与感染性炎症状态可能有关。此外,本研究未观察到miR155表达水平与糖尿病病程之间存在相关性。
本研究中,DFU组足溃疡的病程至少4周,为慢性难愈合创面。临床特征表现为糖尿病病程长,长期血糖控制不佳,合并不同程度的脂代谢异常、周围血管病变与感染性炎症状态。多因素回归分析显示,糖尿病病程、HbA1c、TcPO2、CRP为足溃疡发生的独立影响因素,与既往的研究[12]结果一致。进一步分析发现,与T2DM组患者相比,DFU组患者外周血miR-155水平明显增高;miR-155表达水平与足溃疡病程、Wagner分级呈正相关,与8周后足溃疡愈合率呈负相关。多因素回归分析显示,高表达的miR-155为足溃疡发生的独立危险因素。提示miR-155可能参与DFU的发病过程,并可作为DFU病情严重程度以及预后判断的标志物。目前普遍认为创面中存在持续和过度的炎症状态以及表皮中参与创面愈合的多种细胞功能受损是造成DFU难以愈合的重要影响因素[13]。研究[6]表明,在糖尿病鼠皮肤伤口中miR-155表达增加,miR-155既扮演着促炎症效应角色,又可通过下调成纤维细胞生长因子7表达,影响角质形成细胞的迁移和增殖,损害创面的再上皮化。而在敲除miR-155后,小鼠伤口组织中M1样巨噬细胞减少,M2样巨噬细胞和I型胶原沉积明显增加,创面炎症反应减轻,修复能力增强[14]。另外,在糖尿病大鼠皮肤伤口模型中[6-7],局部注射miR-155抑制剂干扰miR-155表达后,创面组织中T淋巴细胞、中性粒细胞、巨噬细胞等炎症细胞数量减少,白介素-1β、肿瘤坏死因子-α水平降低,炎症反应减轻,新生血管明显增加,肉芽组织中胶原含量增加,排列更加规则,创面愈合加速。
总之,本研究显示,2型糖尿病足溃疡患者外周血miR-155表达水平增高,为DFU的独立危险因素并与DFU预后密切相关。本研究的不足之处主要包括:为单中心研究,样本量相对较少,可能存在选择偏倚,因此需要更多的研究来证实。此外,本研究也无法明确miR-155与DFU发病的因果关系。未来需要进一步探讨miR-155的作用机制以及评估miR-155能否成为DFU的新治疗靶点。

