紫草素对乳腺癌4T1细胞增殖的抑制作用及其机制研究
马 畅,彭国良,李 妍* (.吉林医药学院免疫药理学重点研究室,吉林 吉林 303;.联勤保障部队临潼康复疗养中心,陕西 西安 70699)
全球疾病调查发现乳腺癌已经成为威胁女性健康的首要疾病。世界卫生组织国际癌症研究机构统计,2020年全球乳腺癌新发病例高达226万例,乳腺癌约占所有女性恶性肿瘤的24.2%,中国女性发病人数及死亡人数均居世界首位[1-2]。乳腺癌的治疗多以化疗、放疗、手术切除为主。患者治疗期间痛苦程度较高,且治疗后仍有30%左右的患者会出现复发或转移,部分患者在治疗期间还会出现如心脏毒性、肾毒性、骨髓抑制等毒副作用,影响愈后生活。
紫草素是从中草药紫草根部提取的一种小分子萘醌类的化合物[3],研究发现其具有抗炎、抗癌、抗血栓形成、免疫调节等作用,具有易获取、价格低、毒副作用小等优势[4-5]。基质金属蛋白酶(matrixmetalloproteinases,MMPs)是一个大家族[6],其表达和活性在不同细胞中受到严密调控,可以监测肿瘤细胞是否发生浸润或迁移。紫草素是否影响肿瘤细胞转移与侵袭尚不明确。本研究以体外培养的小鼠乳腺癌细胞4T1为模型,探讨紫草素对乳腺癌细胞增殖的抑制作用,分析相关机制,阐述其在乳腺癌治疗中的价值。
1 材料与方法
1.1 实验材料
小鼠乳腺癌细胞4T1保存于吉林医药学院免疫学实验室。紫草素购自百灵威科技有限公司;细胞培养液1640购自Gibco公司;MTT、DMSO购自美国Sigma公司;碘化丙啶(propidium iodide,PI)购自碧云天生物技术有限公司;鼠抗人β-actin、MMP-2抗体购自美国Abcam公司;免疫印迹试剂购自索莱宝公司;其他试剂均为国产分析纯。
1.2 细胞培养及药物处理
液氮罐中取出冻存的4T1细胞,复苏、传代至对数生长期。传代培养使用含10%胎牛血清的1640液,每周传代2到3次,按照实验所需铺板,培养。取对数生长期细胞,调整细胞浓度为2×104/mL,每孔100 μL接种于96孔板培养12 h,弃去上清每孔加入含紫草素的培养液200 μL,使其终浓度分别为0、12.5、25、50和100 μmol/L,每个药物浓度设6个复孔。PBS封边。
1.3 MTT还原法测细胞增殖
在给予药物紫草素后继续培养72 h,移除上清,按照1∶10加入MTT与血清培养基的混合液(MTT保存使用过程中注意避光),96孔板继续放入培养箱中培养4 h,PBS组为空白组,每孔加入DMSO 200 μL溶解10 min,使用酶标仪室温下490 nm波长处测定吸光度值,每组实验重复3次。计算细胞增殖抑制率(inhibition rate,IR)。
1.4 流式细胞术检测细胞周期和凋亡
消化并收集细胞,取每组1×106个细胞进行染色,PBS洗涤两次,用5 mL 80%冷甲醇溶液固定细胞。检测分析前离心弃去固定液,用PBS洗涤细胞2次,细胞周期测定使用Triton-100的PI和RNA酶室温下避光染色30 min;凋亡使用PI避光染色30 min,流式细胞仪(Epics,美国贝克曼)上机检测。
1.5 免疫印迹分析相关蛋白
取对数生长期的4T1细胞加入紫草素使终浓度为0、12.5、25、50和100 μmol/L处理细胞24 h,去上清液PBS洗涤细胞2次,消化收集贴壁生长的细胞,加裂解液裂解超声破碎提取蛋白,免疫印迹分析MMP-2蛋白的表达。
1.6 统计学分析亡
用SPSS 20.0软件进行统计学分析,组间比较采用单因素方差分析,结果用均数±标准差表示,P<0.05表示具有统计学意义。
2 结 果
2.1 紫草素对4T1细胞增殖的影响
紫草素以浓度依赖方式抑制乳腺癌细胞4T1生长,药物作用72 h的半数抑制率(IC50)值约为50 μmol/L(图1)。
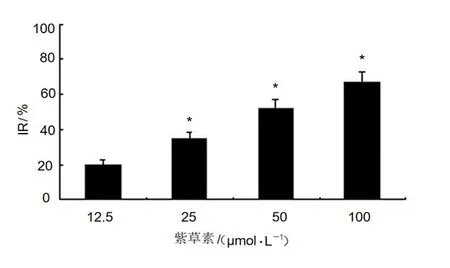
图 1 不同浓度紫草素对4T1细胞增殖的抑制作用
2.2 紫草素对4T1细胞周期与凋亡的影响
不同浓度紫草素(0、12.5、25、50和100 μmol/L)处理4T1细胞24 h后,流式细胞术分析细胞周期(表1)。与对照组比较,紫草素组处理组显著使细胞阻滞于G0/G1期细胞,而S期和G2/M期细胞百分率不同程度降低。
2.3 紫草素对4T1细胞MMP-2表达的影响
不同浓度紫草素(0、12.5、25、50和100 μmol/L)处理4T1细胞免疫印迹技术检测MMP-2表达的结果见图2,显示紫草素对MMP-2表达具有抑制作用。
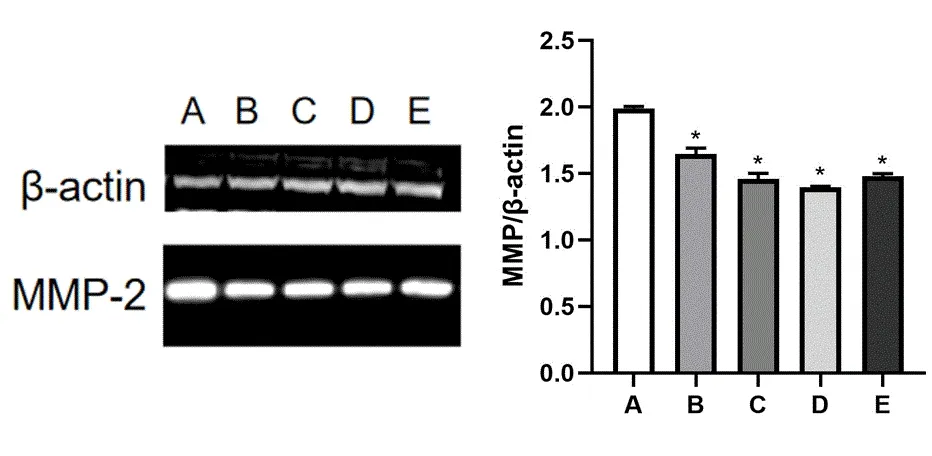
图 2 紫草素对4T1细胞MMP-2表达的影响
3 讨 论
2000-2021年,乳腺癌的发病率急速增高,但死亡率却有所降低。乳腺癌早期的治疗相较于晚期更容易,生存率也更高,而肿瘤晚期的浸润与迁移会直接导致患者死亡率增加[1-2]。乳腺癌是一种异质性疾病,分为管腔A、管腔B、HER2过表达、受体转移性乳腺癌(metastatic breast cancer,MBC)和三阴性乳腺癌(triple-negative breast cancer,TNBC)。TNBC是指雌激素受体、孕激素受体和人表皮生长因子均为阴性的乳腺癌,占所有乳腺癌的10%~17%。TNBC在具有较强的浸润和迁移性,治疗上相较于其他类型的乳腺癌更难,且对于晚期TNBC几乎无法治愈,筛选合适的抗肿瘤转移药物是治疗的捷径。
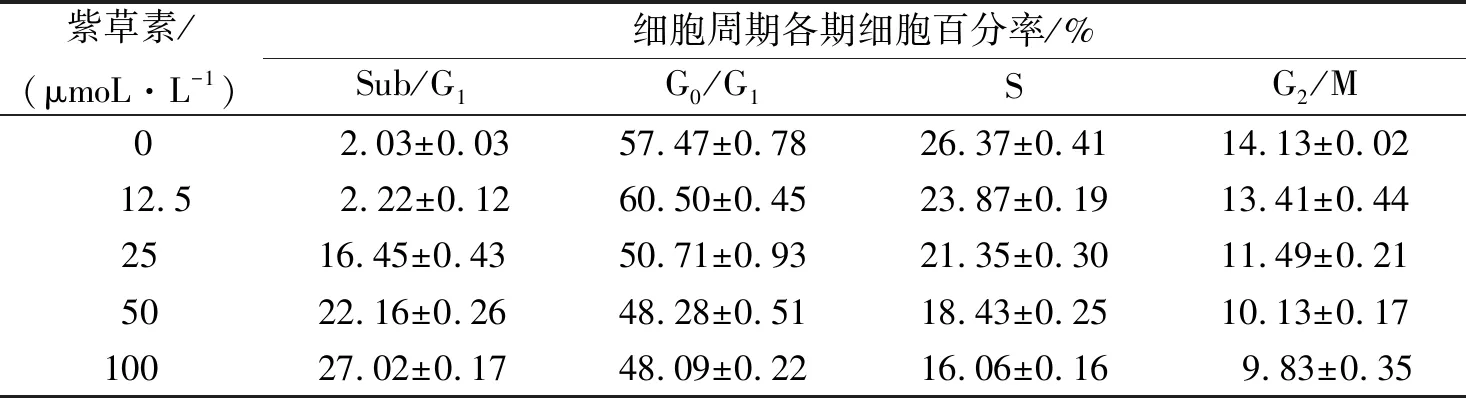
表 1 紫草素对4T1细胞周期与凋亡的影响
紫草素有明显的抗肿瘤作用,它可以抑制胃癌MGC803细胞、甲状腺癌细胞的增殖,诱导卵巢癌HO-8910细胞的凋亡,促进人乳腺癌MCF-7发生自噬[4-5]。徐洋等研究发现紫草素可通过抑制STAT3-MMP2信号通路抑制人胃癌MGC803迁移[6]。为探究紫草素影响乳腺癌细胞的药理学机制,采用TNBC细胞小鼠乳腺癌细胞4T1,具备较强迁移能力的肿瘤,有利于研究紫草素的抗肿瘤机制。本实验的结果显示,紫草素能够抑制乳腺癌细胞4T1的增殖,且呈一定程度的浓度依赖性,这与安兴晨等的研究结果一致[7]。为进一步探讨紫草素抑制乳腺癌细胞增殖的原因,采用流式细胞术测定了不同浓度紫草素作用后4T1细胞的细胞周期与凋亡。结果显示细胞周期阻滞于G0/G1期的占比增多,处于S期与G2/M期的细胞呈不同程度的降低,且细胞凋亡的数量增多。王瑜等研究紫草素可以通过PI3K/AKT信号通路上调p53基因的表达而诱导SMMC-7721细胞凋亡的发生[8]。为研究紫草素是否会影响肿瘤细胞迁移,实验采用免疫印迹的方法测定了对照组与不同浓度紫草素给药后的乳腺癌4T1细胞的MMP-2与β-actin蛋白。MMP-2是检测肿瘤细胞迁移的标志物[9],其含量与肿瘤细胞的转移有直接的联系。实验结果显示,与空白组相比较,药物组MMP-2/β-actin的蛋白含量显著降低。提示紫草素可能影响小鼠乳腺癌4T1细胞的迁移与浸润,对TNBC转移后的治疗有帮助,为药物进一步研究提供了实验数据的支持。
综上所述,紫草素可以通过浓度依赖的方式抑制4T1细胞的增殖,通过MMP-2信号通路导致细胞周期阻滞于G0/G1期,抑制乳腺癌细胞4T1的侵袭转移,诱导凋亡的发生,从而为抗乳腺癌药物的研发提供实验依据。

