冷圈套切术与氩离子凝固术治疗结直肠微型及小型息肉的效果对比
刘双高,柳东东,邓赛玲
(广州市广钢新城医院内一科,广东 广州 510380)
结直肠息肉是指结直肠黏膜表面突出至肠腔的单发性或多发性肿物。此病的发生与遗传因素、饮食因素、年龄因素、炎症刺激因素等多种因素有关。此病患者随着病情的发展,可出现腹痛、便血、便秘等症状。结直肠息肉有癌变的风险。临床上通常将结直肠息肉分为肿瘤性息肉和非肿瘤性息肉,其中肿瘤性息肉约有9.4% 的癌变率。因此,专科医师建议针对结直肠息肉应做到早诊断、早发现、早治疗,以最大限度地降低其癌变率[1]。近年来随着我国医疗水平的提高,手术器械和腔镜技术愈加成熟和完善,具有创伤小、出血少及术后患者恢复快等诸多优势的内镜微创手术逐渐替代了创伤大、出血多的传统开腹手术。目前就结直肠息肉的治疗而言,一般有两种常用的微创术式,一种为氩离子凝固术(APC),一种为冷圈套切术(CSP)[2]。本文主要是比较用CSP与APC 治疗结直肠微型及小型息肉的效果。
1 资料和方法
1.1 基线资料
选择我院2019 年7 月至2020 年12 月收治的60 例结直肠微型及小型息肉患者作为试验对象。其纳入标准是:病情符合结直肠微型及小型息肉的诊断标准,且经结肠镜检查和病理活检得到确诊;微型息肉的直径≤5 mm,小型息肉的直径为6 ~9 mm ;具有进行手术治疗的指征;自愿参与本研究。其排除标准是:存在凝血功能障碍;合并有严重的心血管系统疾病或结直肠血管瘤;存在消化道出血或有出血倾向。随机将其分为APC组和CSP 组,每组各有患者30 例。在APC 组患者中,有男15 例,女15 例;其年龄为35 ~75 岁,平均年龄为(55.26±5.62)岁;其中,单发息肉、多发息肉患者分别有21 例、9 例;其共有息肉62枚,其中微型息肉、小型息肉分别有32 枚、30 枚。在CSP 组患者中,有男17 例,女13 例;其年龄为36 ~75 岁,平均年龄为(56.52±5.65)岁;其中,单发息肉、多发息肉患者分别有17 例、13例;其共有息肉58 枚,其中微型息肉、小型息肉分别有27 枚、31 枚。两组患者的基线资料相比,差异无统计学意义(P>0.05)。详见表1。
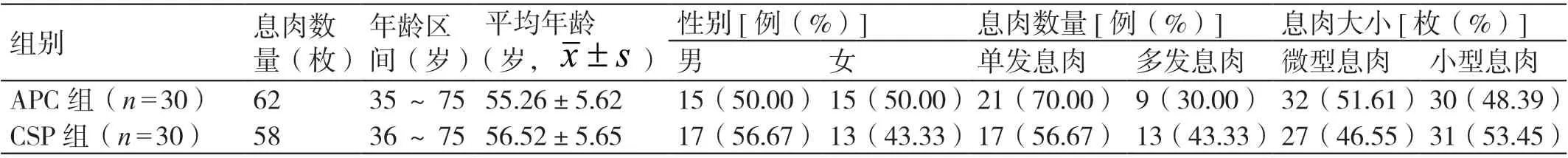
表1 两组患者基线资料的比较
1.2 方法
术前完善两组患者的血常规检查、凝血功能检查和心电图检查等常规检查,让其于术前禁食12 h,术前3 h 让其口服聚乙二醇电解质散,以清洁肠道。对APC 组患者进行APC,方法是:采用德国ERBE 公司生产的内镜系统进行手术,该系统配备APC300 高频电流发生器(即氩气发生器),将氩气流量设为2 L/min,将功率设为50 ~60 W(治疗右半结肠息肉时将功率设为50 W,治疗左半结肠息肉时将功率设为60 W)。经肛门置入电子肠镜,在电子肠镜下找到息肉组织,观察息肉的位置、大小和数量。若息肉为广基扁平或亚蒂息肉,经内镜钳道插入氩离子凝固器导管,使导管伸出内镜头端,直至病灶上方0.5 ~1 cm 处。对息肉进行烧灼,单次烧灼的时间为1 ~3 s,直至病灶表面泛白泛黄或出现黝黑样变。灼除息肉后,可见肠黏膜平坦或略微凹陷。根据息肉的大小和质地决定烧灼的次数,反复进行烧灼,直至灼除所有息肉。对于有蒂息肉,采用ICC200 高频电切圈套器将息肉切除,并用APC300 探头对残余组织进行凝固。对CSP 组患者进行CSP,方法是:经肛门置入电子肠镜,稍吸出肠腔气体,在电子肠镜下找到息肉组织,观察息肉的位置、大小和数量。将内镜置于视野下5 点钟方向的息肉位置,稳定镜身,在息肉上端展开圈套器(Olympus 圈套器,型号为SD-210U-10),套住息肉周边1 ~2 mm 的肠黏膜组织,持续缓慢地收紧圈套器,在不上提圈套器的前提下,勒断息肉组织,确保将息肉边缘1 ~2 mm 的肠黏膜切除。
1.3 观察指标
比较两组患者息肉的清除率、术后病情复发的情况及并发症的发生率。
1.4 统计学方法
用SPSS 21.0 软件处理本研究中的数据,计量资料用±s表示,用t检验,计数资料用% 表示,用χ² 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者息肉清除率的比较
术后对两组患者进行结肠镜复查的结果显示,CSP 组患者的58 枚结直肠息肉被完全清除,APC组患者术后在进行结肠镜复查时发现遗漏2 枚息肉,对2 枚息肉进行病理学检查显示其均为绒毛状腺瘤,均伴有轻度分化不良,再次实施APC 将2 枚息肉完全切除。CSP 组患者息肉的切除率略高于APC 组患者,但组间相比差异无统计学意义(P>0.05)。详见表2。

表2 两组患者息肉清除率的比较[%(枚/ 枚)]
2.2 术后两组患者病情复发情况的比较
分别于术后1 个月、6 个月及12 个月对两组患者进行结肠镜复查,结果显示,两组患者在术后12 个月内均无病情复发的迹象。
2.3 两组患者术后并发症发生率的比较
APC 组患者术后并发症的发生率为23.33%,CSP 组患者术后并发症的发生率为6.67%,二者相比差异有统计学意义(P<0.05)。详见表3。

表3 两组患者术后并发症发生率的比较
3 讨论
结直肠息肉是消化内科的常见病。近年来随着肠镜诊断技术的发展及普及,结直肠息肉的检出率明显升高。结直肠息肉可单发,也可多发,其发病率为1.6% ~12.0%。临床上将结直肠息肉定义为结直肠黏膜突出于肠腔的局限性隆起病变。临床上根据结直肠息肉的病理性质将其分为肿瘤性息肉和非肿瘤性息肉,其中肿瘤性息肉的上皮细胞增生活跃,可发生恶变。此外,合并有上皮内瘤变的非肿瘤性息肉也有发生恶变的可能。流行病学调查显示,我国结直肠癌的发病率很高,仅次于肺癌和胃癌,在所有恶性肿瘤中居于第三位[3]。目前临床上尚未彻底阐明结直肠息肉的发病原因或机制,一般认为此病的发生与遗传因素、饮食因素、年龄因素、炎症刺激因素等有关。临床上根据结直肠息肉的体积,将其分为微型息肉(直径≤5 mm)、小型息肉(直径为6 ~9 mm)、大型息肉(直径为10 ~30 mm)和巨大息肉(直径>30 mm)。研究指出,结直肠息肉的恶变风险与息肉的体积呈正相关。最新的研究发现,结直肠息肉的体积越大,进展为腺癌的风险越高,此外即使是微型息肉,也有9% ~10% 的恶变几率。因此,专科医师建议对结直肠息肉应做到早发现、早诊断和早治疗,以切断其癌变的路径,降低结直肠癌的发病率[3-4]。目前临床上治疗结直肠息肉的手术方式主要有冷/ 热圈套切术、活检钳夹术、APC、内镜下黏膜切除术(EMR)等,其中使用频次最高的是APC 和CSP[5]。本研究的结果显示,CSP 组患者息肉的切除率略高于APC 组患者,但组间相比差异无统计学意义(P>0.05)。术后12个月内两组患者的病情均未复发。CSP 组患者术后并发症的发生率低于APC 组患者,差异有统计学意义(P<0.05)。可见,用CSP 与APC 治疗结直肠微型及小型息肉的效果相当,但患者在进行CSP 后并发症的发生率更低,治疗的安全性更高。与CSP 相比,APC 虽然可多向凝固,且凝固的深度有自限性,但易引发肠管扩张,导致肠壁的薄弱处因手术操作而发生出血或穿孔[6]。CSP在处理小息肉方面具有独特的优势,引起肠道出血和穿孔的概率极低,但该手术不适用于体积较大的息肉。本研究筛选的对象均为小型息肉患者,故采用CSP 对其进行治疗更具临床优势。
综上所述,用CSP 与APC 治疗结直肠微型及小型息肉的效果相近,但CSP 具有高效快速、创伤轻微及术后患者的并发症少等优势,而APC 在切除大息肉方面具有显著优势。这两种术式各有优势和不足,故临床上应根据结直肠息肉的类型合理选择手术方式。

