全球基因编辑技术专利布局与发展态势分析*
钟 华 胥美美 苟 欢 安新颖*
(中国医学科学院医学信息研究所,北京 100020)
基因编辑(Gene Editing)是指对基因组进行定点修饰的一项基因工程技术[1],其通过对目标基因进行删除、替换、插入等操作,以获得新的功能或表型[2]。作为生命科学迅速发展的重要研究领域,目前基因编辑技术主要包括锌指核酸酶(Zinc-Finger Nucleases,ZFNs)、转录激活因子样效应物核酸酶(Transcription Activator-Like Effector Nucleases,TALENs)、规律成簇的间隔短回文重复(Clustered Regularly Interspaced Short Palindromic Repeats,CRISPR)、单碱基编辑(Base Editing,BE)及先导编辑(Prime Editing,PE)等[3]。基因编辑技术已应用于生命科学多个领域,在动物疾病模型研究、植物遗传改良、遗传性疾病以及非遗传性疾病的治疗中显示出较高的应用价值[4],不断拓展对生物体遗传改造的深度和广度,为科学发展提供了新的研究与应用方案。
目前基因编辑技术已成为各主要国家在国家战略层面重点支持的领域[5],也是各国科研机构、高校、企业重点投入的技术领域。近年来,我国在基因编辑技术开发上取得了一定突破。2017年,中科院遗传与发育生物学研究所等机构的研究人员利用Cas9变体(nCas9-D10A)融合大鼠胞嘧啶脱氨酶(rAPOBEC1)和尿嘧啶糖基化酶抑制剂(Uracil Glycosylase Inhibitor,UGI),构成了高效的植物单碱基编辑系统nCas9-PBE,成功地在三大重要农作物(小麦、水稻和玉米)基因组中实现高效、精确的单碱基定点突变[6]。2019年陈虎、邓宏魁、吴昊教授等团队合作,首次利用CRISPRCas9在HSPCs中编辑CCR5基因并成功移植到罹患 HIV和急性淋巴细胞白血病的患者[7]。2020年华西医院卢铀教授团队利用CRISPR-Cas9基因编辑技术在体外T细胞中编辑PD-1基因,经体外T细胞培养扩增,再输回非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)受试者,首次证明了该疗法在NSCLC中的安全性和可行性[8]。虽然基因编辑在技术发展、机制研究、动植物模型和基因治疗等方面取得进展,但仍然存在许多挑战,例如通过整合基因递送载体或脱靶基因组编辑来处理基因毒性,将基因转移或编辑效率提高到能够有效治疗疾病的水平,解决重复体内施用载体引起的免疫应答,就有关争议的问题达成社会共识等[9],还需要在有效的技术和伦理监管下谨慎推进相关研究。
专利是科学技术成果的重要载体。专利分析方法已经较为广泛地应用于技术领域分析,一方面在制定科技发展路线图等科技发展战略规划时,可以用于协助审查技术研发情况并预测技术风险,并对科学合理地制定出各项技术的发展路线提供决策支持;另一方面可以帮助科研人员了解技术领域的发展阶段和现状,为其选择科学研究方向提供有力的情报支撑。本研究中,通过专利数据分析基因编辑技术发展阶段,以及技术主题-时间-机构之间的关联,能较好地对技术领域变化以及各机构技术实力进行判断,能更具结构化地展现不同研发机构在基因编辑技术发展过程中的相对优势,揭示全球及国内基因编辑技术专利布局、主要研发机构、研发合作关系、技术流向、技术主题及技术创新现状,并对我国基因编辑技术发展规划和布局提出建议,为科研人员和科技管理部门提供参考。
1 数据与方法
本文以Incopat专利数据库作为数据来源开展基因编辑技术相关专利检索,该数据库收录了全球120个国家、组织或地区,超过1.4亿件的专利文献,覆盖范围较全。采集范围为专利公开公告日在2016—2020年的发明专利授权数据。在Incopat数据库中,以 ZFN、TALEN、CRISPR、Gene、Genomic、Base Editing、Prime Editing等词进行组合检索(检索时间为2021年3月30日),检索策略:(TIAB=“gene Editing”OR TIAB=“gene editor*”OR TIAB=“genome Editing”OR TIAB=“genome editor*”OR TIAB=“DNA editing”OR TIAB=“DNA editor*”OR TIAB=“genome and epigenome editing”)OR(TIAB=(("Zinc Finger Nuclease*") OR ( "Zinc-finger endonuclease*") OR ("Zinc Finger Protein Nuclease*") OR ( ((Genome OR Gene OR Genetic OR DNA OR RNA OR"zinc-finger")AND ZFN)NOT“ZFN 361”)OR((Genome OR Gene OR Genetic OR DNA OR RNA OR"zinc-finger")AND ZFNs)))OR (TIAB=(“Transcription*Activator-Like Effector Nuclease*”OR“Transcription*Activator*Like Effector Nuclease*”OR “TALE nuclease*”OR “TAL Effector Nuclease*”OR“transcription activator-like effector endonuclease*”OR((Genome OR Gene OR Genetic OR DNA OR RNA OR Nuclease OR ZFNs OR CRISPR)AND TALEN)OR(((Genome OR Gene OR Genetic OR DNA OR RNA OR Nuclease OR ZFNs OR CRISPR)AND TALENs)NOT“Talens,R.P.”)))OR(TIAB=("Clustered Regularly Interspaced Short Palindromic repeat*"OR CRISPR*))OR(TIAB=("prime editing"OR"prime editor")OR((TIAB="base editing")NOT(TIAB=("knowledge base editing"OR"case base editing")))OR((TIAB="base editor")NOT(TIAB=("knowledge base editor"OR"database editor"OR"multimedia"OR"visual modeling"OR"Semantic Annotation"))。检索结果经过数据清洗、人工剔除和专家判读,得到全球范围内发明专利授权1477项。基于上述数据,本文构建基因编辑技术专利数据集合,利用德温特数据分析软件(Derwent Data Analyzer,DDA)、VOSviewer和Excel等工具对技术概况、专利发明人、机构合作及技术流向等开展分析。
2 基因编辑技术发展态势分析
2.1 基因编辑技术发明专利授权数量年度变化趋势
通过对2016—2020年基因编辑技术发明专利授权数量年度情况进行分析,可以发现,近年来基因编辑技术专利布局总体呈快速增长趋势,2017年以后全球基因编辑技术发明专利授权数量突破百项,2020年的发明专利授权数量达到626项(图1)。
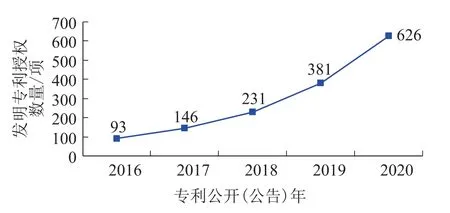
图1 全球基因编辑技术发明专利授权数量年度变化趋势Fig.1 Annual Trend of Global Gene Editing Technology Invention Patents
2.2 基因编辑技术专利受理国家(地区)及技术流向分析
专利保护具有地域性和空间性的限制,一个国家或地区仅保护在该国(地区)申请并获得专利权的发明创造。因此一项技术在同一地域内申请的专利数量越多,就能形成更全面的技术覆盖度和技术保护范围,其技术市场化后形成的产品也会得到更为全面的地域保护和市场竞争力[10]。通过基因编辑技术专利来源国和受理国分布情况,可分析基因编辑技术研发的优势国家及主要技术市场。本文从专利受理国和专利来源国维度,分析2016—2020年期间各国技术输入和输出情况(图2~4)。全球基因编辑技术发明专利授权数量最多的是中国和美国,中美两国是行业中受关注度较高的技术和产品目标市场;通过欧洲专利申请可以在欧洲专利局指定多个成员国获得保护,因此通过欧洲专利局途径进行专利申请也是各机构进行全球技术布局的有效途径之一。
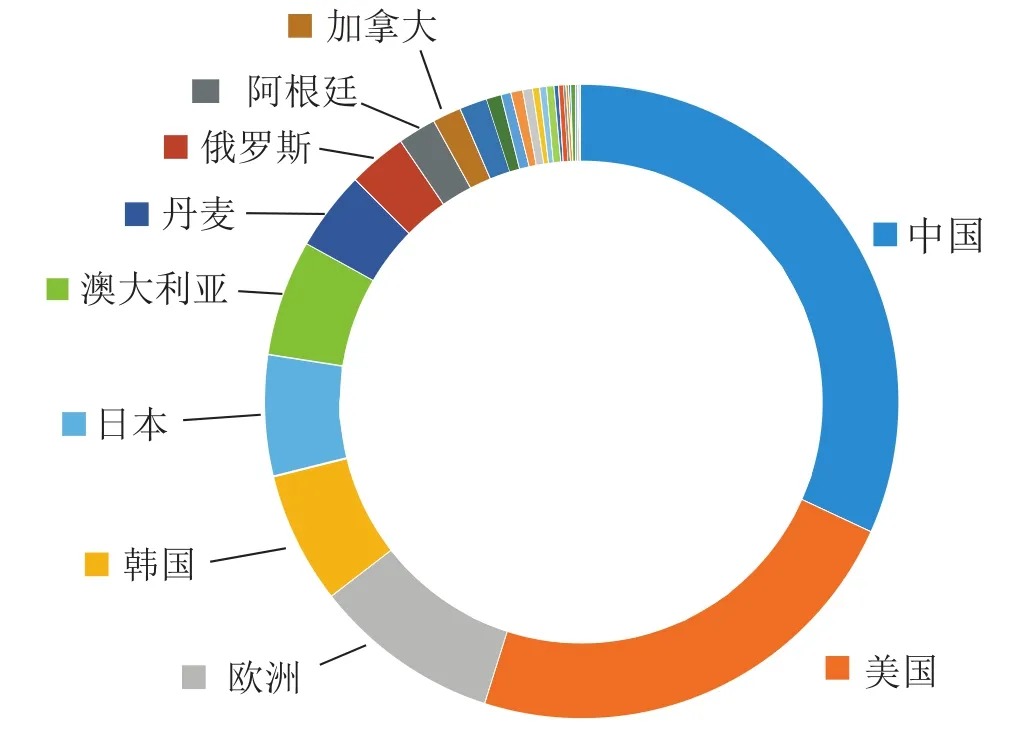
图2 2016—2020年全球基因编辑发明专利授权的技术市场国家(地区)(专利受理国)Fig.2 2016-2020 Global Gene Editing Granted Patents Technology Market Countries(Regions)(Patent Granted Country)

图3 2016—2020年全球基因编辑发明专利授权的技术来源国家(地区)(专利来源国)Fig.3 2016-2020 Global Gene Editing Granted Patents Technology Source Countries(Regions)(Patent Source Country)
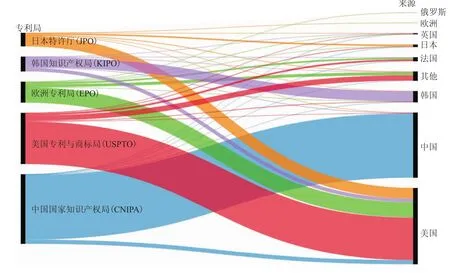
图4 基因编辑技术专利技术流向Fig.4 Gene Editing Technology Patent Flow
在美国专利局申请的基因编辑技术专利,其技术来源国除美国本土外,覆盖范围较广,包括法国、加拿大、瑞士、荷兰、丹麦、韩国等国家。中国近90%的基因编辑技术专利都来源于本国,约5%的基因编辑技术的专利来源国是美国,其余来自法国、韩国、日本等国家。
2.3 基因编辑技术主要研发机构发明专利授权情况
2.3.1 全球基因编辑技术主要机构情况
通过分析全球专利申请人的分布情况,可以揭示技术优势研发机构,约有3000多家机构活跃在基因编辑技术研发领域,优势研发机构主要来自美国、中国、法国等,美国的布罗德研究所、麻省理工学院、哈佛大学是此领域的主要申请人(表1)。布罗德研究所的基因编辑技术发明专利授权数量最多,为121项,美国麻省理工学院的基因编辑技术发明专利授权数量为116项,哈佛大学为102项,且三个机构多为共同申请;从图5显示的基因编辑技术全球主要研发机构专利合作情况,可以看到三者以布罗德研究所为中心形成高度紧密合作关系。中国科学院发明专利授权量为54项,但中科院下属各所院间在基因编辑技术合作较弱,没有形成协同研发态势。

表1 2016—2020年全球基因编辑技术发明专利授权数量前21家机构Tab.1 2016-2020 Top 21 Institutions of Gene Editing Granted Patents
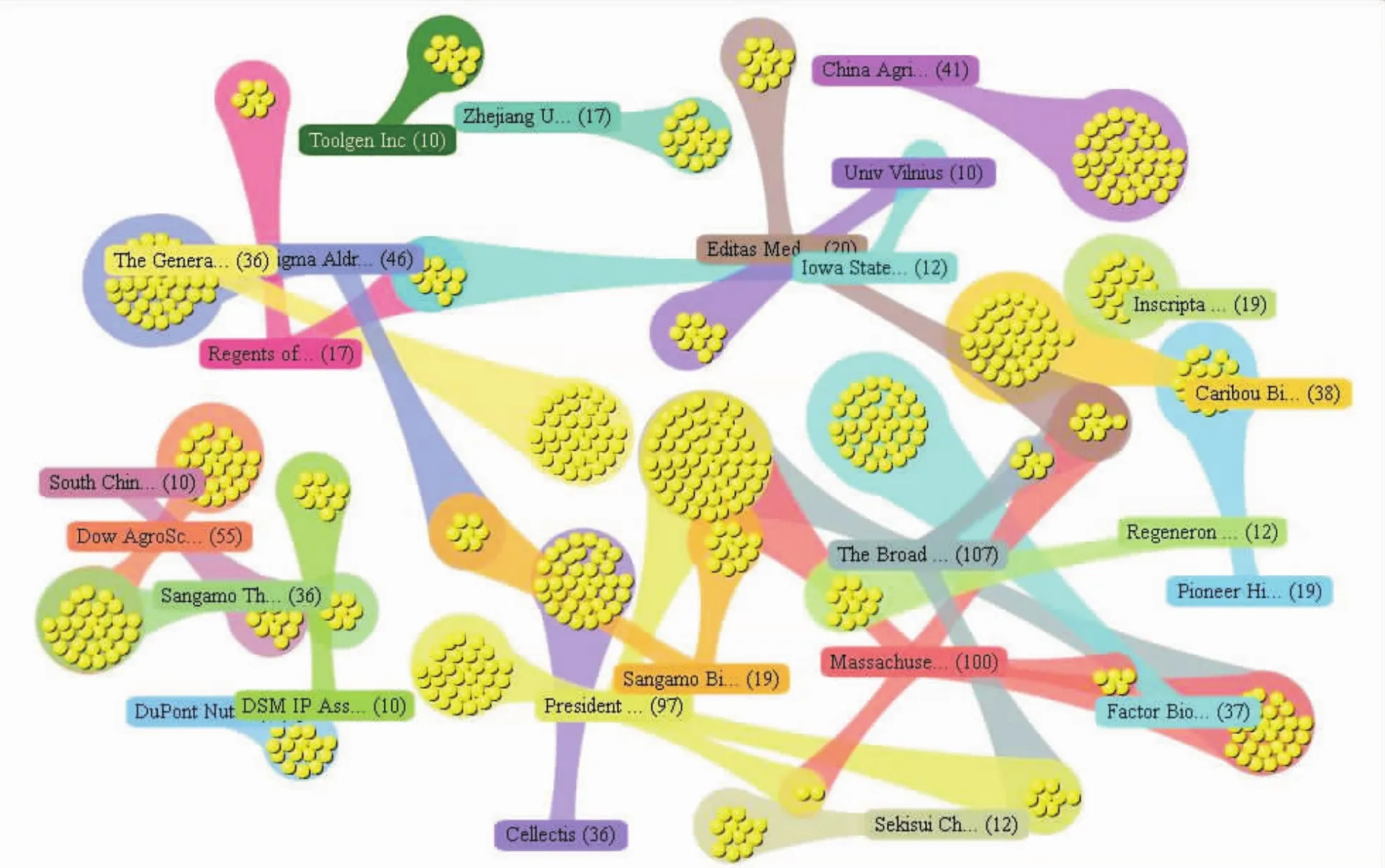
图5 基因编辑技术全球主要研发机构专利合作情况Fig.5 Patent Cooperation of Major R&D Institutions of Gene Editing In The World
美国布罗德研究所(The Broad Institute Inc)是世界顶尖水平的基因组学研究中心,其目标是用系统方法来确定疾病的根本生物学原因并寻找治疗干预的新机会,缩小生物学研究与临床治疗间的差距,并通过发明新技术、构建和实施计算工具、开发新疗法以推进临床应用。该研究所早在2013年就开始布局基因编辑技术的相关专利,2016—2020年共获得基因编辑技术发明专利授权121件。CRISPR-Cas系统是布罗德研究所最重视的基因编辑技术主题,共布局了56项专利,在CRISPR-Cas系统及其载体、递送、组合物、gRNA技术方面有多项专利获授权。
美国麻省理工学院(Massachusetts Institute of Technology,MIT)的临床研究中心在CRISPR基因编辑技术研发领域处于世界领先地位。MIT早在2013年就开始布局基因编辑相关专利,2016—2020年共获得发明专利授权116项。CRISPR基因编辑技术是麻省理工学院最重视的技术研发方向,共布局58项专利,在CRISPR基因编辑技术及其靶向、载体、递送和治疗应用领域,以及基因序列操作的系统、方法和优化方面有多项专利获授权。
美国哈佛大学(President And Fellows of Harvard College)下属医学院、研究所和干细胞研究所等机构都开展基因编辑相关研究,并在CRISPR基因编辑技术领域处于世界领先地位。哈佛大学早在2012年就开始布局基因编辑相关专利,2016—2020年共获得基因编辑技术发明专利授权102项。CRISPR-Cas系统是哈佛大学最重视的基因编辑技术主题,共布局了16项专利,有新型CRISPR酶及其系统、CRISPR-Cas系统及其载体、递送、组合物方面有多项专利获授权,此外用于序列操作的CRISPR-Cas组件系统、方法和组合物也是其布局重点。
美国陶氏益农公司(Dow Agrosciences LLC)是领先世界的五大农药跨国公司之一,是美国陶氏化学的全资子公司,在植物基因编辑技术研发处于世界领先地位。2016—2020年共获得基因编辑技术相关发明专利授权77件。FAD2和FAD3基因的研究和应用是美国陶氏益农公司最重视的基因编辑技术主题,共布局了17项专利,并在诱导靶向断裂的FAD2/FAD3性能位点技术领域布局了4项专利。
2.3.2 国内基因编辑技术主要机构情况
国内基因编辑技术的主要专利权人和国外相比有较大差异,从表2可见国内主要研发机构以高校和科研院所为主。其中,中国科学院、中国国农业科学院、浙江大学在此期间发明专利授权数量最多。

表2 2016—2020年国内基因编辑技术发明专利授权数量前22家机构Tab.2 2016-2020 Top 22 Institutions of Gene Editing Granted Patents in China
中国科学院(Chinese Academy of Sciences)的广州生物医药与健康研究院、上海生命科学研究院和天津工业生物技术研究所等所院都在开展基因编辑技术相关研究,2016—2020年共获得基因编辑技术相关发明专利授权54件。CRISPR/Cas9系统是中国科学院较为重视的基因编辑技术主题,总共布局10项专利,在bHLH73蛋白、LEPTO1及其编码蛋白、AP1基因突变体和OsSWEET13基因突变体方面有多项专利获授权。
中国农业科学院(Chinese Academy of Agricultural Sciences)由深圳农业基因组研究所、生物技术研究所和哈尔滨兽医研究所等在开展基因编辑相关研究。2016—2020年共获得基因编辑技术相关发明专利授权25项,主要在CRISPR-Cas系统及其载体、递送、组合物等方面进行布局。
浙江大学(Zhejiang University)主要是生命科学研究所、医学院和化学系等开展基因编辑相关研究。2016—2020年共获得基因编辑技术相关发明专利授权17项,集中在CRISPR-Cas系统测试、应用等方面。
2.4 基因编辑技术专利发明人分析
2.4.1 全球基因编辑技术专利发明人分析
从全球基因编辑技术专利的发明人来看(图6),美国麻省理工学院张锋(Zhang Feng)教授一直从事基因修饰技术CRISPR-Cas9的发展和应用,在此技术领域率先获得了美国专利并形成专利族群,在CRISPR相关基因编辑技术发明专利授权数量上处于领先位置。Factor Bioscience公司的Mattew Angel和Christopher B Rohde等持续探索利用先进的基因编辑和细胞治疗技术推进疾病疗法。通过分析基因编辑技术重点发明人及其研究团队,并对相关专利发明人合作关系进行分析(图7),从全球来看基因编辑技术呈现由核心研发人员引领的多研发团队格局。

图6 2016—2020年全球基因编辑技术发明专利授权的主要发明人情况Fig.6 2016-2020 Main Inventor of Global Granted Patents in Gene Editing
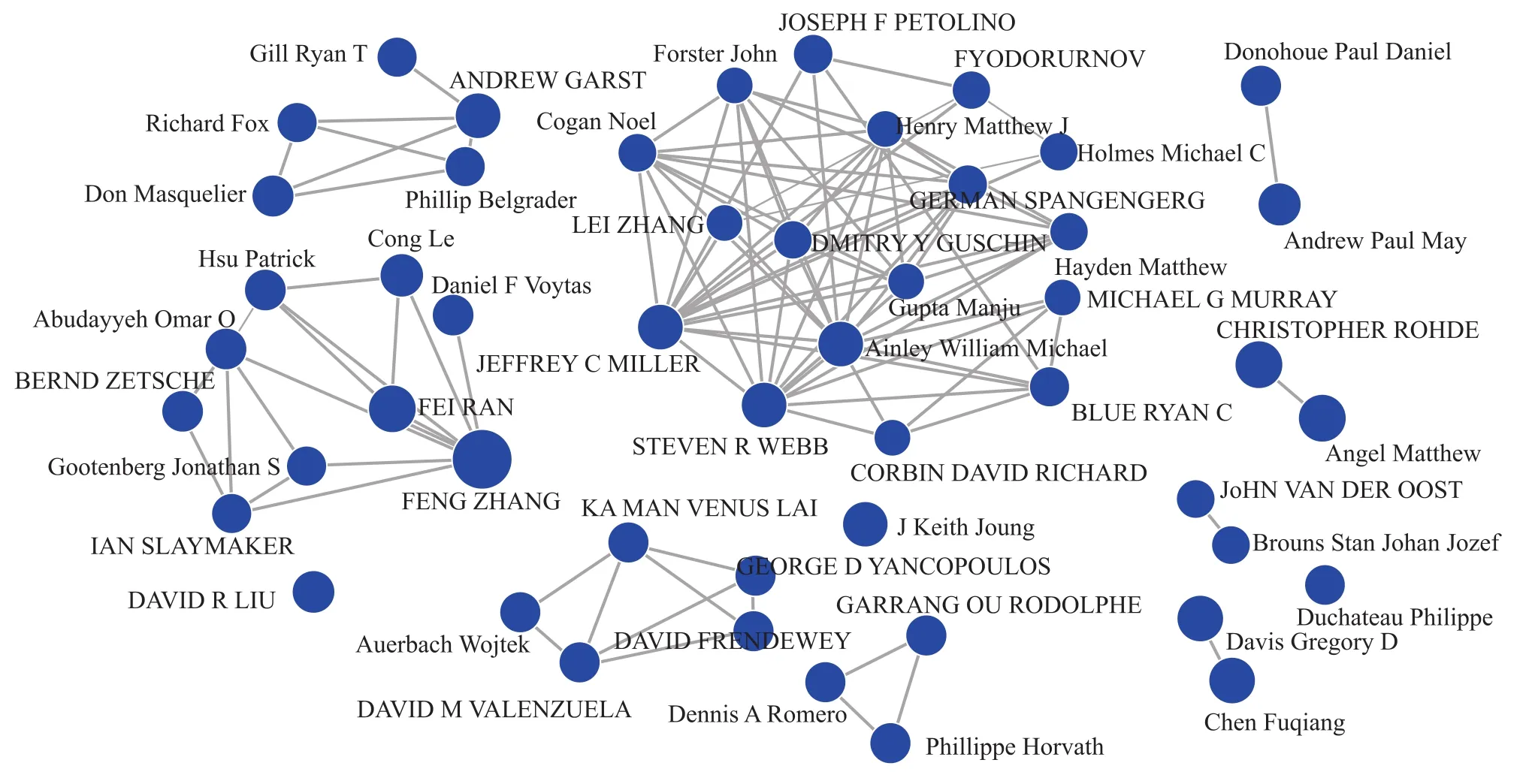
图7 2016—2020年全球基因编辑技术主要发明人合作情况Fig.7 2016-2020 Cooperation of Major Inventors of Global Granted Patents in Gene Editing
张锋团队中,张锋是麻省理工学院终身教授、布罗德研究所核心成员,致力于研发和应用新型分子技术研究神经系统疾病以及精神疾病等复杂疾病。他率先研发基因编辑CRISPR技术,是基因编辑和光遗传技术研究的先驱,2016—2020年获得基因编辑技术相关发明专利授权91项。Fei Ann Ran是张锋实验室研究成员,共同在自然微生物CRISPR系统用于真核细胞(包括人类细胞)的基因编辑工具开发方面做出了最前沿的探索,2016—2020年有40项基因编辑技术发明专利授权。
Mattew Angel是 Factor Bioscience联合创始人、董事长兼首席执行官,致力于生物技术研究和新药开发,不断扩大Factor公司专利组合规模,其中包括首个涉及RNA重编程技术的专利。2013年入选Meselson奖。2016—2020年有基因编辑技术发明专利授权37项。
Christopher B Rohde是NovellusInc.的联合创始人兼总裁、Factor Bioscience的联合创始人。2016—2020年有基因编辑技术发明专利授权37项。
William Michael Ainley和Jeffrey Conrath Miller均来自美国陶氏益农公司,开展 FAD3/FAD2性能基因座的相关研究。2016—2020年共同获得基因编辑技术发明专利授权35项。
2.4.2 国内基因编辑技术专利发明人
国内基因编辑技术专利发明人在申请数量上较为平均,主要发明人研究大多集中在动植物基因修饰方面,各研发团队内部合作紧密,但团队间处于较为独立的状态,跨机构联合研发较少,缺少领域内技术研发领军人才和团队(表3、图8)。

表3 2016—2020年国内基因编辑技术发明专利授权的主要发明人情况Tab.3 2016-2020 Main Inventor of Granted Patents in Gene Editing in China

图8 2016—2020年基因编辑国内主要发明人合作情况Fig.8 2016-2020 Cooperation of Major Inventors of Granted Patents in Gene Editing in China
李秋艳、李志远为中国农业大学团队成员。该团队在基因敲除猪研究方面取得重要进展,和李宁教授开展合作研发,利用CRISPR/Cas9的基因编辑技术,低成本、高效率地制备Fbxo40基因敲除猪,为研究肌肉发育及肌肉相关疾病提供了动物模型;团队还研究常染色体显性多囊肾病基因突变猪,该技术可用于常染色体显性多囊肾病的研究及药物筛选。2016—2020年该团队李秋艳获得基因编辑技术发明专利授权6项,李志远获得基因编辑技术发明专利授权5项。
王克剑、王春为中国水稻研究所水稻生物学国家重点实验室团队成员。团队致力于遗传重组机制及应用研究、植物繁殖习性研究、水稻重要农艺性状基因克隆及功能研究。2016—2020年,获得基因编辑技术发明专利授权6项,其中与中国热带农业科学院黄华孙团队合作专利5项。
黄华孙、华玉伟、戴雪梅、杨先锋、范月婷、辛士超为中国热带农业科学院橡胶所团队成员。该团队与中国水稻研究所王克剑研究员团队开展合作研发,在橡胶树CRISPR/Cas9质粒编辑体系研究方面取得重要进展,率先建立橡胶树CRISPR/Cas9基因编辑体系,克隆了5个橡胶内源的HbU6基因的启动子用于构建CRISPR/Cas9原生质体瞬时转化编辑载体。2016—2020年,获得基因编辑技术发明专利授权5项。
2.5 基因编辑技术主题领域
从2016—2020年基因编辑技术发明专利高频关键词(图9)及国际主要技术领域分布(图10)情况来看,基因编辑主要技术领域覆盖基因治疗(A61K48/00)、遗传突变工程(C12N15)中分离制备或纯化DNA或RNA的方法(C12N15/10)、DNA或 RNA片段(C12N15/11)、调节基因表达的非编码核酸(C12N15/113)、用于植物细胞(C12N15/82)、用于动物细胞(C12N15/85)、使用载体引入外来遗传物质(C12N15/63)、将外来DNA稳定地引入染色体中(C12N15/90)和核糖核酸酶(C12N9/22)和经引入外来遗传物质而修饰的细胞,如病毒转化的细胞(C12N5/10)等领域,近五年来热点主要集中以CRISPR/Cas9系统为代表的新型技术,基因编辑研究和应用领域也不断迅速拓展到农业、科研、临床治疗等领域,在建立细胞模型新药开发、新型动物模型开发建立、细胞工程改造,以及蛋白产物糖基化水平优化等方面应用广泛。

图9 2016—2020年全球基因编辑发明专利高频关键词云图Fig.9 2016-2020 Global Gene Editing Granted Patents High Frequency Keyword Cloud Map

图10 2016—2020年全球基因编辑技术领域分布Fig.10 2016-2020 Global Distribution of Gene Editing Granted Patents in Major Technical Fields
3 总结和建议
本文面向揭示基因编辑专利技术研发态势的客观需求,基于2016—2020年基因编辑技术全球发明专利授权数据,对技术概况、主要研发机构、研发合作关系、技术流向、技术主题、技术创新现状进行分析,并对我国基因编辑技术发展提出建议:
1)从全球专利总体发展态势看,基因编辑技术总体自2016年后呈现快速增长趋势,以ZFN和TALEN为代表的序列特异性核酸酶技术在基础研究、基因治疗和遗传改良等方面展示出了巨大潜力[11],一度成为各国主流基因编辑技术,此后CRISPR技术掀起研发高潮,成为基因编辑技术的主要研发方向。基因编辑技术从科学研究在应用转化过程中,得到了较为有效的推广。基因编辑技术优势研发机构主要集中在美国,从国内来看,2016—2020年中国科学院、中国农业科学院等国家级科研机构在基因编辑技术处于研发前列。
2)从核心专利技术数量分析,目前我国基因编辑技术专利数量虽然已经位于各国前列,在部分领域甚至处于全球领先地位,但是大多数核心、源头技术的知识产权被国外掌控[12],尤其是在CRISPR/Cas9等核心专利上,我国基本处于技术外围。我国要推进基因编辑技术重大的源头性创新,解决基因科学领域“卡脖子”技术瓶颈,迫切需要建立基础性、原创性、具有全球知识产权的基因编辑技术体系,包括基于现有基础进行技术改进和增强、对现有基因编辑技术缺陷和不足进行修正、利用生物学新手段研发新型技术等,才能在国际基因组学技术领跑和转化应用中走在前沿。
3)从专利技术布局分析,我国基因编辑技术领域还有待拓展;根据专利技术主题分析结果,国内专利在微生物或酶及其组合物领域的比例最大,其余的主要分布在医用配制品、化合物或药物制剂的特定治疗活性、模式动物等几个领域。与美国等主要国家比较,我国对CRISPR等关键核心技术的系统改进较少,且主要集中在植物、农场动物或水产养殖领域,技术格局还有待全局性的优化调整。
4)从专利技术应用转化情况分析,我国发明专利授权中具有实质性技术成果转化的专利较少。在遵循科学伦理准则的前提下,基因组学的发展应重视基因编辑技术的转化应用,特别是在我国特有生物资源上的应用突破。虽然目前CRISPR/Cas等技术已经在各生物物种中应用,包括常见的斑马鱼、小鼠、猪、猴等动物,以及水稻、小麦等常见农作物,但在农业基因编辑的育种应用、面向临床疾病诊治、药物靶点筛查等方面仍大有可为,将现有基因编辑技术拓展到其他生物也是新的突破,尤其对于我国特有的生物资源,其过程往往涉及技术调整和改进,一方面可以产生新技术,另一方面可为目标生物的功能基因组研究以及遗传改良提供有效手段。虽然基因编辑技术作为生命科学的一项基础且重要的技术,在农业、科研及临床治疗方面得到了各国政府在科研方面的重视和支持[13-15],但是技术发展带来的伦理问题也需要进行有效把控,应构建并不断完善生物技术安全的法律法规体系,推动以基因编辑为代表的生物技术谨慎、有序、高质量的发展。
数据可用性声明
支撑本研究的科学数据已在中国科学院科学数据银行(Science Data Bank)ScienceDB平台公开发布,访问地址为 https://www.doi.org/[10.11922/sciencedb.j00053.00013]或 http://resolve.pid21.cn/[31253.11.sciencedb.j00053.00013]。

