2,3,7,8-四氯二苯二噁英诱导C57BL小鼠腭裂发病机制的研究
罗枭 蔡生青 石冰 李承浩
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院唇腭裂外科 成都 610041
作为口腔颌面部最常见的先天性畸形,唇腭裂病理机制并不明确,目前认为它是环境和遗传因素共同作用的结果。四氯二苯二噁英(tetrachlorodiphenyl dioxin,TCDD)是一种广泛的环境污染物,能够导致单纯性腭裂的发生,但具体机制仍不清楚[1]。研究[2]表明,TCDD并不影响腭板的生长、上抬、接触,却能干扰腭中嵴上皮细胞的黏附和消亡。
在TCDD作用下,小鼠腭中嵴上皮细胞表面的丝状伪足完全消失,腭中嵴上皮细胞形态由柱状变为扁平[3]。丝状伪足是上皮细胞的一种极性结构,细胞极性对于细胞功能的发挥有着重要的作用,极性的改变预示着细胞功能和命运的变化[4]。在细胞极性的建立和维持中,蛋白酶活化受体/非典型蛋白激酶C(protease-activated receptor/atypical protein kinase C,PAR/aPKC)复合体发挥着重要的作用[5]。PAR/aPKC复合体由3种蛋白组成,即PAR3、PAR6、aPKC,它们都属于PAR[6]。研究[7-9]证实,PAR/aPKC复合体在细胞极性维持与调节中起到重要作用。那么,PAR/aPKC复合物是否参与腭中嵴上皮细胞的形态维持与消亡从而影响腭发育呢?
β-连环蛋白作为经典Wnt信号通路的重要信号分子,在腭胚突的发育及腭裂的形成中同样发挥着重要的作用[10]。条件性敲除小鼠腭中嵴上皮细胞中的Catnb基因,腭中嵴上皮细胞同样不能正常凋亡而产生腭裂[11],这一表型与TCDD诱导腭裂极其相似。同时,β-连环蛋白作为黏附分子在上皮极性维持中起到重要作用。此外,研究[12]表明,β-连环蛋白与TCDD的关键受体AhR在胚胎发育、疾病发生中存在交互作用。因此,本研究将探讨β-连环蛋白是否协同PAR/aPKC复合体参与TCDD影响腭中嵴上皮细胞的极性和凋亡调节,从而导致腭裂。
1 材料和方法
1.1 材料
1.1.1 实验动物 8周龄C57BL小鼠(购自四川大学华西实验动物中心),无特定病原体(specific pathogen free,SPF)饲养。按照雌雄比2∶1的比例于18时合笼,次日晨8时探查雌鼠阴道栓,有阴道栓者定为胚胎0 d(embryonic day,E0)。
1.1.2 实验试剂和器材 兔抗PAR3抗体(11085-1-AP,ProteinTech公司,美国)、鼠抗PAR6b抗体(SC-17791,Santa Cruz公司,美国)、兔抗aPKC抗体(SC-216,Santa Cruz公司,美国)、兔抗β-连环蛋白抗体(D10A8,Cell Signaling Technology公司,美国)、免疫组织化学试剂盒(北京中杉金桥生物技术有限公司)、Western blot试剂盒(碧云天生物技术研究所)、Trizol试剂(Invitrogen公司,美国)、逆转录及荧光定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒[宝生物工程(大连)有限公司]。超净工作台和台式离心机(Thermo公司,德国)、体视显微镜(Olympus公司,日本)、电子天平(Strtorius公司,美国)、微量移液器(Gilson公司,法国)、倒置显微镜(Nikon公司,日本)、超纯水机(Millipore公司,美国)、PCR仪(BIO-RAD公司,美国)、-80℃超低温冰箱和高压蒸汽消毒器(Sanyo公司,日本)、紫外可见分光光度仪(NanoDrop公司,美国)。
1.2 方法
1.2.1 实验分组 取E12.5孕鼠,随机分为对照组和实验组,每组20只,分别称重并记录,按照体质量24μg·kg-1,实验组孕鼠胃饲质量浓度为4μg·mL-1的TCDD;对照组孕鼠胃饲蓖麻油。
1.2.2 标本的获取及染色 分别于E13.5、E14.5、E15.5、E18.5将实验组和对照组孕鼠引颈处死,75%乙醇溶液消毒1 min,无菌操作环境中取出胚胎。体视显微镜下将E18.5胚胎从口角剪开,去除下颌及舌体,充分暴露腭部,观察并记录腭融合及腭裂情况。实验组及对照组各取一只E13.5、E14.5、E15.5孕鼠,直视下剪取头部,在预冷的无菌PBS液中清洗3次,经后续处理后进行组织学观察。其余孕鼠按照Lu等[13]的操作,体视显微镜下剪开胚胎口角,去除下颌及舌体,充分暴露腭部,剪取腭胚突,在预冷的PBS液中清洗3次,经后续处理后进行基因、蛋白检测。
1.2.3 染色 将获取的胎鼠头部固定,脱水,透明,浸蜡,包埋后,制成6μm切片,切片脱蜡,水化。对标本行苏木精-伊红(hematoxylin-eosin,HE)染色后显微镜下观察腭部组织学形态。采用链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)法,使用兔抗β-连环蛋白抗体对标本进行免疫组织化学染色,DAB显色,苏木精轻度复染,脱水、透明后经中性树胶封片,通风厨内晾干后显微镜下观察。
1.2.4 Western blot检测 按照总蛋白提取试剂盒的操作说明书提取总蛋白,所有操作均冰上进行,然后进行总蛋白定量,按照Pierce BCA蛋白定量试剂盒说明进行操作,并进行凝胶电泳,完成后转膜、封闭、抗体孵育:将膜放置于含兔抗PAR3(1∶500),鼠抗PAR6b(1∶200),兔抗aPKC(1∶500)的抗体孵育袋中,4℃冰箱孵育过夜。TBST洗膜3次,每次5 min。将膜置于二抗稀释液中37℃孵育1 h。TBST洗膜3次,每次10 min。将增强型化学发光液(Millipore公司,美国)滴加在聚偏二氟乙烯膜上,充分抹匀,将膜置于BIORAD凝胶成像系统中采集图像,使用Quantity One v4.40软件进行分析。
1.2.5 RT-PCR检测 总RNA提取:按照Trizol(Invitrogen公司,美国)试剂说明书进行总RNA提取。RT-PCR检测:按照逆转录反应试剂盒说明书进行,具体如下:PAR3、PAR6[14]、aPKC、β-连环蛋白[15]基因引物见表1。目标基因的mRNA量以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,采用2-ΔΔct公式进行数据分析。

表1 引物序列Tab 1 The sequence of the primers
1.3 统计分析
采用SPSS 13.0统计分析软件进行数据分析。采用独立样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 腭发育及TCDD诱导腭裂的组织学观察
TCDD组胎鼠在E18.5全部发生腭裂,对照组未见腭裂产生,TCDD诱导腭裂的发生率为100%。组织学观察可见,E13.5时,TCDD组及对照组腭板均在舌体两侧垂直生长,腭板形态未见明显差异。E14.5时,对照组腭板抬升至舌体上面,两侧腭板在中线处接触,形成中嵴上皮带。TCDD组腭板同样抬升至舌体上面,但是两侧腭板并未紧密接触。E15.5时,对照组腭中嵴上皮带消失,腭板完全融合。TCDD组腭板仍然处于分离状态,腭裂形成(图1)。
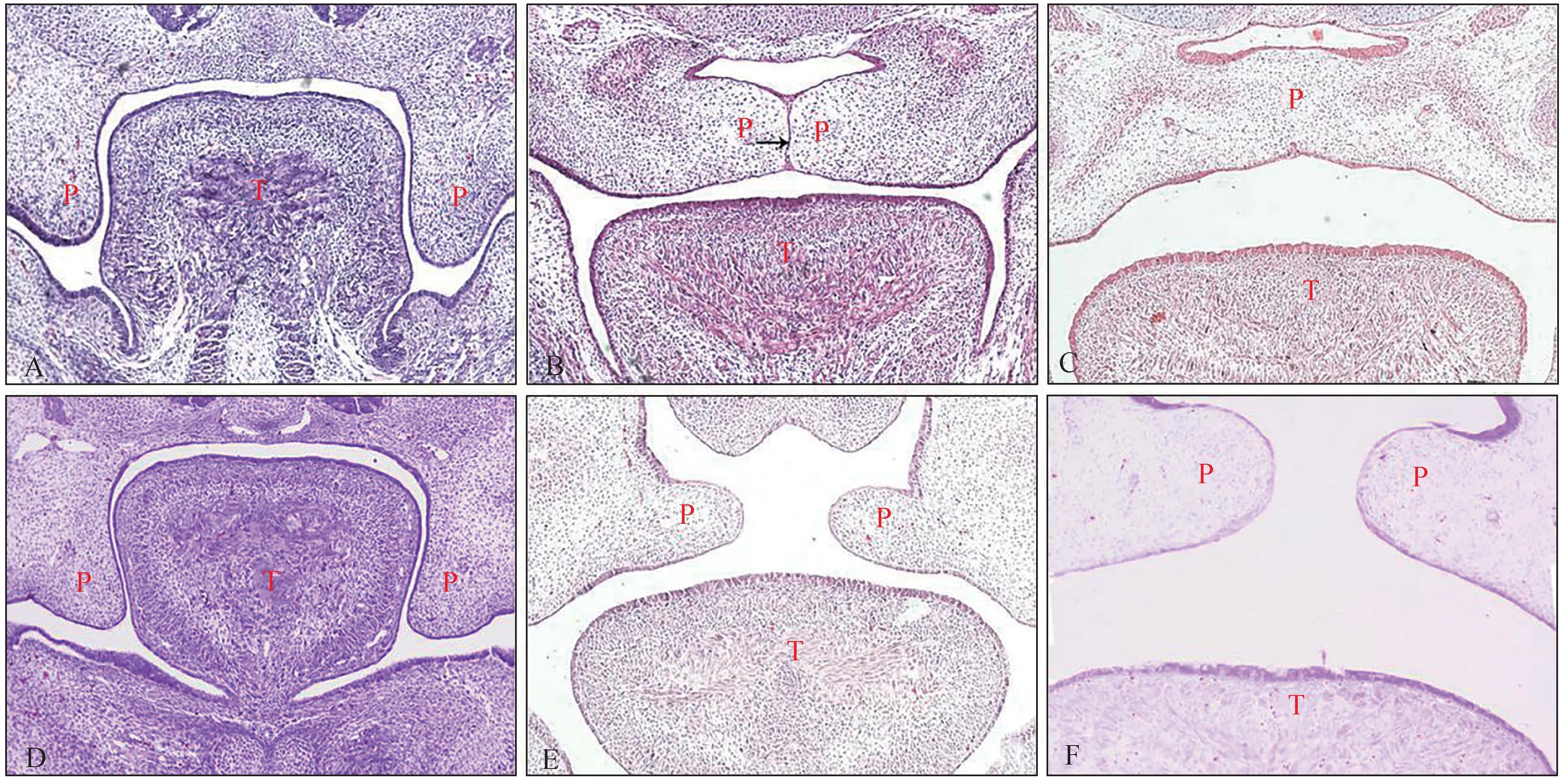
图1 对照组及TCDD组C57BL/6J小鼠腭胚突发育过程HE×10Fig 1 Palatal development of C57BL/6Jmice in control and TCDD groups HE ×10
2.2 PAR/aPKC复合体在腭发育中的规律表达
通过RT-PCR检测发现,对照组中PAR/aPKC复合体在E13.5表达最强。E14.5、E15.5时,PAR/aPKC复合体mRNA的表达减弱(图2)。为了进一步确认PAR/aPKC复合体在腭发育中的功能,进行了Western blot检测,结果同样证实PAR/aPKC复合体的表达随着腭发育而降低(图3)。这一结果提示,PAR/aPKC参与腭发育的进行和腭中嵴上皮细胞的形态维持。
2.3 TCDD干扰PAR/aPKC复合体在腭发育中的表达
RT-PCR结果显示,TCDD组PAR/aPKC复合体的表达无明显规律。其中PAR3在E13.5表达最强,E14.5、E15.5的表达量低于E13.5,但是E14.5与E15.5的表达无明显差异。PAR6的表达在E13.5、E14.5、E15.5无明显变化。aPKC的表达在E13.5最低,E14.5、E15.5依次升高。通过独立样本t检验对比分析对照组和TCDD组PAR/aPKC复合体在相应时间点的表达后发现,TCDD组PAR3、PAR6在E13.5、E14.5、E15.5的表达量明显低于对照组相应时间点的表达,二者间的差异具有统计学意义(P<0.001)。TCDD组中aPKC在E13.5的表达低于对照组,然而在E14.5、E15.5时,TCDD组aPKC的表达高于对照组(P<0.01)(图2)。Western blot在蛋白水平进一步证实了这一结果(图3)。
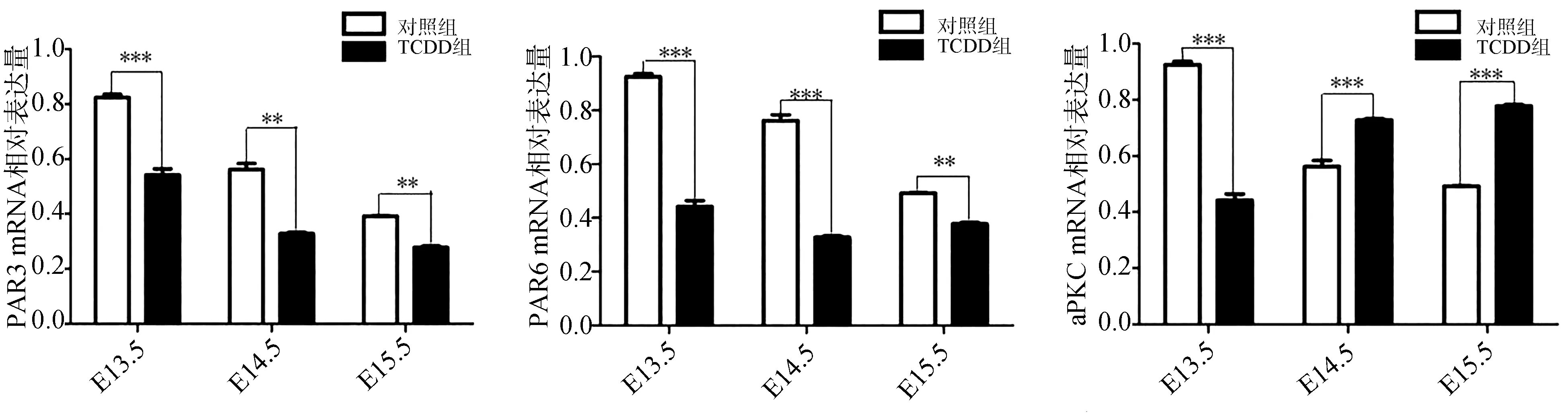
图2 RT-PCR检测PAR/aPKC复合体mRNA基因的表达Fig 2 Gene expression of PAR/aPKCcomplex by RT-PCR
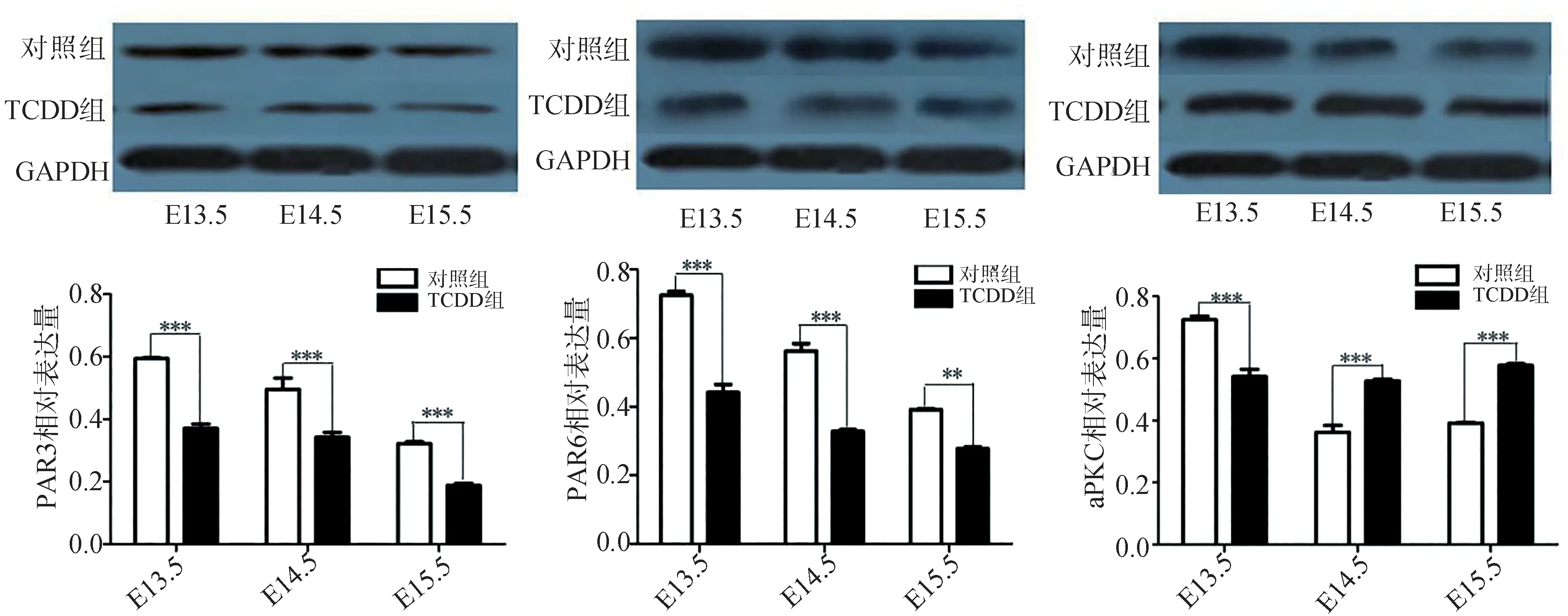
图3 Western blot检测PAR/aPKC复合体在蛋白水平的表达Fig 3 Protein expression of PAR/aPKCcomplex by Western blot
2.4 β-连环蛋白主要表达于腭中嵴上皮细胞
免疫组织化学染色显示β-连环蛋白在对照组E13.5、E14.5腭中嵴上皮细胞内呈强阳性表达,E15.5腭发育基本完成,腭中嵴上皮细胞消失。仅在口腔侧残留的尚未完全消失的腭中嵴上皮细胞内可见少量β-连环蛋白的表达(图4)。为了探究β-连环蛋白在腭发育过程中的表达规律,笔者进行了RT-PCR检测。结果显示,β-连环蛋白在E14.5表达最强,E13.5次之,E15.5表达最弱(图5)。
2.5 TCDD抑制β-连环蛋白在腭中嵴上皮细胞中的表达
免疫组织化学染色显示,TCDD组β-连环蛋白在E13.5、E14.5以及E15.5均表达于腭中嵴上皮细胞(图4)。RT-PCR分析显示,E13.5、E14.5时TCDD组β-连环蛋白的表达明显低于对照组(P<0.01)。E15.5时,TCDD组β-连环蛋白的表达高于对照组(图5)。
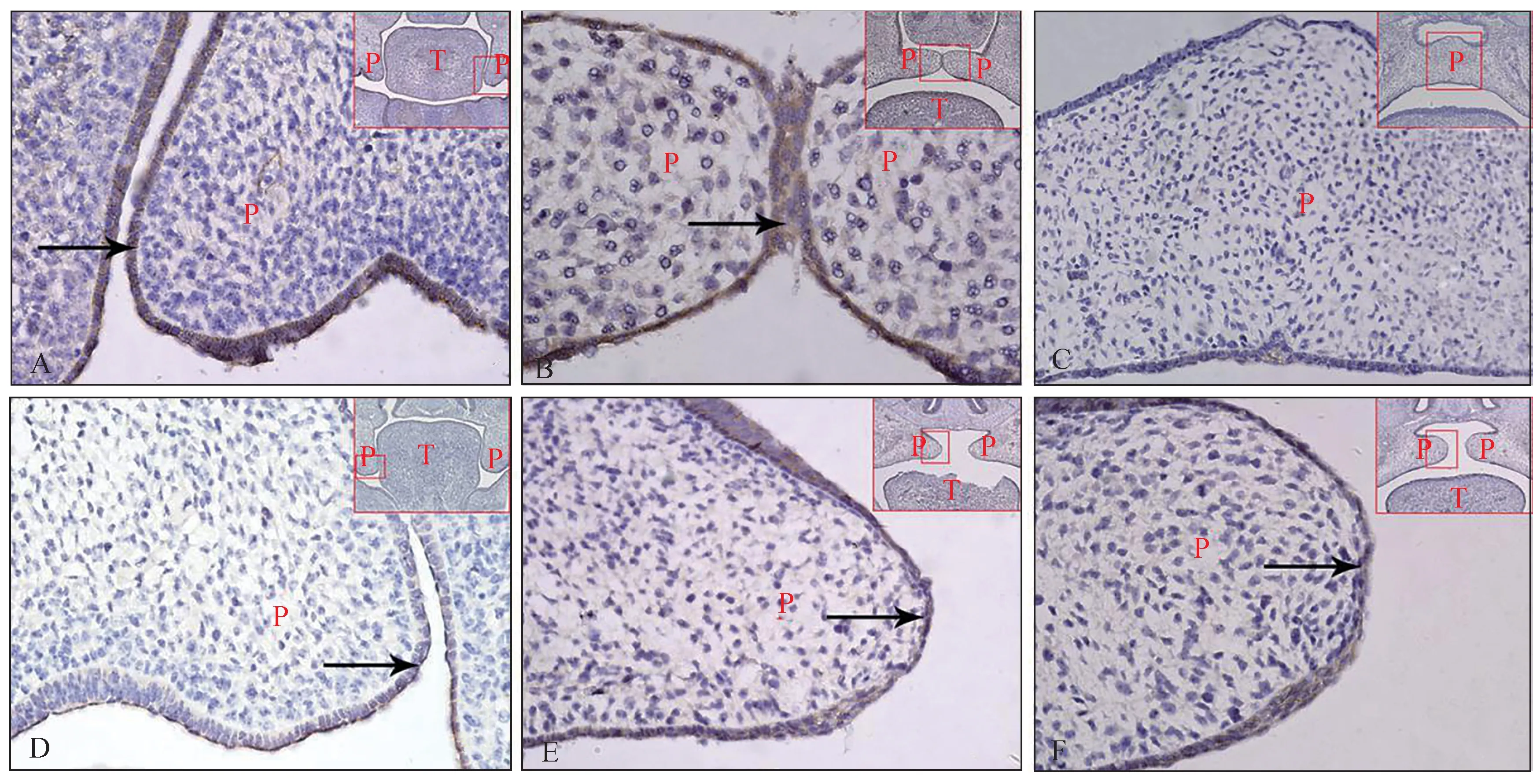
图4 β-连环蛋白在对照组和TCDD组腭中嵴上皮中的表达 SABC ×40Fig 4 β-Catenin expression in medial edge epithelium of control and TCDD groups SABC ×40
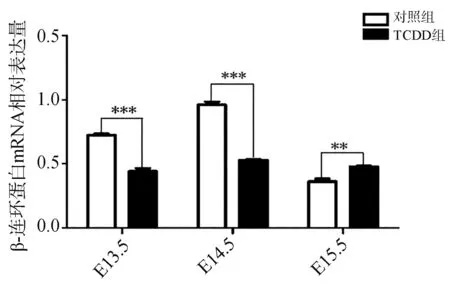
图5 RT-PCR检测β-连环蛋白在腭发育不同时间点的表达Fig 5 β-catenin expression at the different time of palatal development by RT-PCR
3 讨论
环境中的二噁英很难通过自然降解消除,易在生物体内积累,因而被称为“世纪之毒”。在自然界存在的300多种二噁英同类物中,以TCDD的毒性最大。TCDD来源广泛,能够诱导多种动物产生先天性腭裂。
研究[16-17]表明,TCDD并不影响腭板的垂直生长及上抬,但是在腭板的接触及融合期,腭中嵴上皮细胞形态和功能发生改变。细胞极性对于维持细胞形态、发挥功能具有重要的作用,细胞极性的调节参与细胞的迁移,上皮间充质转化。同时,细胞迁移、上皮间充质转化在腭中嵴上皮细胞的消亡、腭板的融合中发挥着重要的作用。这些研究提示,腭中嵴上皮细胞的极性对于腭发育具有重要的作用,同时TCDD有可能通过改变腭中嵴上皮细胞的极性而导致腭裂。PAR/aPKC复合体作为一种高度保守的细胞极性蛋白,对于细胞极性的建立和维持发挥着重要的作用。不仅如此,PAR/aPKC复合体还参与上皮间充质转化。β-连环蛋白参与细胞的黏附、迁移[18-19],而腭中嵴上皮细胞的黏附、迁移障碍正是腭裂畸形产生的机制之一;β-连环蛋白是Wnt信号通路的重要转导因子,而Wnt信号通路在腭发育以及腭裂形成中具有重要作用,并且敲除Catnb基因可以导致腭裂畸形;β-连环蛋白与AhR受体之间存在交互作用,而AhR正是TCDD的主要受体之一[20]。
本研究通过HE染色、免疫组织化学染色、RT-PCR、Western blot发现:1)腭发育的过程中,PAR/aPKC复合体呈现由高到低的变化规律,这一结果提示,腭中嵴上皮细胞的细胞极性在腭发育中存在由高到低的规律变化;2)TCDD诱导腭裂中,PAR/aPKC复合体的表达受到干扰,提示TCDD有可能通过干扰PAR/aPKC复合体的表达,引起腭中嵴上皮细胞的极性改变,从而导致腭裂;3)腭发育的关键阶段,β-连环蛋白在腭中嵴上皮细胞内呈强阳性表达,这揭示了β-连环蛋白在腭发育中的重要作用;4)TCDD诱导腭裂中,β-连环蛋白在腭中嵴上皮细胞中的表达降低。据此可以推测,TCDD有可能通过抑制β-连环蛋白表达而影响腭中嵴上皮细胞的消亡,从而引发腭裂。
通过本研究,笔者发现了TCDD能够干扰腭中嵴上皮细胞中PAR/aPKC复合体的表达,但是具体的分子调控机制还未能阐明。TCDD能够同时改变PAR/aPKC复合体以及β-连环蛋白的表达从而影响腭中嵴上皮细胞的极性改变和凋亡,但对于二者之间的内在联系还有待进一步研究。
利益冲突声明:作者声明本文无利益冲突。

