基于适配体吸附金纳米颗粒比色传感检测组胺
罗 倩,鲁 迨,黄晨涛,石星波*
(湖南农业大学食品科学技术学院,食品科学与生物技术湖南省重点实验室,食品安全微纳生物传感技术课题组,湖南 长沙 410128)
组胺是一种生物胺,在人体的各种生理和病理过程中作为重要的生物源性介质,一定浓度的组胺对于人体维持正常生理活动,如血管扩张、血压下降、局部免疫反应等,必不可少[1-4]。但是,人体中组胺浓度一旦过高,将会与G蛋白偶联的组胺受体结合,引发一系列过敏性炎症反应疾病[5]。鱼的肌肉组织中通常含有大量的游离组氨酸。在一定条件下,游离的组氨酸会被某些细菌脱羧而产生大量的组胺,食用含有大量组胺鱼会导致组胺中毒和临床疾病[6]。在食品生产、贮藏和运输过程中,组胺作为食品质量中的生物标志物之一倍受关注,对组胺进行准确而高灵敏的检测至关重要。目前不同国家根据不同食品的特性给出组胺的限量标准,美国食品及药物管理局规定鱼类组胺含量不能超过50 mg/kg[7],欧洲食品安全局规定新鲜鱼类产品组胺含量为100~200 mg/kg[8]。我国规定鲐鱼、鲹鱼、竹荚鱼、鲭鱼、鲣鱼、金枪鱼等青皮红肉海水鱼组胺含量不得超过40 mg/100 g,其他海水鱼不得超过20 mg/100 g[9]。
食品中组胺的常见检测方法有色谱检测技术[10-12]、毛细管电泳技术[13]、电化学传感技术[14]和酶联免疫吸附技术等[15]。但是这些方法目前都存在检测成本高,仪器尺寸大而难以运输,需要耗时的程序、昂贵的设备和熟练的操作人员等缺点。例如,当使用色谱和毛细管电泳技术时,需要长时间的样品制备,如组胺衍生物的制备[16]。因此,研究建立一种准确、简单、高效、快速的针对鱼肉样品中组胺的检测方法变得非常必要。核酸适配体是一种通过体外进化过程,从随机序列核酸文库中人工选出的功能性DNA/RNA寡核苷酸序列,能特异性结合目标物[17],是一类很有潜力的抗体替代品。由于其价格便宜,容易合成,不易失活的特性,目前开发基于核酸适配体针对小分子的检测方法也越来越多[18-21]。近年来,适配体逐渐被应用到食品安全检测领域[22-23],而金纳米颗粒(gold nanoparticles,AuNPs)因其表面等离子体效应能快速响应并介导比色信号,在化学和生物传感领域也受到广泛关注[24-26]。与此同时,利用智能手机记录并分析颜色信息,使得各种基于比色信号的生物传感策略变得更为便携与实用[27-28]。受以上工作的启发,Lerga等[29]将成功筛选的组胺适配体与AuNPs材料结合,以加盐使AuNPs聚集的方式实现颜色的变化,构建了一种目视比色检测组胺的传感方法。Huang Conghui等[30]发现咪唑环及脂肪族氨基有协同诱导未修饰AuNPs聚集的性质,建立了一种未修饰的AuNPs比色检测组胺的方法。鲜见报道既利用组胺诱导AuNPs聚集的特点,又结合适配体特异性识别组胺的检测方法。在此基础上,本实验建立一种快速、便携的组胺检测方法。该方法是由AuNPs、组胺适配体组成的检测体系。在此体系中,有组胺存在时,组胺与适配体结合,诱导AuNPs聚集呈现颜色的变化达到快速检测组胺的目的。同时,颜色信息被智能手机成像识别,并通过RGB分析进行数字化,进而实现便携式检测组胺,旨在为复杂基质的样品中检测组胺提供新的方法。
1 材料与方法
1.1 材料与试剂
HAuCl4g3H2O(纯度≥99.9%) 上海阿拉丁生化科技股份有限公司;柠檬酸三钠(Na3Cit)、硼氢化钠(NaBH4) 国药集团化学试剂有限公司;组胺、二甲胺、三甲胺、β-苯乙胺、乙二胺、亚精胺、色胺上海麦克林生化科技有限公司;实验用水均为超纯水(18.2 MΩgcm)。
组胺适配体序列[29](5′-AGC TCC AGA AGA TAA ATT ACA GGG AAC GTG TTG GTT GCG GTT CTT CCG ATC TGC TGT GTT CTC TAT CTG TGC CAT GCA ACT AGG ATA CTA TGA CCC CGG-3′)经生工生物工程(上海)股份有限公司合成和高效液相色谱纯化。
1.2 仪器与设备
Spark酶标仪 瑞士帝肯(上海)贸易有限公司;Zetasizer Nano-ZS纳米粒度仪 英国马尔文仪器有限公司;BX 51立式荧光显微镜(配备UPLSAPO Olympus 100 倍油浸物镜) 日本奥林巴斯公司;CMOS Michrome 20显微镜相机 上海微图仪器科技发展有限公司;荣耀手机20 华为技术有限公司;BSA124S电子天平赛多利斯(上海)贸易有限公司;Heraeus Pico 17离心机赛默飞世尔科技(中国)有限公司;Mingche No CP2ALLRESCN超纯水系统 密理博中国有限公司;Image J软件由National Institutes of Health开发。
1.3 方法
1.3.1 AuNPs的制备
参照Jana等[31]的方法,将1 mL HAuCl4g3H2O(质量分数1%)与99 mL超纯水在磁力搅拌下混合15 min,然后在室温条件下加入1 mL Na3Cit(质量分数1%)。最后,取1 mL NaBH4(质量分数0.075%)和1 mL Na3Cit(质量分数1%)的混合物滴入溶液中,搅拌30 min,4 ℃保存备用。
1.3.2 组胺测定方法的建立
将合成的AuNPs(200 μL)与组胺适配体(1 μL、10 µmol/L)在室温(25 ℃)孵育10 min。随后,20 mmol/L组胺以不同的体积被添加到该体系中,取200 μL反应体系溶液加入至96 微孔聚苯乙烯板并放入酶标仪中进行紫外-可见光谱扫描。以610 nm与520 nm波长处吸光度之比评价各参数的影响及定量组胺。同时,通过智能手机记录AuNPs的颜色变化,利用Image J软件分析拍摄彩色照片的蓝(B)、绿(G)、红(R)3个通道的值,以G/R灰度值定量分析组胺。
1.3.3 组胺测定方法的特异性评价
选择6种常见的生物胺类物质(二甲胺、三甲胺、β-苯乙胺、乙二胺、亚精胺、色胺)作为干扰物质,浓度为1 µmol/L,采用1.3.2节检测方法进行特异性检测。
1.3.4 水样及鳙鱼样加标回收率与检测应用
参照Lerga等[29]的方法,将鳙鱼去除鱼鳞、鱼肠和鱼头,鱼肉剁碎用于后续实验,称取0.5 g鱼肉肉糜,加入25 mL超纯水,旋涡振荡1~2 min,再以10 000 r/min离心5 min后,收集提取上清液。
将不同浓度的组胺标准溶液添加到1.3.2节中的体系溶液和鳙鱼提取上清液中。对每个溶液进行3次标准添加和回收实验,计算回收率。
1.4 数据统计及图表绘制
使用智能手机对反应前后的溶液拍照获取图像,利用Image J软件采集图像的RGB值,步骤如下:1)选择并点击Image-Color-Split channels,将图像拆分为蓝(B)、绿(G)、红(R)3个颜色通道;2)通过一个固定的矩形区域(约1 000 像素)对不同通道图像提取平均灰度值,点击Analyze-Measure得到结果;3)最后计算G/R通道的比值实现可视化定量组胺。
实验中所有数据均使用Origin2016统计分析软件进行线性拟合并作图。
2 结果与分析
2.1 基于核酸适配体吸附AuNPs比色传感器测定组胺策略的设计原理
如图1所示,适配体的碱基与AuNPs之间存在范德华引力,使适配体吸附在AuNPs表面上,且碱基上的磷酸基团带有负电荷,使AuNPs能够相互排斥而稳定分散在溶液中[32-33]。在适配体/AuNP溶液体系中,当存在适当浓度组胺目标物时,一部分组胺与被吸附在AuNPs表面上的适配体链特异性结合,使带有残存AuNPs柠檬酸根离子暴露于溶液中。另一部分存在的组胺,则通过其咪唑环取代合成AuNPs表面的柠檬酸根离子,带正电的组胺与带负电的柠檬酸离子的结合降低了AuNPs的净表面电荷,从而破坏AuNPs的稳定性并引发聚集[30,34]。通过分析AuNPs聚集发生的颜色改变,进而实现组胺的定量分析。

图1 基于核酸适配体吸附AuNPs的组胺传感策略图Fig.1 Schematic diagram of sensor strategy for histamine detection based on aptamer-absorbed AuNPs
2.2 基于核酸适配体吸附AuNPs比色传感器测定组胺策略的可行性验证
如图2所示,在光谱图中约520 nm波长处可以观察到纯AuNPs溶液的特征表面等离子体共振(surface plasmon resonance,SPR)峰带(图2a)。吸附有适配体的AuNPs溶液与纯AuNPs溶液相比,其SPR峰带位置及吸光度和颜色变化基本无变化(图2c)。加入组胺后,AuNPs溶液颜色由红色变为灰色,并且在610 nm处出现一个强吸收峰,表明AuNPs聚集严重(图2b);而吸附有适配体的AuNPs溶液在520 nm处的SPR峰带发生红移,且610 nm处吸收峰值少许增高,证实了适配体具有保护AuNPs不被聚集的效应,但同时由于剩余部分组胺能通过咪唑环取代AuNPs表面的柠檬酸根离子导致部分聚集(图2d),由此,证明了该策略的可行性。
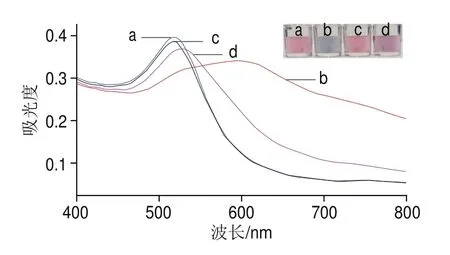
图2 检测原理可行性紫外-可见吸收光谱图Fig.2 UV-visible absorption spectra showing the feasibility of the sensor for histamine detection based on aptamer-absorbed AuNPs
AuNPs的聚集可以通过暗场显微成像下颗粒散射光的颜色变化得到证实,研究表明,单分散与团聚的AuNPs的散射光颜色分别为绿色与红色[35]。由图3可知,纯AuNPs与吸附有适配体的AuNPs在暗场显微镜视野中分布良好,散射光颜色为绿色(图3a和图3b)。有组胺存在时,AuNPs聚集显著,散射光颜色为红色(图3d)。吸附有适配体的AuNPs在加入组胺后,暗场图像中出现红色和绿色两种颜色的点(图3c)。如图4所示,经组胺反应并吸附有适配体的AuNPs溶液比单纯吸附有适配体AuNPs溶液的Zeta电位高,表明一部分组胺中和了纯AuNPs溶液的电荷。这两种效应都充分表明基于AuNPs核酸适配体传感方法测定组胺策略的可行性。

图3 利用暗场显微成像考察传感策略的可行性Fig.3 Dark-field scattering images showing the feasibility of the sensor for histamine detection based on aptamer-absorbed AuNPs

图4 各种传感溶液的Zeta电位图Fig.4 Zeta-potential of various solutions
2.3 反应条件优化
2.3.1 适配体浓度
组胺的适配体能够特异性识别组胺,其浓度对比色传感体系有直接影响。实验中将不同浓度的适配体加入到200 µL AuNPs中,并25 ℃孵育10 min,然后加入1.6 µmol/L组胺以考察比色信号。从图5可以看出,随着适配体浓度的增大,AuNPs溶液的吸光度与相应的溶液颜色变化越不明显,表明组胺对AuNPs的聚集效果越弱。当加入适配体浓度大于40 nmol/L时,组胺对AuNPs不再具有聚集效果,颜色不再变灰。一方面为了保证适配体对AuNPs的保护作用,另一方面需要部分组胺诱导AuNPs聚集实现比色检测。因此,40 nmol/L适配体浓度被选为最佳用量。
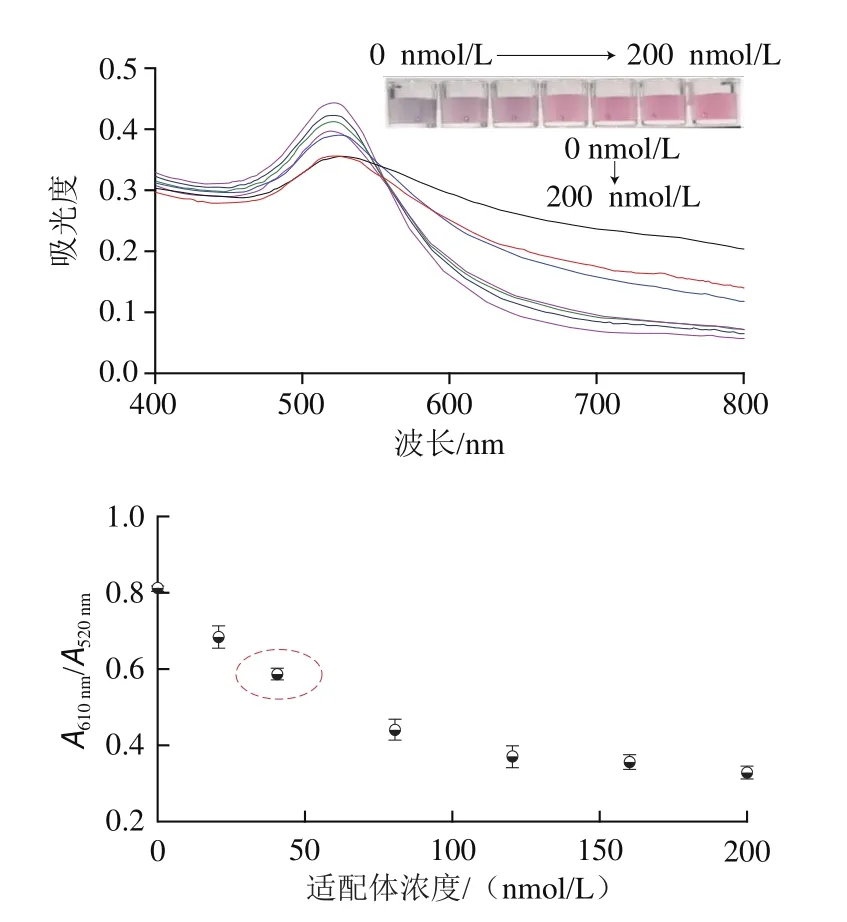
图5 适配体浓度对比色传感体系的影响Fig.5 Effect o aptamer concentration on the colorimetric sensor system
2.3.2 反应时间
如图6所示,随着反应时间的延长,基于AuNPs核酸适配体传感方法测定组胺的反应体系吸光度信号稳定,说明加入组胺后,该传感体系的比色信号不随反应时间的变化而变化,可以达到即时检测的目的,缩短检测时间。因此,在该比色传感体系中不需要孵育即可实现紫外-可见吸光度的快速检测。
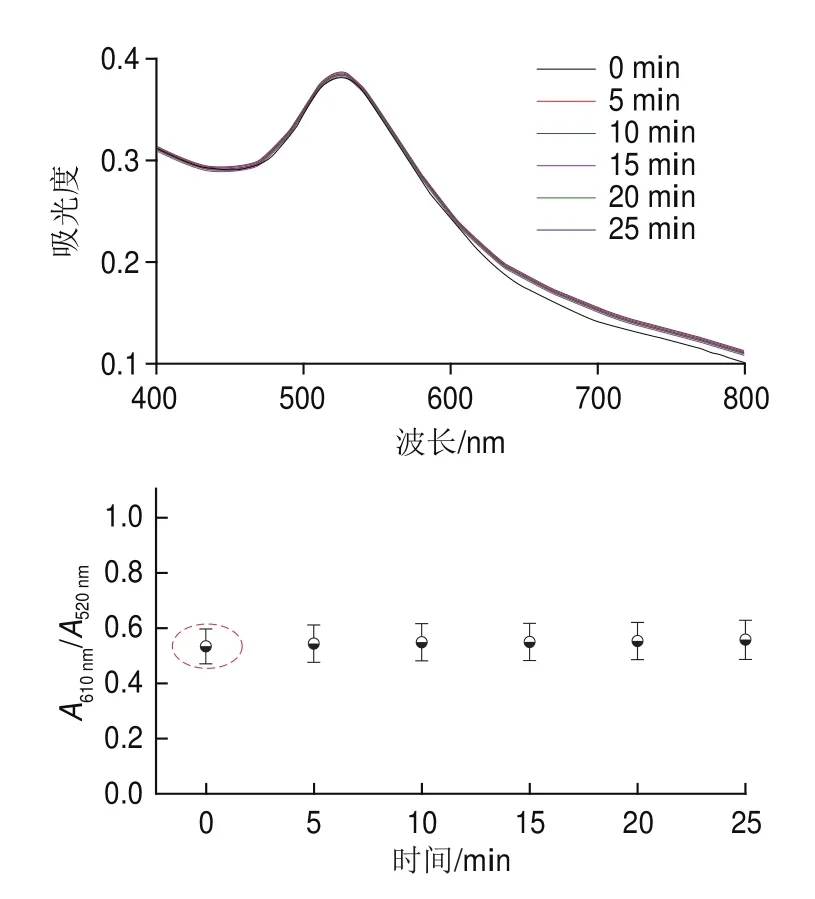
图6 反应体系时间对比色反应体系的影响Fig.6 Effect of reaction time on the colorimetric detection system
2.4 策略的灵敏度考察
如图7a可知,随着组胺浓度的增加,AuNPs检测体系A610nm增大,而A520nm有少许波动,但是AuNPs体测体系的颜色逐渐加深。为了避免检测体系中AuNPs等底物浓度的轻微变化引起检测信号的不准确性,实验选用A610nm/A520nm作为信号变化的衡量标准。图7b显示,组胺在50 nmol/L~1.2 µmol/L范围内具有良好的线性关系,其相关系数为R2=0.999,线性回归方程为Y=0.293X+0.303 36。线性范围(定量范围)是指定量测定的最低浓度到遵循线性响应关系的最高浓度间的范围[36]。故本实验中比色法的定量范围为50 nmol/L~1.2 µmol/L。检测限根据3σ/K(其中σ为空白的标准差,K为校准曲线的斜率)计算,为8.89 nmol/L。采用RGB法进行颜色分析,如图7c所示,红色通道与绿色通道的比值(G/R)随着组胺浓度的增加而增大,其中在150 nmol/L~1.0 µmol/L之间存在良好线性关系,即定量范围。线性回归方程为Y=0.067 98X+0.816 34,检测限为24.91 nmol/L(图7d)。这两种方法都可用于组胺的定量检测,其中RGB法能够适用于组胺的便携式检测。如表1所示,与其他快速检测方法相比,本方法具有良好的线性范围与较好的灵敏度。
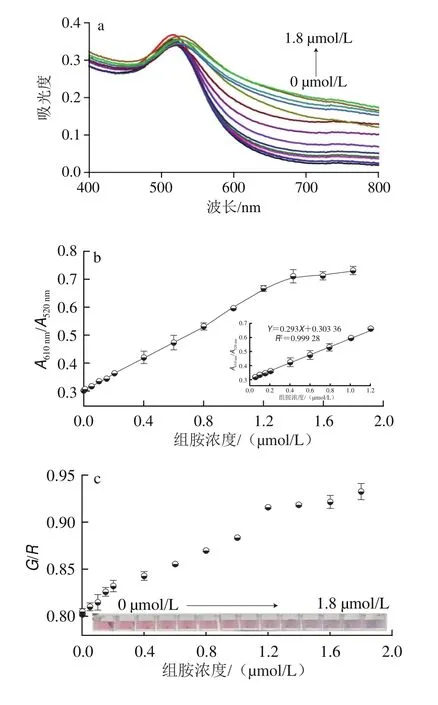
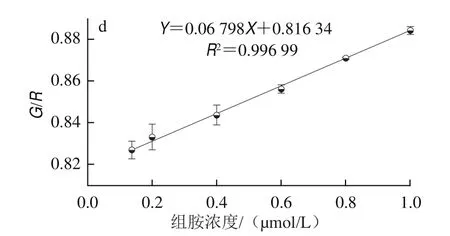
图7 不同组胺浓度存在下检测体系的灵敏度Fig.7 Sensitivity of the detection system in the presence of different histamine concentrations

表1 各检测组胺方法的对比Table 1 Comparison of histamine detection methods
2.5 方法特异性实验结果
为进一步验证本方法的特异性和选择性,选择组胺的类似物,如二甲胺、三甲胺、β-苯乙胺、乙二胺、亚精胺和色胺,作为对照样,进行信号考察。如图8a所示,只有组胺存在时,紫外吸收信号响应及颜色才与空白对照有明显的变化,而二甲胺、三甲胺、β-苯乙胺、乙二胺、亚精胺和色胺没有表现出较空白对照更为明显的信号响应。由图8b和图8c可知,比色法与RGB分析都表明组胺信号值比空白和其他胺信号值高,这一结果表明该方法特异性强,可用于组胺的特异性检测。
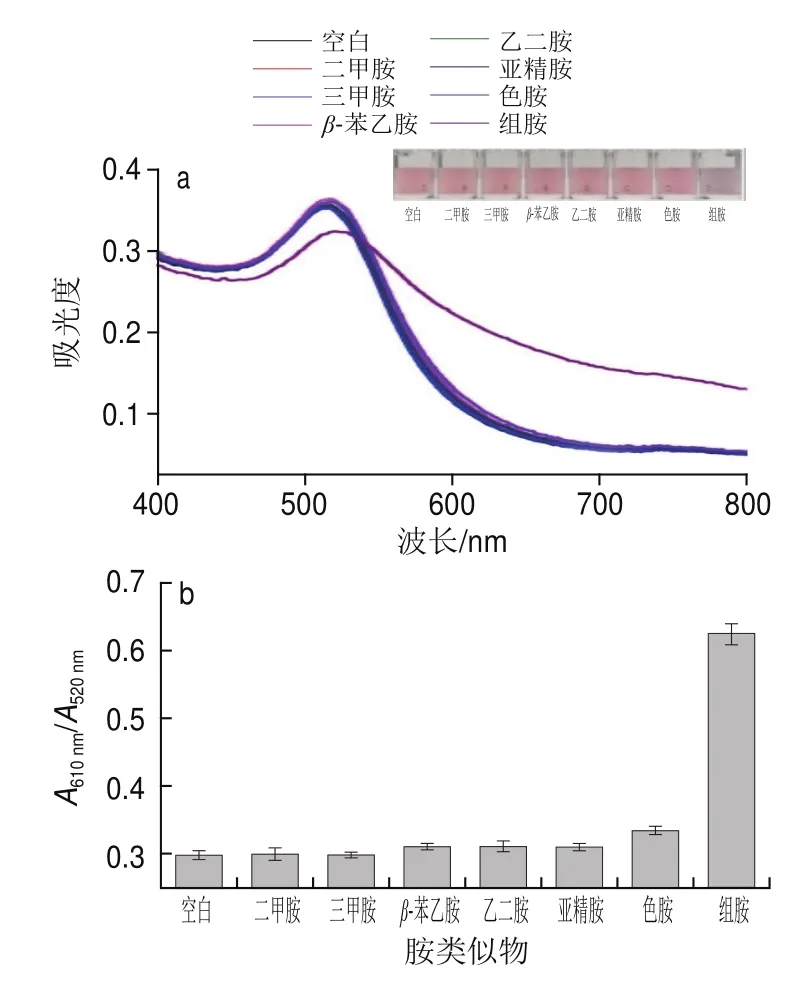

图8 检测体系的特异性评价Fig.8 Evaluation of the specificity of the detection system
2.6 加标回收率实验结果
水样及鱼肉样品加标回收率考察该方法的准确性与重复性。通过向水样或者鳙鱼样品中添加组胺标准溶液,使其最终加标浓度为0.2、0.4、0.6、0.8、1.0 µmol/L,采用本实验所建立的方法进行检测,每个样品做3次平行实验。从表2可以看出,用比色法测得加标回收率为91.82%~102.27%,RGB法的加标回收率为98.96%~102.89%。由表3可知,比色法测得鳙鱼样品中加标回收率为89.77%~108.92%,RGB法中鳙鱼样品的加标回收率为88.96%~109.82%。两种信号方式皆表明该比色策略具有较好的准确性,可以用于组胺的检测。
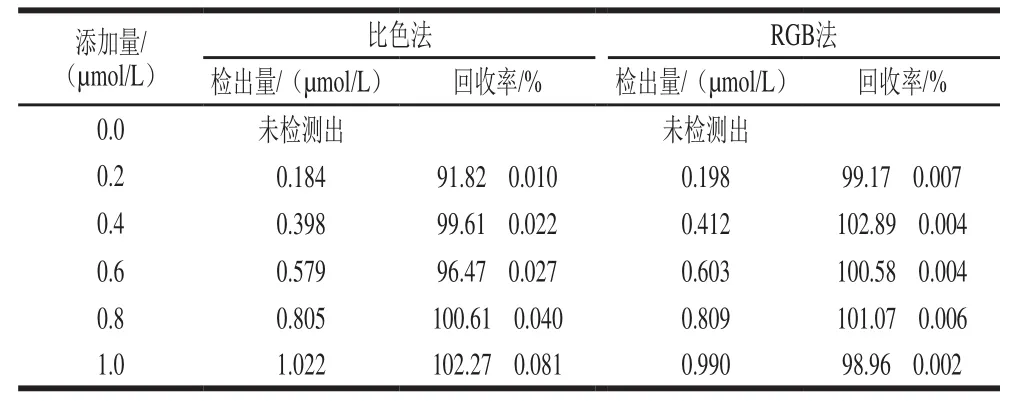
表2 水样加标回收率(n=3)Table 2 Recoveries of histamine in spiked water samples (n = 3)

表3 鳙鱼样品加标回收率(n=3)Table 3 Recoveries of histamine in spiked bighead carp meat samples (n = 3)
3 结 论
本实验成功开发了一种基于核酸适配体吸附AuNPs的比色传感检测组胺的方法,其灵敏度高,基于紫外-可见吸收光谱测得的检测限为8.89 nmol/L,而基于RGB方法的检测限为24.91 nmol/L。本方法利用适配体的高亲和力、结构稳定特性以及AuNPs优异的光学特性,使组胺本身带有的咪唑环结构引起AuNPs的聚集,较好弥补了一般方法中加入盐引起的AuNPs聚集现象,同时适配体的加入使本检测方法更具特异性。最后根据颜色的变化定量组胺,引入智能手机可便携式分析组胺,避免了传统比色方法需要大型仪器的缺点。因此,该方法能满足快速、现场即时检测组胺的需求。

