艾叶提取物对万古霉素诱导急性肾损伤的保护作用及其机制
李 达,李 敏,蔡文志,柳文媛,徐 健,杨宝卫*,冯 锋,**
(1江苏食品药品职业技术学院制药工程学院,淮安 223003;2常州市妇幼保健院,常州医学中心,南京医科大学,常州 213000;3中国药科大学药学院,南京 210009;3中国药科大学中药学院,南京211198)
急性肾损伤(acute kidney injury,AKI)是指不超过3 个月的肾脏功能或结构方面的异常,包括血、尿、肾脏病理组织学检测或影像方面的肾损伤标志物异常,并以肾功能迅速下降为临床特点,最终可能导致急性肾衰竭(acute renal failure,ARF)[1-2]。AKI 对人的肾脏、脑、肝等器官都有一定的危害,研究表明,患有晚期肿瘤的患者使用化疗药物导致AKI 的概率远高于早期患者,发生率约41%。因此,化疗药物在延长肿瘤患者的生命的同时,也给患者带来了严重的并发症,已成公众健康难题[3]。
当前,临床上用于治疗AKI 的药物几乎没有。常采用血液净化和特殊的中成药进行辅助治疗(中成药常用冬虫夏草或灵芝,价格高昂)[4],给患者造成了沉重的心理负担和经济压力。因此,寻找并发现能够用于预防和治疗由化疗药物导致AKI的候选药物十分迫切。
不同病因所致AKI 的作用机制有所不同,但主要涉及血流动力学改变等几个主要病理环节,其中炎症反应、氧化应激、细胞凋亡是药物诱导AKI 发生的重要机制[6-7]。艾叶是菊科植物艾草(Artemisia argyiLevl.et Vant.)干燥叶,药食两用植物,味苦、性温,具有理气血、温经脉的功效,主要化学成分包括绿原酸类、挥发油类、黄酮类等;现代药理学证明艾叶具有抗氧化、抗炎、降血糖、免疫调节等药理作用[8-10]。
本课题组前期实验研究发现,艾叶中的黄酮、绿原酸、酚酸、酚醛、蒽醌等化合物均具有较强的抗氧化活性,艾叶石油醚萃取部位的挥发油组分具有低毒、高效的抗炎作用,所以采用艾叶治疗AKI 有理论可循。目前对艾叶是否对化疗药物导致的AKI具有保护作用未见文献报道。
本研究通过ip 雄性ICR 小鼠万古霉素(VAN)建立药物性AKI 模型,并检测小鼠肾功能、氧化应激和炎症等相关指标、检查肾脏组织形态和肾组织细胞凋亡相关基因含量水平,从而进一步阐明艾叶乙醇提取物改善AKI 的作用机制,为中药艾叶改善VAN诱导AKI作用研究提供理论依据。
1 材 料
1.1 试剂与药材
注射用VAN(浙江海正药业股份有限公司);小鼠胱抑素C(Cys C)、尿素氮(BUN)、炎症指标肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)、超敏C-反应蛋白(hs-CRP)检测试剂盒(上海沪震生物科技有限公司);肌酐(Scr)的含量水平,氧化应激指标丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(北京九强生物技术股份有限公司);细胞凋亡相关基因(Bax、Bcl-2、Caspase-3)检测试剂盒(上海晶抗生物工程有限公司);所使用的试剂均为分析纯(南京化学试剂公司)。
艾叶由湖北蕲春栽培和购买(批号180401),经冯锋教授鉴定为Artemisia argyi的干燥叶,保存于江苏食品药品职业技术学院制药工程学院中药提取实验室。
1.2 仪 器
台式高速冷冻离心机(HR/T16M,湖南赫西仪器装备有限公司);CAX-370 型离心机(日本Tomy Seiko 公司);酶标仪(美国BioTek EL-x800);病理彩色图象分析系统(郑州泽铭科技有限公司);XD-202型倒置显微镜(南京江南永新光学有限公司)。
1.3 动 物
动物等级均为SPF 级雄性ICR 小鼠,体重控制在22~25 g(南京市青龙山动物繁殖场,许可证号SCXK(苏)2020.0001),动物实验符合伦理学。
2 方 法
2.1 艾叶提取物制备
取艾叶500 g 阴干,使用95%乙醇为提取溶剂(料液比为1∶10),于室温下过夜浸泡12 h,50 ℃加热回流提取3次,每次3 h,合并提取液,过滤,减压回收溶剂,得艾叶乙醇提取物。.
2.2 动物分组、AKI模型建立与给药
小鼠适应性喂养后,随机分为空白组、模型组和给药组,给药组包括高剂量组(H 组)、中剂量组(M 组)和低剂量组(L 组)。每组6 只小鼠,实验前将小鼠用硝酸银溶液进行分组标号,且不禁水不禁食。以腹腔注射(ip)方式给药,其中,空白组小鼠按其体重给予等量的无菌生理盐水;模型组小鼠ip VAN(100 mg/kg),每日1 次,连续8 d,在此期间动物自由饮食饮水。
通过预实验发现,当给药组小鼠灌胃(ig)250 mg/kg 及其以上剂量的艾叶乙醇提取物时,小鼠出现死亡,当ig 30 mg/kg 及其以下剂量的艾叶乙醇提取物时,给药组小鼠相关参数水平与模型组无显著差异,因此,实验最终选择200 mg/kg,100 mg/kg,50 mg/kg 3 个给药剂量组。小鼠提前ig规定剂量的艾叶乙醇提取物,每日1次,连续两周,之后ip VAN(100 mg/kg),每日1 次,连续8 d,同时继续ig 规定剂量的艾叶乙醇提取物,其间动物自由饮食饮水[11]。
2.3 指标检测
2.3.1 肾功能指标Cys C、BUN、Scr 的含量测定[11]空白组、模型组、H 组、M 组、L 组实验小鼠末次给药24 h 后,均采用小鼠眼球采血法,以6 000 r/min,离心10 min,分离血清,依据试剂盒方法检测血清中有关肾功能指标的Cys C、BUN、Scr含量水平。
2.3.2 氧化应激指标MDA、SOD 和GSH-Px 的含量测定[12-13]空白组、模型组、H 组、M 组、L 组实验小鼠末次给药24 h 后,均采用小鼠眼球采血法,以6 000 r/min,离心10 min,分离血清,依据试剂盒方法检测血清中氧化应激指标的MDA、SOD 和GSHPx含量水平。
2.3.3 炎症指标TNF-α、IL-1β 和hs-CRP 含量测定[14-15]空白组、模型组、H 组、M 组、L 组实验小鼠末次给药24 h 后,均采用对小鼠眼球采血法,以6 000 r/min,离心10 min,分离血清,依据试剂盒方法检测血清中炎症指标的TNF-α、IL-1β 和hs-CRP的浓度。
2.4 标本采集与肾脏组织形态检查
分别处死小鼠并解剖取出肾脏,分成两部分,一部分于-80 ℃条件下保存,做肾组织中细胞凋亡相关基因Bax、Bcl-2、Caspase-3 的检测;另一部分于10%福尔马林中浸泡24 h,然后使用乙醇脱水,切制成4 μm 厚的切片,并用做苏木精-伊红染色法(HE 染色)染色,在光镜下观察各组肾脏组织形态学改变[16]。
2.5 细胞凋亡相关基因Bax、Bcl-2、Caspase-3 的检测
2.5.1 肾组织匀浆制备 将各组实验小鼠肾脏,依照质量体积比1∶9 分别加入匀浆介质,4 ℃的条件下制备肾组织匀浆,以6 000 r/min,离心10 min,分离并吸取上清液。
2.5.2 细胞凋亡相关基因Bax、Bcl-2、Caspase-3含量水平的检测 于96 孔板待测孔(空白孔、标准品孔、样品孔)中加入各自样品10 μL 和稀释液40 μL;然后,标准品孔和样本孔中加入检测抗体100 μL,空白孔加入等量稀释液,避光封住,恒温37 ℃反应60 min 后弃去液体,拍干,加洗涤液,来回洗5 次,每次中间静置2 min;最后,加入底物50 μL,37 ℃恒温下放置20 min 后加终止液50 μL,于酶标仪450 nm 处测定吸收度,依照标准曲线法计算各样品浓度[17]。
2.6 统计分析
实验结果以±s表示,用SPSS 19.0软件进行统计。数据间差异性采用t检验方法,P<0.05 表示有统计学差异。
3 结 果
3.1 艾叶乙醇提取物制备
照“2.1”项下方法,减压回收溶剂,烘箱加热烘干,得艾叶乙醇提取物浸膏52.3 g。通过计算,艾叶出膏率结果为10.46%(出膏率=浸膏质量/艾叶干重× 100%)。同时,精密称取浸膏样品20 g,加入羧甲基纤维素钠(CMC-Na)溶液100 mL 作样品溶剂,超声溶解配制成20 g/mL 动物实验给药样品母液。
3.2 生化指标的测定
3.2.1 肾功能指标Cys C、BUN、Scr 的含量比较研究结果显示(表1),与空白组比较,模型组小鼠血中Cys C、Scr 和BUN 等反映肾功能的指标参数水平显著升高(P<0.05),表明注射VAN 的小鼠因产生了明显的药物性AKI 模型;同时,给予了不同剂量艾叶提取物后,与模型组比较,H 组小鼠血中肾功能指标含量水平均有不同程度降低(P<0.05),M 组和L 组给药组小鼠血中肾功能指标含量水平也有不同程度降低,且3个不同剂量对其影响呈现浓度依赖性。上述结果表明,艾叶乙醇提取物对化疗药物VAN 诱导的药物性AKI 具有保护作用。
Table 1 Content of Cys C,BUN and Scr in different groups(± s,n = 6)
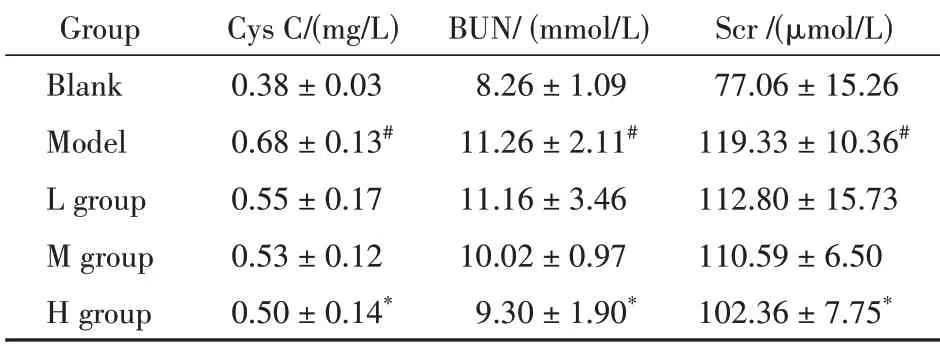
Table 1 Content of Cys C,BUN and Scr in different groups(± s,n = 6)
Cys C: Cystain C; BUN: Blood urea nitrogen; Scr: Serum creatinine; L group: Low-dose(50 mg/kg) group; M group: Middle-dose(100 mg/kg)group;H group:High-dose(200 mg/kg)group#P <0.05 vs blank group;*P <0.05 vs model group
Group Blank Model L group M group H group Cys C/(mg/L)0.38±0.03 0.68±0.13#0.55±0.17 0.53±0.12 0.50±0.14*BUN/(mmol/L)8.26±1.09 11.26±2.11#11.16±3.46 10.02±0.97 9.30±1.90*Scr/(μmol/L)77.06±15.26 119.33±10.36#112.80±15.73 110.59±6.50 102.36±7.75*
3.2.2 氧化应激指标MDA、SOD 和GSH-Px 含量比较 研究结果显示(表2),与空白组比较,模型组小鼠血清中MDA 含量增加,SOD 和GSH-Px活力下降,且反映氧化应激上述指标参数水平均呈显著性变化(P <0.05),表明本实验注射VAN 模型小鼠出现明显的氧化应激反应;同时,给予了不同剂量艾叶提取物后,与模型组比较,H 组小鼠血中氧化应激指标参数含量水平均有不同程度降低(P<0.05),M 组和L 组小鼠血中肾功能指标含量水平也有不同程度降低,且3个不同剂量对其影响呈现浓度依赖性。上述结果表明,艾叶提取物可能通过抗氧化应激改善化疗药物VAN引起的AKI。
3.2.3 炎症指标TNF-α、IL-1β 和hs-CRP 含量比较 研究结果显示(表3),与空白组比较,模型组小鼠血清TNF-α、IL-1β 和hs-CRP 含量均有增加,且TNF-α 和IL-1β 参数水平呈显著性变化(P<0.05),表明本实验注射VAN 模型小鼠出现明显的炎症反应;同时,给予了不同剂量艾叶提取物后,与模型组比较,H 组、M 组和L 组给药组小鼠血中肾功能指标含量水平也有不同程度降低,且3个不同剂量对其影响呈现浓度依赖性。上述结果表明,艾叶提取物可能通过抑制炎症反应改善化疗药物VAN引起的AKI。

Table 2 Content of MDA, SOD and GSH-Px in different groups (xˉ±s,n = 6)

Table 3 Content of TNF-α,IL-1β and hs-CRP in different groups(xˉ±s,n = 6)
3.2.4 肾脏组织形态学改变 研究结果(图1)显示,在光镜下,发现空白组小鼠的肾小管、肾小球等结构颜色正常、形态正常,无明显的异样;与空白组比较,模型组小鼠肾小管结构出现了异样的病理情况,较多肾小管上皮细胞水肿甚至坏死,无明显的细胞界限,小管管腔内有大量细胞管型,间质明显淤血;与模型组比较,给药组H 组、M 组和L组的小鼠肾脏的肾小管、肾小球病理症状随着给药量的增加,给药组小鼠肾脏组织病变减轻程度呈现浓度依赖性。
3.3 细胞凋亡指 标Bax、Bcl-2 和Caspase-3 含量比较
研究结果显示(表4),与空白组比较,模型组小鼠模型组Bax 含量升高、Bcl-2 含量降低,Cas‑pase-3 含量升高,且反映细胞凋亡指标的Bcl-2、Caspase-3 参数水平呈显著性变化(P<0.05)。同时,给予了不同剂量艾叶提取物后,与模型组比较,H 组、M 组和L组给药组不同程度地降低了Bax浓度、升高了Bcl-2 浓度和降低了Caspase-3 浓度,其中H组小鼠Bax、Caspase-3等参数水平均有发生显著性差异(P<0.05)且3 个不同剂量对其影响呈现浓度依赖性;此外,Bax/Bcl-2 比例下降,从而减少了Caspase-3的产生,起到抑制细胞凋亡作用。上述结果表明,艾叶提取物可能通过抑制细胞凋亡改善化疗药物VAN引起的AKI。

Figure 1 Pathological changes in different groups
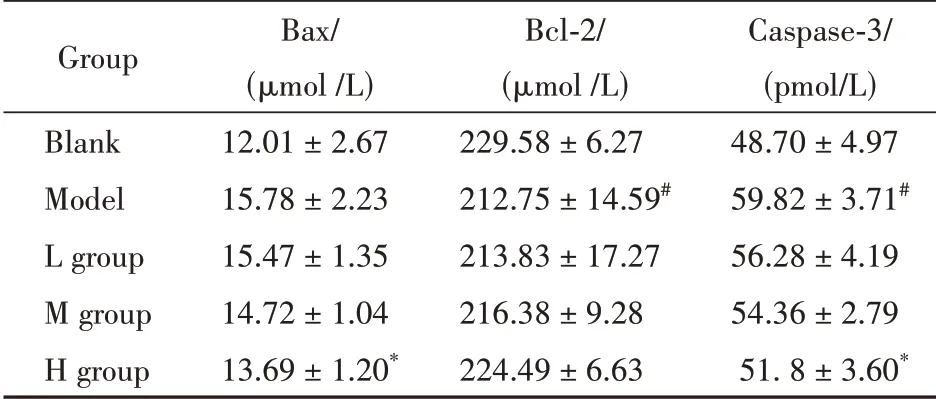
Table 4 Content of Bax, Bcl-2 and Caspase-3 in different groups (xˉ±s,n = 6)
4 讨 论
本实验结果表明,艾叶乙醇提取物对化疗药物VAN 诱导的AKI 具有保护作用,其机制与艾叶提取物能改善氧化应激、抑制炎症与细胞凋亡等有关,与Xu,Lu 等的研究结果[14,18]一致。此外,本实验的研究结果进一步证实了氧化应激、炎症反应、细胞凋亡3 个影响因素在VAN 诱导的药物性AKI模型中过程中关系密切且相互影响。
艾叶在我国药用历史悠久,且资源丰富,目前临床应用多是胃炎、关节炎等疾病治疗[19],尚未见到AKI临床治疗的相关文献记载;而Zhang 等[20]的研究表明,艾叶水煎液对尿毒症患者慢性肾功能不全有保护作用,且该作用在一定浓度范围内呈现剂量相关性,表明艾叶临床上具有潜在的肾保护作用。根据Li 等[21]的研究,艾叶的口服给药的安全性较好,小鼠的给药量到达120 g/(kg·d)灌胃7 d时仍未出现明显急性毒性反应。本实验设计的对治疗组小鼠采用8 d 灌胃艾叶提取物[200 mg/(kg·d)]的给药方式,该剂量给药期间小鼠无明显不良反应,治疗组小鼠相比模型组小鼠肾功能明显改善,表明其具有潜在的临床使用安全疗效。
艾叶中的化学成分繁多,且化合物之间的协同作用对药效影响甚大,需要进一步对其含有单体化学成分的AKI 药效和机制深入研究,为艾叶防治AKI的潜在药物开发奠定实验基础。

