一株高效还原亚硒酸盐的粘质沙雷氏菌的分离鉴定及特性①
王明释,蒋代华,黄雪娇,李圣会,张 宇,黄金兰,邓华为,铁文周
一株高效还原亚硒酸盐的粘质沙雷氏菌的分离鉴定及特性①
王明释,蒋代华*,黄雪娇,李圣会,张 宇,黄金兰,邓华为,铁文周
(广西大学农学院,南宁 530004)
从广西钦州市钦北区的富硒土壤中筛选出一株可高效还原亚硒酸盐的细菌QZB-1。16S rDNA 基因序列分析确定菌株为粘质沙雷氏菌()。研究发现菌株QZB-1 可耐高达180 mmol/L 的亚硒酸盐。进一步研究发现菌株QZB-1 在36 h 之内对1 mmol/L 亚硒酸盐的还原率为95%,随着硒浓度升高还原率有所下降。正交实验表明,对菌株还原亚硒酸盐的影响程度依次是初始亚硒酸盐浓度>培养时间>接种量,最佳还原条件是初始亚硒酸盐浓度为1 mmol/L,接种量为10%,培养时间为36 h,此时菌株QZB-1 对亚硒酸盐的还原率大于98.55%。研究结果表明新型亚硒酸盐还原菌粘质沙雷氏菌QZB-1 可高效还原亚硒酸盐为单质纳米硒,可高效应用于亚硒酸盐污染水体和土壤的治理。
粘质沙雷氏菌;亚硒酸盐还原;分离;鉴定;特性
硒(Se)是人体必需的微量元素之一,通过硒蛋白在体内发挥重要作用[1]。在全球大气、海洋和陆地生态系统中,硒的循环通常以4种价态存在:Se(-II)、Se(0)、Se(IV) 和Se(VI),其中Se(IV) 流动性大,毒性最强[2]。人体对硒的摄入阈值较窄[3],如果摄入过量的硒将会导致人的认知能力下降[4]、胆固醇升高[5]、Ⅱ形糖尿病及前列腺癌、肌肉硬化等疾病的发生[6]。硒污染主要包括矿石、沉积岩、化石燃料和火山山脉土壤中的自然来源,以及工农业生产、采矿、燃煤、杀虫剂生产、金属提取、炼油、玻璃制造和光电管等的人为污染[7-9]。目前环境中硒污染控制技术包括:膜分离技术、共沉淀技术、吸附处理技术、化学还原法、生物还原法等,前4个技术存在着运营和维护成本高、产物处理难、反应条件苛刻、二次污染风险等问题,反之生物还原法是一种较为环保、高效的方法[10]。
微生物通过还原、甲基化和同化硒,影响硒在环境中的运输和积累[11]。研究发现,从富硒环境中分离筛选的微生物具有较高的亚硒酸盐还原成纳米硒的能力,这些微生物可应用于硒污染环境的修复工作[12-15]。生物提取硒纳米颗粒因其具有比亚硒酸钠更高的抗氧化活性,可作为抗菌药物来开发[16-17]。近年来,Wang 等[18]发现硒纳米颗粒修饰的侧流试剂盒能方便、快速、灵敏地检测人体血清和血液中的抗体,适用于COVID-19 的流行病学调查。此外,Hu 等[19]研究结果表明硒纳米颗粒能被小麦幼苗吸收,其吸收过程与能量无关,被吸收后的硒纳米颗粒迅速氧化为Se(IV) 并转化为有机形式。同时程丹等[20]研究也发现纳米硒可作为有效硒源被杭白菊所吸收利用。当前已分离筛选出了诸多的亚硒酸盐还原微生物,但是大部分微生物存在着硒耐性不高或还原效率低等问题,同时兼有亚硒酸盐耐性和高还原率的微生物相对较少[21-23]。因此,本试验以分离自富硒区的土壤微生物为研究对象,通过加硒培养筛选出具有较高硒耐性的菌株,并测定其对亚硒酸盐的还原率和还原条件优化,以充分发掘利用还原亚硒酸盐的微生物资源,也可为今后生物合成纳米硒颗粒的制备、硒污染环境的治理及生物富集硒提供参考。
1 材料与方法
1.1 土壤样本采集
土壤采自广西壮族自治区钦州市大垌镇大片村(108°32′53″ E,22°05′31″ N)的天然富硒土壤。大垌镇位于北回归线以南,属海洋性的亚热带季风气候,年平均气温为22 ℃,热量资源丰富,年均降雨量为2 104.2 mm。山地居多,主要土壤类型以强酸性铁铝土为主。采用5 点取样法,剔除土壤表层的枯枝落叶,采样深度为0 ~ 20 cm,每个点采集约200 g 土壤,将5 个点的土壤混合均匀,挑去植物残根及入侵体,最后将土壤放进冷藏箱运回实验室作进一步分析。土壤的基本理化性质为pH 5.47,有机质20.80 g/kg,全氮0.99 g/kg,总硒0.81 mg/kg,有效硒71.56 μg/kg。
1.2 培养基
LB 液体培养基:胰蛋白胨10 g/L、酵母提取物5 g/L、氯化钠10 g/L,pH 7.3 ± 0.03;LB 固体培养基:在LB 液体培养基的基础上添加琼脂15 g/L。
1.3 菌株的分离、纯化
参照魏志敏等[24]的方法,取10 g 新鲜土样加入预先装有少量玻璃珠的90 ml无菌PBS(phosphate buffer saline)中,30 ℃、180 r/min 振荡30 min,静置5 min,收集土壤悬液,悬液于5 000 r/min 离心15 min,去掉上清液,沉淀用10 ml PBS 悬浮。取2 ml 悬液添加到100 ml 含亚硒酸盐浓度为1 mmol/L 的LB 液体培养基中进行筛选培养。30 ℃、180 r/min 震荡培养两天,5% 接种量继代培养5 次后,用梯度稀释法制备10–2~ 10–6系列稀释液,分别取100 μl 涂布到LB 固体培养基中,30 ℃ 下培养至菌落长好,挑取单个菌落,采用平板划线法获得菌株纯培养物。
1.4 细菌耐硒能力及生长的测定
挑取分离纯化后的单菌落接种到LB 液体培养基中培养,取100 μl 培养了24 ~ 48 h 的培养液接种于含有不同亚硒酸盐浓度的LB 固体培养基中。含硒固体培养基中硒的浓度递增梯度为1、2、5、10、20、30、40、50、60 和70 mmol/L,经过加硒培养基淘汰后,筛选出能存活的菌株再进行更高的耐硒浓度试验。将分离筛选出的耐硒菌株分别接种到含有0、5、25、75 和160 mmol/L 亚硒酸盐的LB 液体培养基中,测定其生长曲线。菌株在30 ℃ 下以180 r/min 的转速振荡培养。每隔3 h取样一次,以根据活细胞数(菌落形成单位,cfu)测定细菌生长量。通过将样品稀释10–6后取100 μl 的相应稀释样品涂布到LB 固体培养基上,并在30 ℃ 下培养72 h来测定cfu 数。
1.5 菌株鉴定
菌株形态观察及生理生化特征测定参考《常见细菌系统鉴定手册》[25]和《微生物学实验指导》[26]。菌株16S rRNA 基因片段采用16S rRNA 基因通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′) 和1492R(5′-TACGGCTACCTTGTACGACTT-3′)进行PCR 扩增。PCR 反应体系(50 μl):引物27F 和引物1492R(20 μmol/L)各1.0 µl;模板DNA 1.0 µl;混合酶包括dNTPs(2.5 mmol/L) 10.0 μl,10 × Buffer 15.0 μl,Taq 酶(5.0 U/μl) 1 μl,H2O 21 μl。PCR 反应程序如下:96 ℃ 3 min;93 ℃ 30 s,58 ℃ 30 s,72 ℃ 60 s,35 个循环;72 ℃ 10 min,PCR 反应结束后,1% 的琼脂糖鉴定并使用Axygen 凝胶回收试剂盒回收所需PCR 产物片段。菌株的PCR 扩增产物由通用生物系统(安徽)有限公司完成测序,将所得到测序目的序列添加到NCBI 进行Blast 比对,挑选与菌株同源性最为接近的种属,使用MEGA7.0 进行序列分析,以NJ 法构建该菌株的系统发育树。
1.6 菌株对亚硒酸盐的还原测定
菌株对亚硒酸盐还原率的测定是在廖青等[27]的方法下进行优化。挑取LB 固体培养基上的单菌落接种于50 ml LB 液体培养基中,30 ℃,150 r/min 摇床过夜培养至对数生长期,按5% 的比例取活细菌悬液(600 nm 波长下的吸光度值为0.5)分别接种于初始浓度为1、5、25、75、160 mmol/L 的亚硒酸盐LB 液体培养基中,每个处理设置3 个重复。35 ℃、150 r/min 振荡培养36 h。每隔12 h 取样一次,培养液在10 000 r/min 离心10 min 后,用HG-AFS 法测定上清液中Se(IV) 的浓度。
亚硒酸盐还原率(%)=(初始总硒–上清液硒含量)/ 初始总硒× 100
1.7 菌株还原亚硒酸盐的正交试验
为了确定不同条件对细菌还原亚硒酸盐的影响,选取初始亚硒酸盐浓度、培养时间、接种量3 个因素3 个水平,利用L9(33) 正交试验表进行正交试验分析(表1)。试验共设计9 个不同的处理,菌株在每个处理培养之后,取培养液10 000 r/min 离心10 min,利用HG-AFS 法测定上清液中Se(IV) 的浓度后计算每个处理的亚硒酸盐还原率。
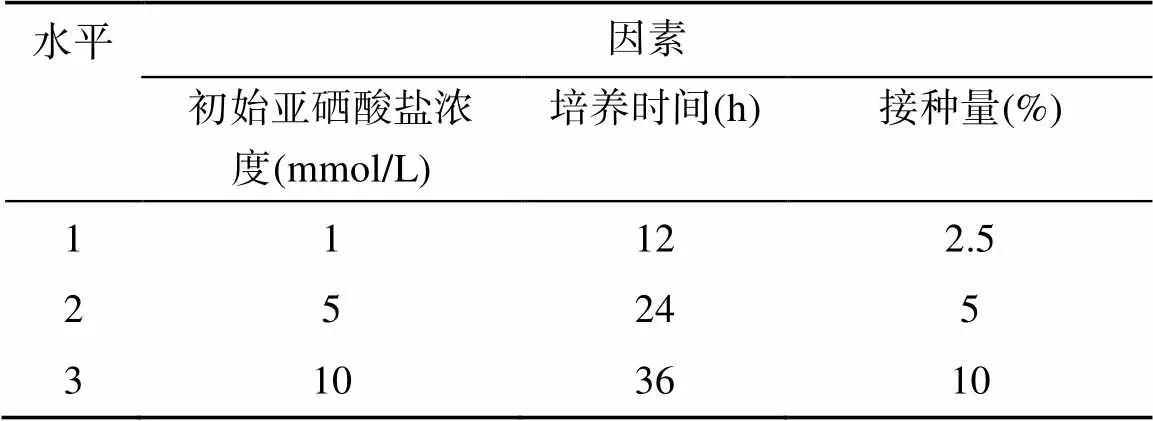
表1 正交试验因素及水平
1.8 数据分析
所有试验数据采用Microsoft Office Excel 2019 进行处理,利用SPSS 26.0 对数据进行方差分析,采用Origin 2021 和MEGA 7.0 对数据进行作图。
2 结果与分析
2.1 耐硒细菌的分离筛选
将土壤悬液稀释后添加到含有亚硒酸盐的固体培养基上,细菌菌落变为红色,用灭菌的接种环挑取不同形态的菌落分离提纯,分离出16 株可以还原亚硒酸盐的细菌。将它们作进一步耐硒分析,最终筛选出1 株具有较高硒耐性的细菌QZB-1,此细菌在亚硒酸盐浓度为180 mmol/L 的LB 固体培养基上仍能生长。观察LB 固体培养基上生长的QZB-1 菌株(图1A),细菌菌落为乳白色,中间隆起,边缘整齐,表面光滑不透明,菌落直径介于0.2 ~ 0.3 mm,革兰氏染色后呈阴性。在含亚硒酸盐浓度为1 mmol/L 的固体培养基上,如图1B 所示,QZB-1 菌株因将亚硒酸盐还原成红色单质硒,表现为外圈由乳白色包围的红色菌落。
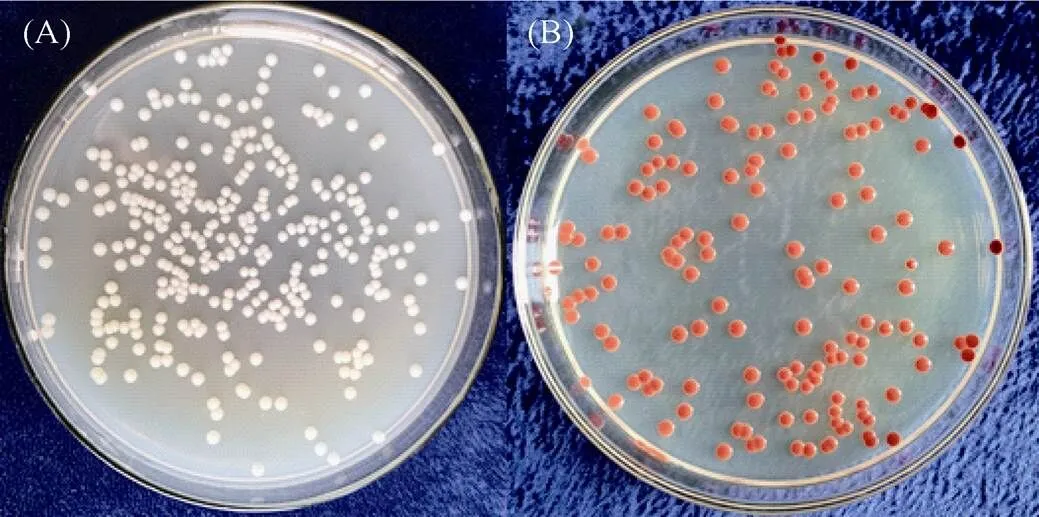
(图A 表示菌株QZB-1 在无硒LB 固体培养基上的菌落形态特征;图B 为菌株QZB-1 在含硒LB 固体培养基上的菌落形态特征,红色菌落表示亚硒酸盐还原成红色单质硒)
2.2 菌种鉴定
经过PCR 产物序列测定,菌株QZB-1 基因PCR 产物序列长度为1 397 bp。将所获得的菌株16S rDNA 基因序列通过GenBank 中的序列进行基因序列对比,选取与菌株QZB-1 同源性高,已定名的模式菌的序列信息。通过MEGA7.0 软件构建系统发育数,如图2 所示,菌株QZB-1 序列与PZ11 菌株相似性最高,高达99.93%。根据系统发育树分析,鉴定菌株QZB-1 为粘质沙雷氏菌()。
2.3 细菌在不同亚硒酸盐浓度胁迫下的生长曲线
为了探究细菌QZB-1 对亚硒酸盐(Se2O32–)毒性的反应,通过在培养基中添加不同浓度的亚硒酸钠,研究细菌的生长情况。从图3 可以看出,不加硒时细菌QZB-1 没有明显的生长停滞期,0 ~ 3 h 为生长对数期,3 ~ 24 h 细菌浓度上升变缓,24 ~ 36 h 进入稳定期并开始衰亡,细菌浓度逐渐减少。与不加硒相比,添加亚硒酸钠的培养基在培养了3 h之后均出现了深浅不同的红色,表明细菌具有将有毒的亚硒酸盐转化为无毒的红色单质硒的能力[28]。由于红色单质硒的干扰,很难用光谱法对培养基的细菌数进行定量,所以本试验采用稀释平板法来测定培养基中的活细胞数量。
细菌QZB-1 在添加了不同浓度的亚硒酸盐之后仍然保持良好的生长趋势,表明剧毒的亚硒酸盐对细菌QZB-1 生长的影响不显著。在细菌的初始生长阶段(0 ~ 3 h),各处理之间的生长情况差异不明显,但是在经过3 h的培养之后,不同硒浓度处理下的细菌生长曲线开始显现出差别。在5 mmol/L 浓度下,细菌的生物量比不加硒提升明显,在21 h 处,细菌生物量比对照的生物量多了2.63×108cfu/ml;在25 mmol/L 亚硒酸盐浓度下,其生物量在培养了9 h之后也比对照有不同程度的增加,上述研究表明低亚硒酸盐浓度不仅不会对细菌QZB-1 产生毒害,反而促进了细菌的生长。Li 等[29]的研究也证明适量的硒浓度有利于细胞的存活和生长,然而在Zhang 等[30]研究的不同硒浓度对微生物的生长影响中,硒的存在抑制了细菌的生长,这可能是本研究筛选的菌株具有更高硒耐性的原因。反之,在亚硒酸盐浓度为75 mmol/L 和160 mmol/L 之下,培养基中的生物量有了不同程度的减少,其中160 mmol/L 浓度下生物量比不加硒减少了27.2% 左右。试验结果表明在75 mmol/L 之后,随着培养基亚硒酸盐浓度的增加,其毒性会相应地增大,导致微生物量逐渐减少。本试验中菌株QZB-1 在160 mmol/L 浓度之下还能保持一定的生长,进一步证明了此菌株对毒性亚硒酸盐具有较高的耐性。
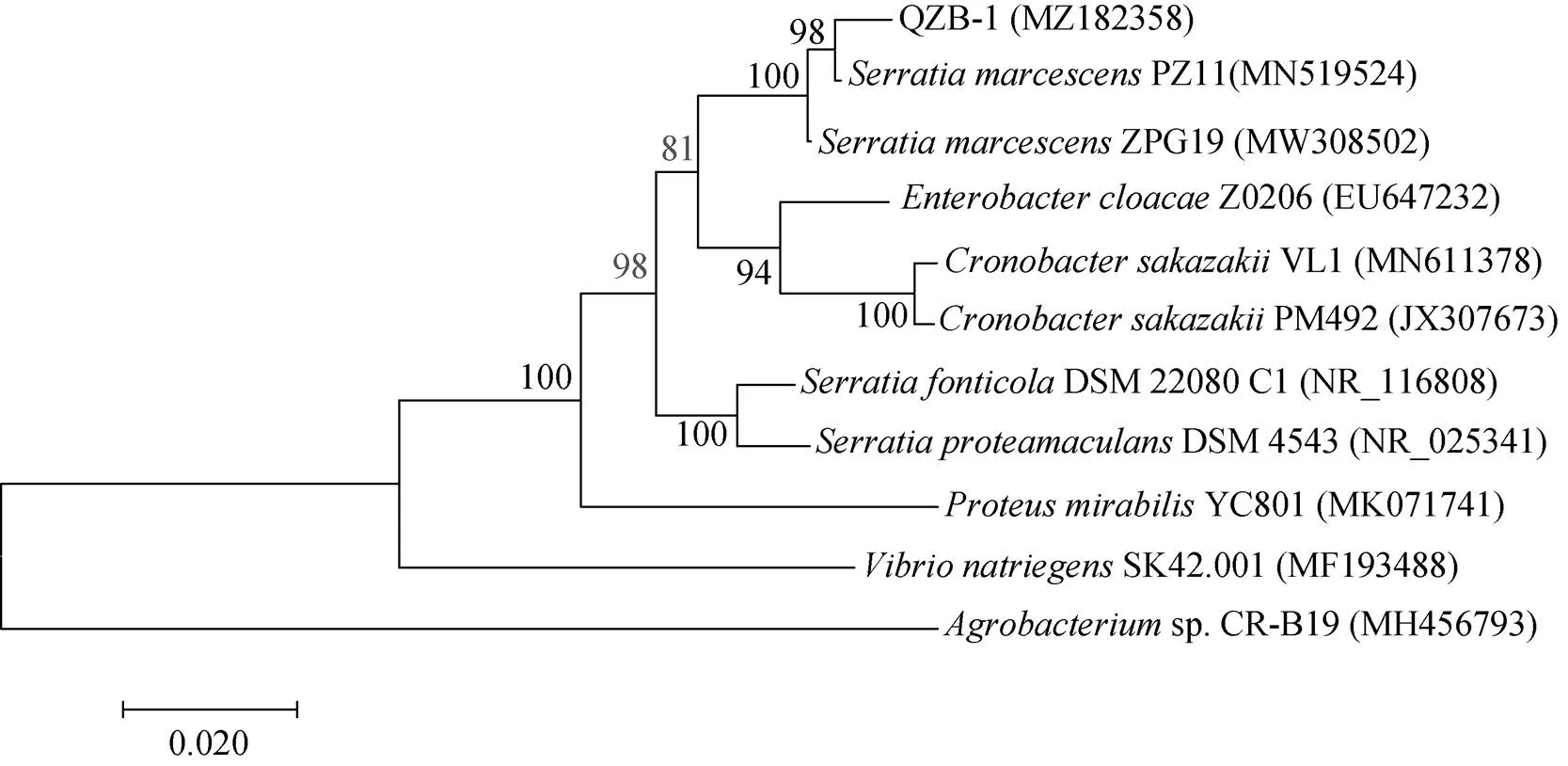
图2 基于细菌的16S rDNA 序列以邻接法构建的系统发育树
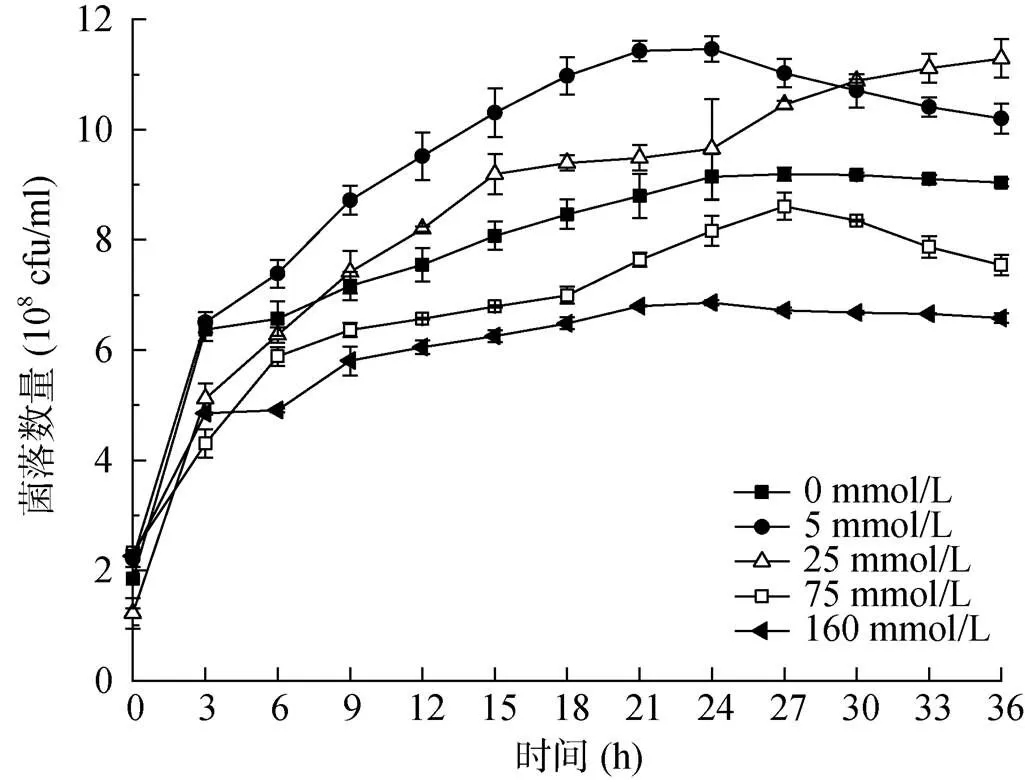
图3 细菌在不同亚硒酸盐浓度下的生长曲线
2.4 不同亚硒酸盐浓度对菌株还原率的影响
由图4 可知,在亚硒酸盐浓度小于25 mmol/L 的低硒浓度和相同培养时间下,随着亚硒酸盐浓度的增加,显著降低了菌株对亚硒酸盐的还原率,表明硒浓度升高对菌株还原亚硒酸盐具有较强的抑制作用。在亚硒酸盐浓度大于25 mmol/L 的高硒浓度下,相同的培养时间对菌株还原率的影响不显著,与1 mmol/L 硒浓度下的还原率相比,75 mmol/L 和160 mmol/L 的还原率显著降低,但后两者之间差异不显著,说明菌株对高硒浓度具有稳定的适应性。同时,在同一浓度下,硒还原率随着培养时间的增加而增加,并可能在某一时间点完全还原硒。目前国内外报道的亚硒酸盐还原菌试验中,还原率普遍偏低,在亚硒酸盐浓度同为1 mmol/L 的情况下,沈娥等[31]报道的亚硒酸盐还原菌在36 h 对亚硒酸盐的还原率仅为60% 左右;Kora[14]试验表明还原菌在48 h 内对1 mmol/L 的亚硒酸盐还原率为82.73% 左右,说明本研究分离筛选的亚硒酸盐还原菌具有比前人试验更高的还原效率。当前文献报道的亚硒酸盐还原菌有:地衣芽孢杆菌()[32]、贪铜杆菌()[31]、固氮红细菌()[33]、大肠杆菌()[3]等60 多种还原细菌[23]。其中粘质沙雷氏菌()也有少量的报道,但是对亚硒酸盐的耐性偏低或还原率较低[21-22],同时拥有较高的硒耐性和还原率的粘质沙雷氏菌()鲜有报道。
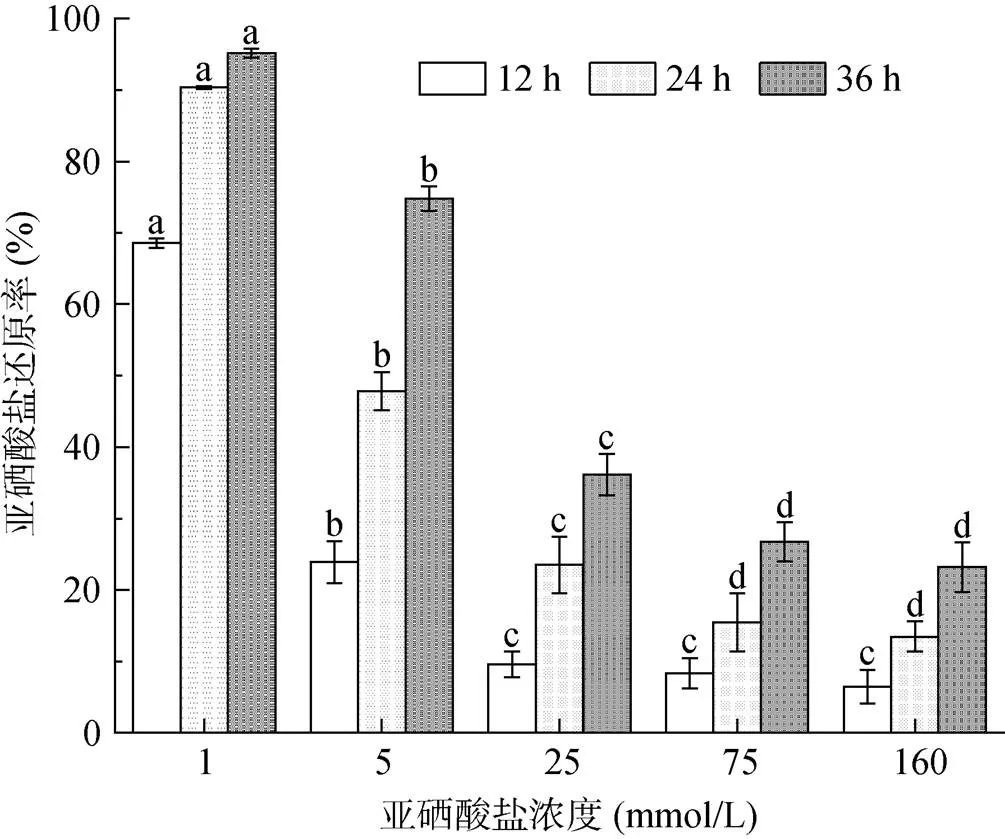
(图中小写字母不同表示同一培养时间下不同亚硒酸盐浓度处理间差异显著(P<0.05))
2.5 菌株还原亚硒酸盐的正交试验
由表2、表3 可知,3 个因素对菌株还原亚硒酸盐的效率均有一定的影响,但每个因素影响的显著性水平不同。根据极差分析值可知:初始亚硒酸盐浓度对细菌还原亚硒酸盐的影响最大,其次是培养时间和接种量,李丹等[34]的研究也证明了亚硒酸钠添加量对硒的转化率影响最大。由水平之间的差异性表明本次试验条件下最优组合为初始亚硒酸盐浓度为1 mmol/L、培养时间36 h、接种量10%,在此条件下可提高细菌对亚硒酸盐的还原效率。
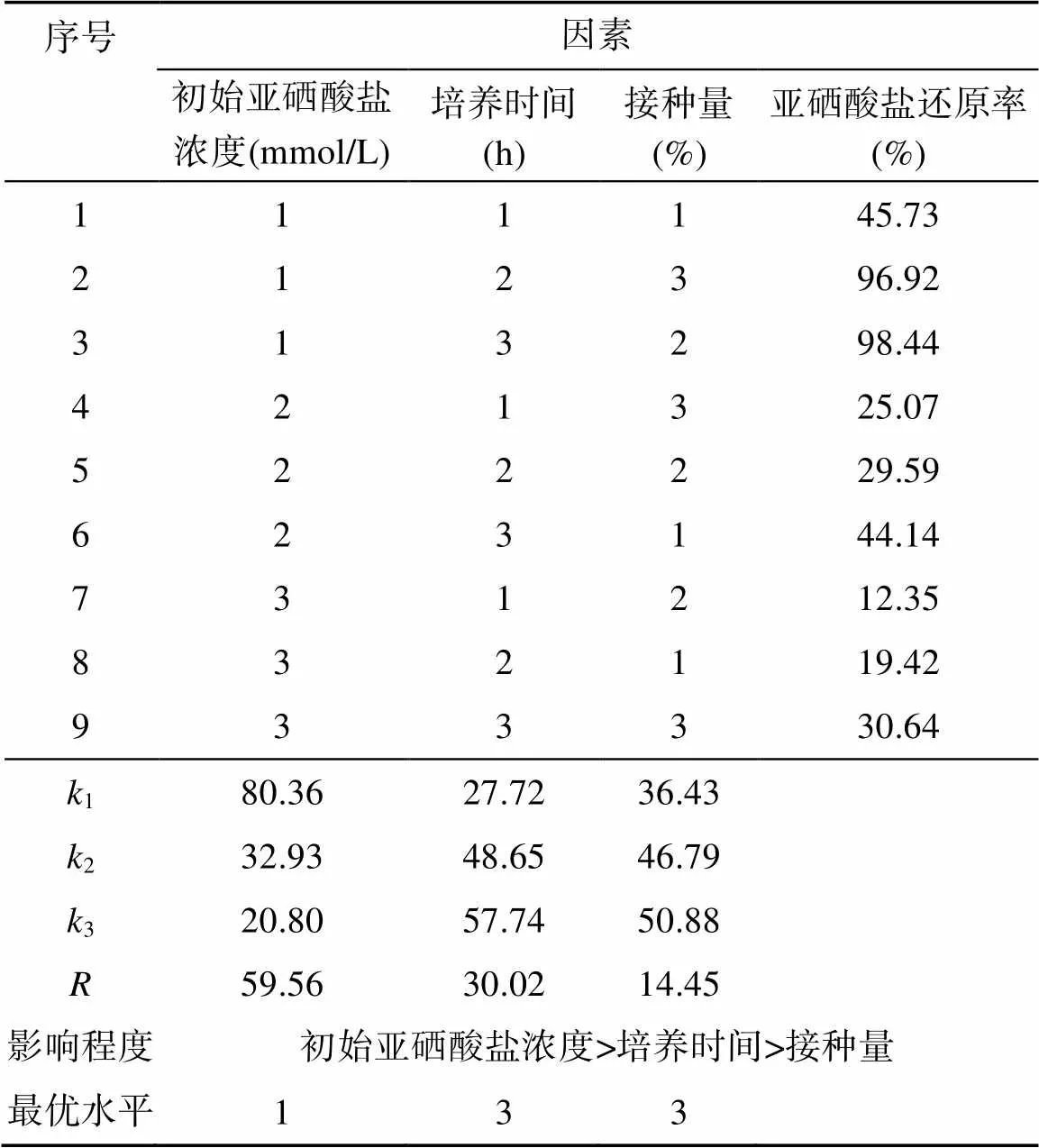
表2 菌株QZB-1 亚硒酸盐还原条件正交试验结果
注:1k2k3分别表示1、2、3 水平的平均值;表示同一个因素下1k2k3的极差。
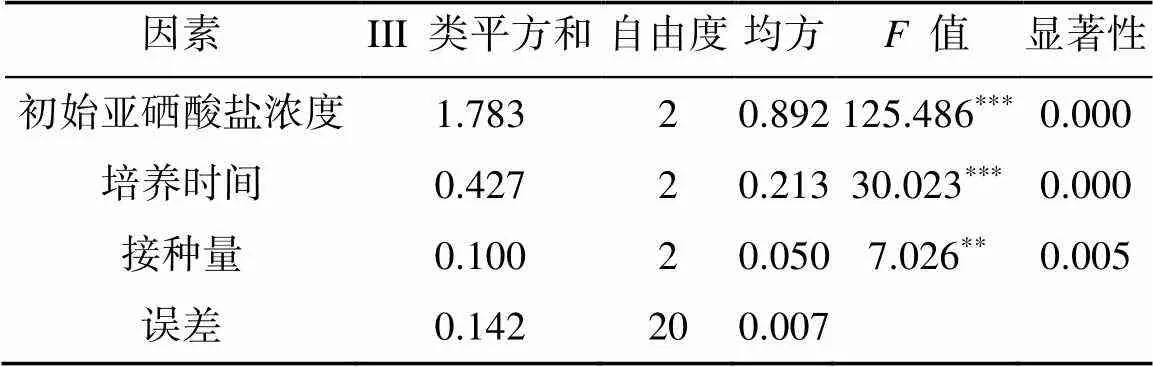
表3 正交试验的方差分析
注:***、**分别表示方差分析达<0.001和<0.01显著水平。
3 结论
从富硒区土壤分离筛选出一株具有硒耐性的菌株QZB-1,经16S rDNA 基因序列分析,将其鉴定为粘质沙雷氏菌()。菌株对亚硒酸盐的耐性高达180 mmol/L,同时QZB-1 具有较高的硒还原效率,在36 h 内对1 mmol/L 亚硒酸盐的还原率为95% 左右。正交试验结果表明三因素条件对菌株还原亚硒酸盐的影响顺序是初始亚硒酸盐浓度>培养时间>接种量。最佳的培养条件是初始亚硒酸盐浓度为1 mmol/L、接种量为10%、培养时间为36 h,该条件下菌株对亚硒酸盐的去除率高达98.55%。
[1] Cai Z L, Zhang J Z, Li H J. Selenium, aging and aging-related diseases[J]. Aging Clinical and Experimental Research, 2019, 31(8): 1035–1047.
[2] 范书伶, 王平, 张珩琳, 等. 环境中硒的迁移、微生物转化及纳米硒应用研究进展[J]. 科学通报, 2020, 65(26): 2853–2862.
[3] Zhu T T, Tian L J, Yu H Q. Phosphate-suppressed selenite biotransformation by[J]. Environmental Science & Technology, 2020, 54(17): 10713–10721.
[4] Gerardo B, Cabral Pinto M, Nogueira J, et al. Associations between trace elements and cognitive decline: An exploratory 5-year follow-up study of an elderly cohort[J]. International Journal of Environmental Research and Public Health, 2020, 17(17): 6051.
[5] González-Estecha M, Palazón-Bru I, Bodas-Pinedo A, et al. Relationship between serum selenium, sociodemographic variables, other trace elements and lipid profile in an adult Spanish population[J]. Journal of Trace Elements in Medicine and Biology, 2017, 43: 93–105.
[6] Vinceti M, Filippini T, Wise L A. Environmental selenium and human health: An update[J]. Current Environmental Health Reports, 2018, 5(4): 464–485.
[7] Ullah H, Liu G J, Yousaf B, et al. A comprehensive review on environmental transformation of selenium: Recent advances and research perspectives[J]. Environmental Geochemistry and Health, 2019, 41(2): 1003–1035.
[8] 覃建勋, 付伟, 郑国东, 等. 广西岩溶区表层土壤硒元素分布特征与影响因素探究——以武鸣县为例[J]. 土壤学报, 2020, 57(5): 1299–1310.
[9] 秦鹏一, 王敏, 殷国强, 等. 滕州表层土壤硒异常特征及来源分析[J]. 土壤, 2019, 51(2): 279–283.
[10] 黄树杰. 硒的环境污染特征及其防控技术[J]. 再生资源与循环经济, 2017, 10(4): 30–33.
[11] Yu Q, Boyanov M I, Liu J L, et al. Adsorption of selenite onto: The overlooked role of cell envelope sulfhydryl sites in the microbial conversion of Se(IV)[J]. Environmental Science & Technology, 2018, 52(18): 10400–10407.
[12] Wang X N, Zhang D Y, Pan X L, et al. Aerobic and anaerobic biosynthesis of nano-selenium for remediation of mercury contaminated soil[J]. Chemosphere, 2017, 170: 266–273.
[13] Song D, Li X, Cheng Y, et al. Aerobic biogenesis of selenium nanoparticles byZ0206 as a consequence of fumarate reductase mediated selenite reduction[J]. Scientific Reports, 2017, 7: 3239.
[14] Kora A J., selenite-reducing bacterium from contaminated lake of an industrial area: A renewable nanofactory for the synthesis of selenium nanoparticles[J]. Bioresources and Bioprocessing, 2018, 5: 30.
[15] Fischer S, Krause T, Lederer F, et al.JG-B5T affects the fate of selenium by extracellular production of colloidally less stable selenium nanoparticles[J]. Journal of Hazardous Materials, 2020, 384: 121146.
[16] Piacenza E, Presentato A, Zonaro E, et al. Antimicrobial activity of biogenically produced spherical Se-nanomaterials embedded in organic material againstandstrains on hydroxyapatite-coated surfaces[J]. Microbial Biotechnology, 2017, 10(4): 804–818.
[17] Kumar A, Prasad B, Manjhi J, et al. Antioxidant activity of selenium nanoparticles biosynthesized using a cell-free extract of[J]. Toxicological & Environmental Chemistry, 2020, 102(10): 556–567.
[18] Wang Z Z, Zheng Z, Hu H Z, et al. A point-of-care selenium nanoparticle-based test for the combined detection of anti-SARS-CoV-2 IgM and IgG in human serum and blood[J]. Lab on a Chip, 2020, 20(22): 4255–4261.
[19] Hu T, Li H F, Li J X, et al. Absorption and bio-transformation of selenium nanoparticles by wheat seedlings (L.)[J]. Frontiers in Plant Science, 2018, 9: 597.
[20] 程丹, 张红, 郭子雨, 等. 硒处理对土壤理化性质及杭白菊品质的影响[J]. 土壤学报, 2020, 57(6): 1449–1457.
[21] 廖青, 梁潘霞, 邢颖, 等. 广西富硒区土壤耐硒菌株的分离及鉴定[J]. 西南农业学报, 2017, 30(10): 2303–2307.
[22] 龙云川, 周少奇, 李荣华. 一株耐硒粘质沙雷氏菌及其硒还原特性[J]. 贵州科学, 2018, 36(1): 1–4.
[23] 朱建明, 雷磊, 肖湘, 等. 地衣芽孢杆菌对亚硒酸盐的还原[J]. 矿物岩石地球化学通报, 2011, 30(3): 245–250.
[24] 魏志敏, 孙斌, 方成, 等. 固氮芽孢杆菌N3的筛选鉴定及其对二月兰的促生效果[J]. 土壤, 2021, 53(1): 64–71.
[25] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[26] 黄秀梨, 辛明秀. 微生物学实验指导[M]. 2版. 北京: 高等教育出版社, 2008.
[27] 廖青, 刘永贤, 邢颖, 等. 土壤富硒细菌的筛选、鉴定[J]. 土壤, 2018, 50(6): 1203–1207.
[28] Xu X, Cheng W, Liu X, et al. Selenate reduction and selenium enrichment of tea by the endophyticsp. strain WT00C[J]. Current Microbiology, 2020, 77(4): 588–601.
[29] Li J L, Li W, Sun X T, et al. Selenophosphate synthetase 1 (SPS1) is required for the development and selenium homeostasis of central nervous system in chicken ()[J]. Oncotarget, 2017, 8(22): 35919–35932.
[30] Zhang J, Wang Y, Shao Z Y, et al. Two selenium tolerantsp. strains are capable of reducing selenite to elemental Se efficiently under aerobic conditions[J]. Journal of Environmental Sciences, 2019, 77: 238–249.
[31] 沈娥, 刘紫嫣, 周豪, 等.SHE好氧还原Se(Ⅳ)合成硒纳米颗粒的特性研究[J]. 环境科学学报, 2015, 35(10): 3065–3070.
[32] Yasir M, Zhang Y X, Xu Z X, et al. NAD(P)H-dependent thioredoxin-disulfide reductase TrxR is essential for tellurite and selenite reduction and resistance insp. Y3[J]. FEMS Microbiology Ecology, 2020, 96(9): fiaa126.
[33] 王东亮, 肖敏, 钱卫, 等. 还原亚硒酸盐产生红色单质硒光合细菌菌株的筛选与鉴定[J]. 微生物学报, 2007, 47(1): 44–47.
[34] 李丹, 李保珍, 张龙颜, 等. 光合细菌还原亚硒酸盐为红色单质硒的条件优化[J]. 山西农业科学, 2015, 43(5): 543–547.
Isolation,Identification and Characterization of Awith High Selenite Reduction Efficiency
WANG Mingshi, JIANG Daihua*, HUANG Xuejiao, LI Shenghui, ZHANG Yu, HUANG Jinlan, DENG Huawei, TIE Wenzhou
(College of Agriculture, Guangxi University, Nanning 530004, China)
A bacterium strain QZB-1 with high selenite reduction efficiency was isolated from Se-rich soil in Qinbei District of Qinzhou City, Guangxi Province. The strain was identified asthrough 16S rDNA gene sequence analysis. The results revealed that the strain could tolerate selenite concentration as high as 180 mmol/L. Further study suggested that the strain QZB-1 could reduce 95% of 1 mmol/L selenite within 36 hours, and selenite reduction rate decreased with the increase of selenite concentration. The orthogonal experiment indicated that the rank of influence degree by selenite reduction was initial selenite concentration > incubation time > inoculum. The optimal conditions for selenite reduced were as following: initial selenite concentration 1 mmol/L, inoculation volume 10%, and incubation time 36 hours. Under these conditions, selenite reduction rate was more than 98.55%. The findings suggested that the novel selenite reducing strainQZB-1can efficiently reduce selenite to elemental selenium nanoparticles, and can be effectively applied in the bioremediation of selenite polluted soil and water.
; Selenite reduction; Isolation; Identification; Characterization
S154.39
A
10.13758/j.cnki.tr.2022.02.014
王明释, 蒋代华, 黄雪娇, 等. 一株高效还原亚硒酸盐的粘质沙雷氏菌的分离鉴定及特性. 土壤, 2022, 54(2): 314–319.
广西科技重大专项(桂科 AA17204037-3)和国家自然科学基金项目(41661076)资助。
(dhjiang2008@gxu.edu.cn)
王明释(1993—),男,广西凭祥人,硕士研究生,主要从事土壤生态学研究。E-mail: 379534014@qq.com

