基于网络药理学与GEO生信统计的瘀血痹抗类风湿性关节炎的活性成分及作用机制研究△
孙彩虹,杨志城,房庆伟,吴若铭,李坤,叶冠
上海医药集团股份有限公司 中央研究院,上海 201203
类风湿关节炎(rheumatoid arthritis,RA)是一种以侵蚀性关节炎为主要临床表现的慢性进行性自身免疫病,高发年龄为30~50 岁,女性患者约占75%[1]。RA 病因不明,研究显示可能与环境、外伤、感染、遗传、雌激素、精神状态等相关;临床症状以关节滑膜炎和关节损伤为主,表现为关节疼痛、肿胀等;病情发展亦伴随骨与软骨组织进行性破坏,导致关节畸形严重,影响患者生活质量[2]。
目前,RA尚无根治性治疗手段,常用化学药物为非甾体类解热镇痛抗炎药、糖皮质激素等,不良反应较多,而抗体类药物应用范围受限于其给药方式及价格。中医学者辨证分析认为RA 属“痹症”,内因为正气不足,外因为外邪侵袭[3],并在长期医疗实践中积累了丰富的临床经验。瘀血痹胶囊是临床常用抗RA 中成药,由当归、丹参、乳香(炙)、没药(炙)、威灵仙、红花、川牛膝、川芎、姜黄、香附(炙)、黄芪(炙)11 味中药组成,具有活血化瘀、通络止痛的功效,主治瘀血阻络所致的痹证,可有效改善患者关节炎症及疼痛症状。截至目前,该药物抗RA 的研究主要集中于实验动物或临床药效学观察[4-5],作用机制也仅有临床抗炎报道[6]。近年来通过网络药理学研究RA 的报道较多,以网络理论和系统生物学原理为基础,从整体上探讨药物与RA的相关性,与中药复方“多成分、多靶点”特点吻合,是探究中药复方治疗疾病作用机制的有效途径。本研究通过网络药理学研究手段获得瘀血痹胶囊潜在的抗RA 活性化学成分及作用靶点信息,结合药动学筛选、蛋白质-蛋白质相互作用(PPI)、生物作用和信号通路富集分析方法,构建药物-成分-靶点-疾病网络,探究瘀血痹胶囊抗RA 的机制,并通过生物信息学分析及分子对接技术进行虚拟验证,为其科学合理应用和后续研究提供参考[7-8]。
1 材料与方法
1.1 化学成分的收集与筛选
采用中药系统药理学数据库与分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php),以瘀血痹胶囊组方单味药中文名进行检索,收集整理中药成分数据。以口服生物利用度(OB)≥30%、类药性(DL)≥0.18 为筛选条件,将活性成分纳入后续研究。
1.2 靶点收集和网络构建
通过TCMSP收集活性成分的作用靶点,靶点名称输入UniProt数据库(https://www.uniprot.org)进行标准化。以“rheumatoid arthritis”为检索关键词在GeneCards 数据库(http://www.genecards.org)检索,获得与RA 相关的靶点。将药物靶点与疾病靶点整合绘制韦恩图,得到交集靶点和药物-活性成分-靶点网络。
1.3 PPI分析
在STRING 11.0 数据库(https://string-db.org)中选择“multiple proteins”模式,导入上述获得的交集靶点,设置物种为“homo sapiens”进行检索,分析靶点蛋白之间的相互作用(combined_score);将交互作用的最小阈值设置为“medium confidence=0.4”,网络类型选择“full string network”,隐藏无相互作用的点后绘制PPI图。
将STRING 11.0 数据库中得到的靶点PPI 网络文件导入Cytoscape 3.7.2 软件,根据度(degree)值筛选得到药物作用排名前30的关键靶点。
1.4 基因本体(GO)分析
将得到的潜在靶点导入Bioconductor 数据库(http://www.bioconductor.org)进行GO 分析,包括分子功能(MF)、生物过程(BP)和细胞组成(CC)3 个部分,得到瘀血痹胶囊潜在抗RA 靶点与其对应的GO条目之间的相互关系。
1.5 京都基因与基因组百科全书(KEGG)分析
将得到的潜在靶点导入Bioconductor数据库进行KEGG分析,对潜在靶点进行通路富集,获取瘀血痹胶囊作用的相关信号通路和可能的抗RA机制。
1.6 RA样本数据下载
登录美国国立生物技术信息中心(NCBI)的GEO(Gene Expression Omnibus,http://www.ncbi.nlm.nih.gov/geo)数据库检索“rheumatoid arthritis”样本。纳入标准:样本应包含RA 样本与常规滑膜炎样本(Normal);样本为人组织来源(homo sapiens)且芯片数据类型为基因表达谱。
1.7 差异基因分析及验证靶点筛选
采用GSEA 4.1.0 对注释后的表达矩阵进行分析,设置Number of permutations=1000;Phenotype Labels 为 RA VS Normal;Permutation type 为Phenotype,取前2000为RA与常规滑膜炎差异基因。差异基因与疾病-药物交集靶点取交集,即得验证靶点。
1.8 分子对接
于RCSB PDB 数据库(https://www.rcsb.org/)中下载上述筛选出的拟验证靶点蛋白晶体结构,于PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)中下载化合物-靶点网络图中度值排名前10 的化合物结构,分别对蛋白和小分子进行去水、加氢、能量最小化等前处理后,采用LibDock 进行分子对接。
2 结果
2.1 瘀血痹胶囊潜在活性成分筛选
共检索瘀血痹胶囊有效成分1449个,以OB≥30%及DL≥0.18 为筛选标准,去除无相关作用靶点化合物及重复化合物,最终获得潜在活性成分128个。
2.2 瘀血痹胶囊抗RA靶点预测
共检索瘀血痹胶囊潜在作用靶点11 504 个,与潜在活性化合物进行交集检索、去重,获得124 个靶点。共检索得到RA 靶点4465 个。将瘀血痹胶囊124 个成分作用靶点与RA 靶点进行交集分析,得到85 个化合物靶点与疾病靶点的交集靶点,这些交集靶点预测为瘀血痹胶囊抗RA的靶点(图1)。

图1 瘀血痹胶囊活性成分靶点与RA靶点韦恩图
2.3 瘀血痹胶囊活性成分-RA 靶点网络构建及PPI核心靶点筛选
采用Cytospase 3.7.2 软件构建瘀血痹胶囊活性成分-RA 靶点调控网络(图2),节点为靶标或化合物,连线表示成分与靶标之间互作关系,由图2 可知,瘀血痹胶囊复方通过多成分、多靶点发挥协调作用。
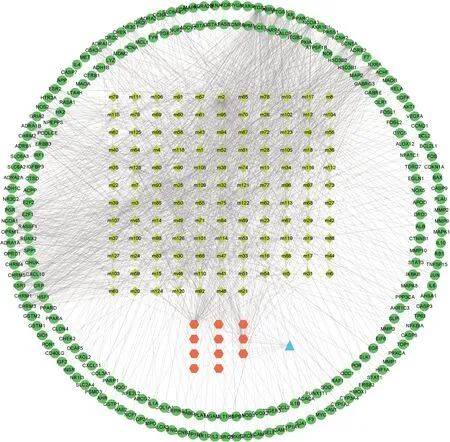
图2 瘀血痹胶囊治疗RA的药物-成分-疾病-靶点网络
基于STRING 11.0 数据库,获得瘀血痹胶囊治疗RA 的85 个靶点PPI网络,该网络包括85 个节点,910 条相互作用线,平均节点度值为21.4,局部聚类系数为0.635。同时,根据PPI 网络分析得到度值排名靠前的28 个靶点(核心靶点),利用R 脚本进行绘图分析,结果见图3。通过network analyzer 对PPI 网络进行分析,以成分作用靶点个数为指标排序,结果见表1,共有成分可能为瘀血痹胶囊复方药物抗RA的主要活性成分。
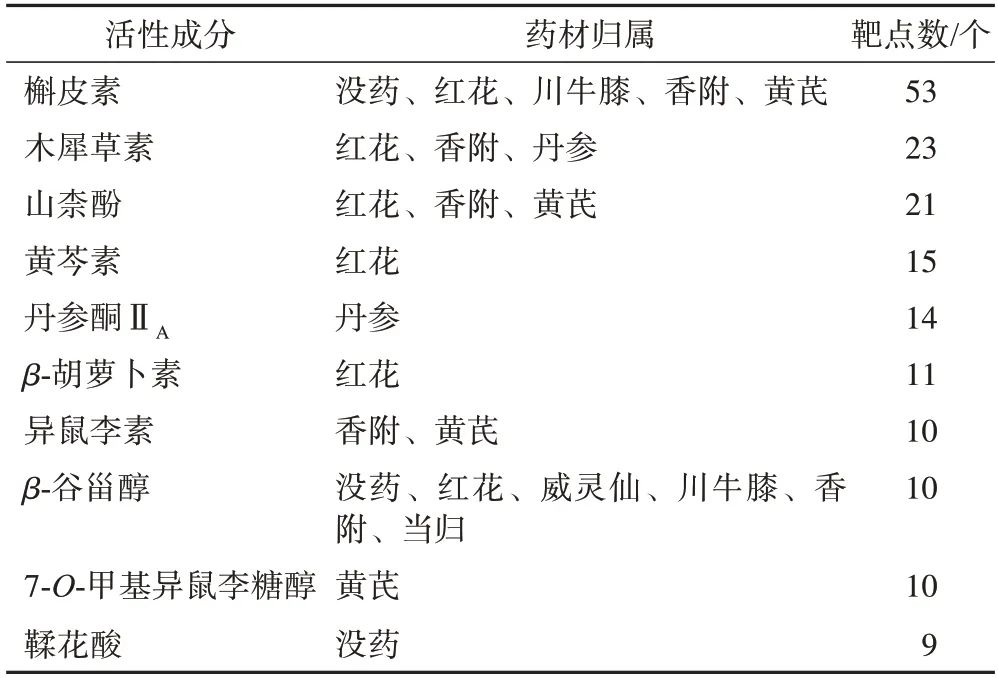
表1 瘀血痹活性成分对应靶点数及归属药味(前10位)

图3 瘀血痹治疗RA交集靶点PPI网络
靶点PPI 网络中度值较大的靶点,如白细胞介素-6(IL-6)、血管内皮生长因子A(VEGFA)、白蛋白(ALB)、表皮生长因子受体(EGFR)仅与少数(1~4 个)中药活性分子相互作用,且这些成分为多个中药的共有成分。提示瘀血痹胶囊中的少数、共有或主要活性成分可以通过核心靶点起到相对强的药理作用。此外,雌激素受体α(ESR1,度值为47)、雄激素受体(AR,度值为39)、过氧化物酶体增生激活受体γ(PPARG,度值为35)、孕酮受体(PGR,度值为28)和核受体亚家族3C 组成员1(NR3C1,度值为29)可以与10 个以上的不同药材归属的化合物相互作用,这些靶点均为细胞核受体。核受体作为核心靶点通过调控多个基因表达从而对多个蛋白靶点发挥调节作用。因而,核受体在RA的发病和治疗机制上的作用值得关注和研究。
2.4 GO分析
采用ClusterProfiler软件包将前28 个共同作用靶点进行GO 功能分析,结果见图4,GO 有向无环分析结果显示,瘀血痹抗RA 作用主要分为调节受体活性、核酸转录因子活性与DNA 结合区活性、核心启动子近端区DNA 结合,进一步调节蛋白质异二聚化、转录激活因子活性、核受体活性、类固醇激素受体活性、激活转录因子结合、类固醇结合等生物过程(图5)。前5 条GO 条目主要与VEGFA、EGFR、原癌基因蛋白FOS(FOS),酪氨酸激酶受体2(ERBB2),转录因子p65(RELA),孕激素受体(PGR)、连环蛋白β-1(CTNNB1)、NR3C1、雄激素受体(AR)、ESR1等靶点相关(图6)。

图4 瘀血痹胶囊治疗RA交集靶点GO富集分析气泡图

图5 瘀血痹胶囊抗RA靶点GO富集分析有向无环图
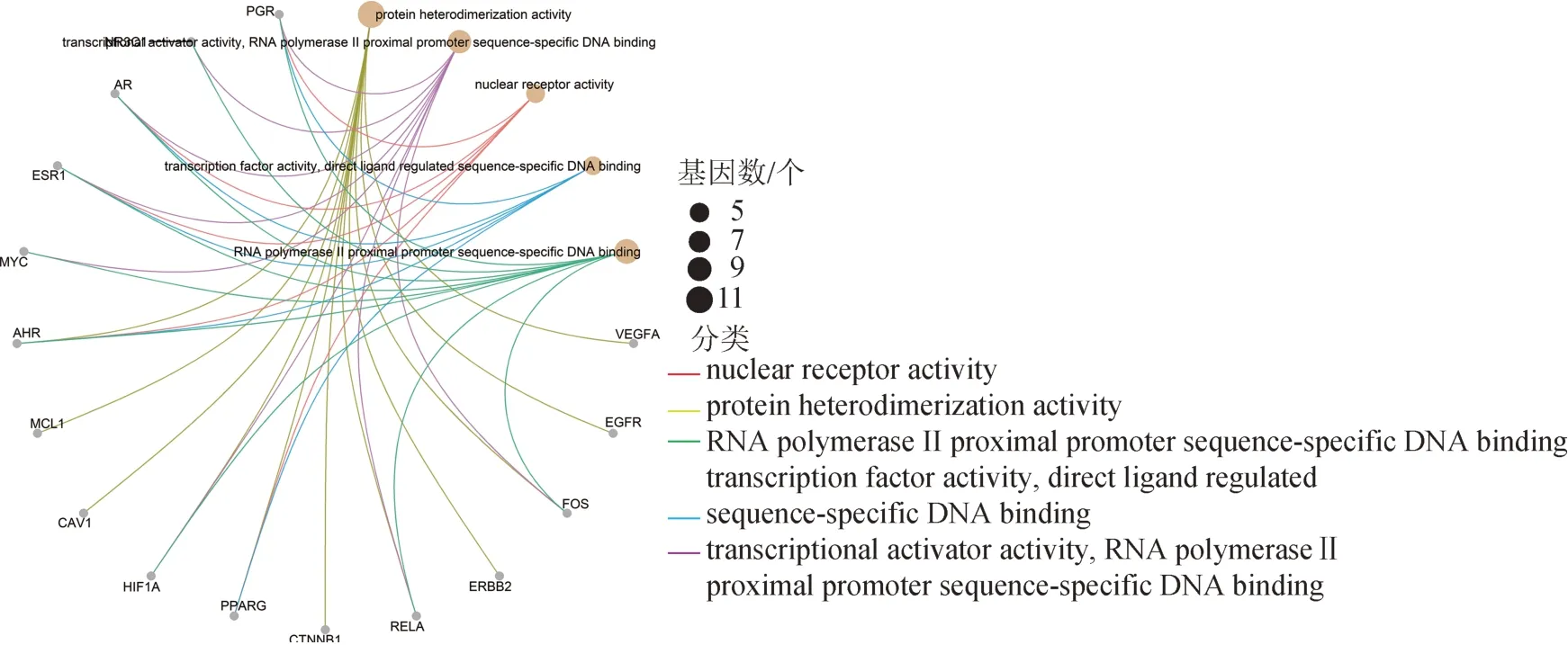
图6 瘀血痹胶囊抗RA靶点GO富集分析弦图(前5)
2.5 瘀血痹胶囊抗RA核心通路筛选
以FDR>0.01 为依据挑选前20 条路径,结果见图7,结果显示,瘀血痹胶囊发挥抗RA 作用主要通过调节心血管、炎症反应、病毒感染、癌症、激素分泌、免疫、中枢神经系统等相关信号通路。靶点-通路相互作用(图8)分析结果显示,多个靶点对应一条通路,体现出多靶点的协同作用,或者同一个靶点对应多条通路,同时调节多种酶蛋白和信号转导,起到多通路共同参与疾病治疗作用。其中FOS、NFKB 抑制剂α(NFKBIA)、核转录因子-κB激酶亚基β抑制剂(IKBKB)、RELA、关联死亡启动子重组蛋白(BCL2)、半胱氨酸蛋白酶-3(CASP3)、G1/S-特异性周期蛋白-D1(CCND1)、丝氨酸/苏氨酸蛋白激酶(RAF1)、CASP9 等靶点对前5条通路贡献最大。

图7 瘀血痹胶囊治疗RA交集靶点KEGG通路气泡图
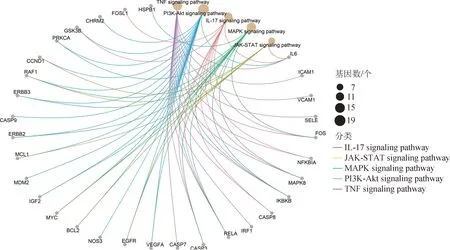
图8 瘀血痹胶囊抗RA靶点KEGG通路分析弦图
2.6 差异基因选取及分子对接验证
为展示2 组基因的差异表达情况,绘制GSE55457 数据集火山图(图9),RA 组与常规滑膜炎组表达差异前50 基因热图(图10)所示,将排名靠前的差异基因与上述交集靶点取交集(图11),筛选出IL-6、丝裂原活化蛋白激酶8(MAPK8)、NR3C1、多不饱和脂肪酸5-脂氧合酶(ALOX5)、IKBKB、EGFR、AR、Myc 原癌基因蛋白(MYC)、CASP3、淀粉样β前体蛋白(APP)、杆状病毒IAP重复蛋白5(BIRC5)、CTNNB1、DNA 修复酶1(PARP1)、NAD(P)H脱氢酶[醌]1(NQO1)、内皮素转化酶1(ECE1)、G2/有丝分裂特异性细胞周期蛋白-B1(CCNB1)为差异表达的核心基因。采用分子对接对靶点及核心化合物进行验证。
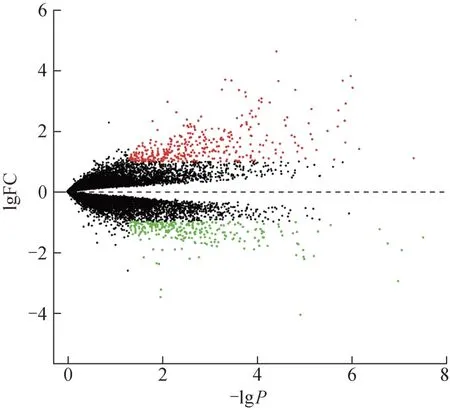
图9 RA组与正常组基因差异表达火山图

图10 RA组与正常组基因差异表达热图(前50)

图11 差异表达基因与RA-瘀血痹交集靶点韦恩图
将瘀血痹胶囊活性成分-RA 靶标调控网络图中与RA 靶点相关性排名前10 的活性成分作为分子对接配体,将基因表达差异筛选到的核心基因蛋白作为分子对接受体,采用LibDock 进行分子对接,对接得分值见表2。由表2可知核心化合物与IL-6对接活性最好,其次为PARP1、IKBKB、AR、CASP3、EGFR、MAPK8、ALOX5 等靶点;β-谷甾醇、鞣花酸、7-O-甲基异鼠李糖醇、木犀草素、槲皮素、异鼠李素、山柰酚、β-胡萝卜素等核心化合物与各差异基因对接分数较高。部分化合物与靶点对接模式见图12。
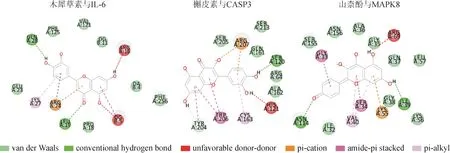
图12 瘀血痹胶囊治疗RA的部分核心化合物与靶点对接模式图
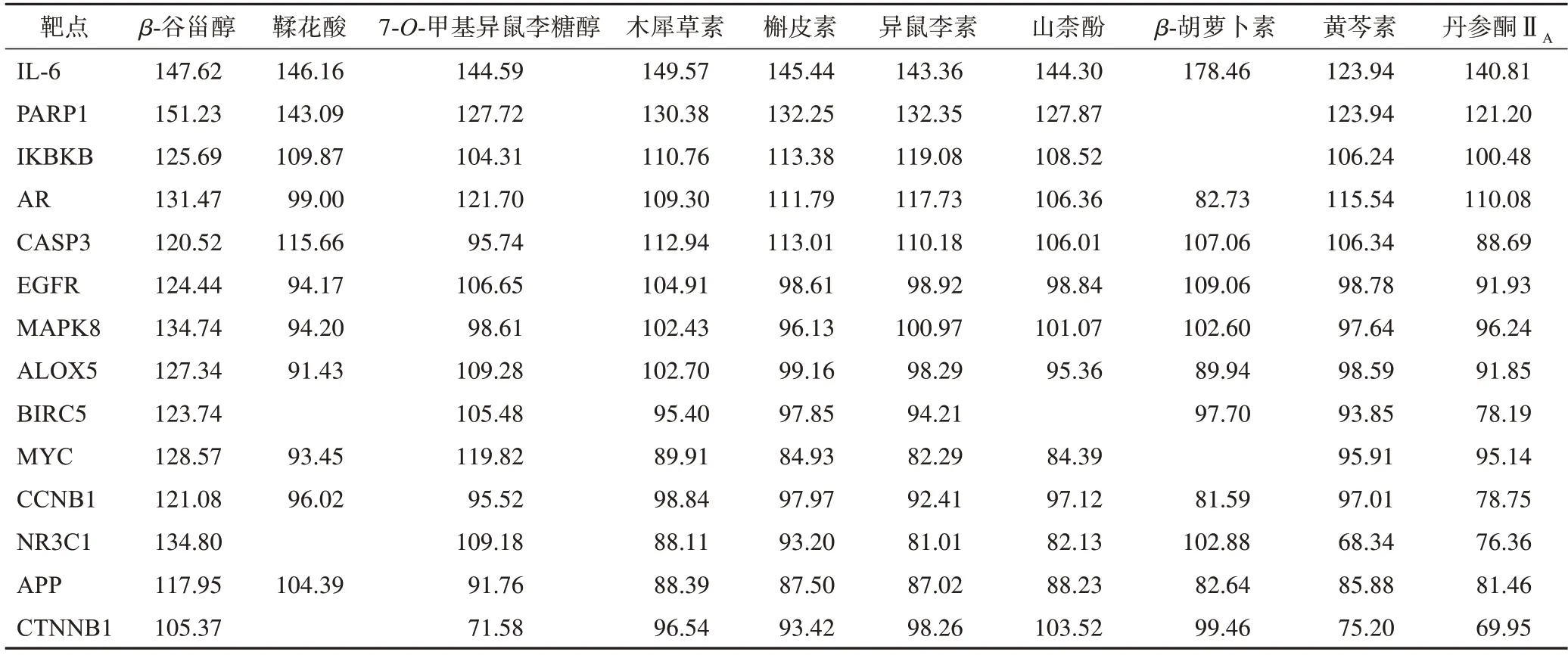
表2 瘀血痹胶囊治疗RA靶点与核心化合物对接得分值
3 讨论
本研究通过网络药理学对瘀血痹胶囊进行活性成分筛选、靶点预测和网络分析;结合GEO 数据库基因芯片数据,明确瘀血痹胶囊治疗RA 的核心靶点,并通过分子对接初步验证了其合理性。结果共得到活性化合物128 个,其中丹参所含活性化合物最多,其次为没药、红花、黄芪;瘀血痹胶囊治疗RA 潜在靶点85 个,筛选出核心靶点16 个,分子对接结果表明β-谷甾醇、鞣花酸、7-O-甲基异鼠李糖醇、木犀草素、槲皮素、异鼠李素、山柰酚、β-胡萝卜素等核心化合物可能与IL-6、PARP1、IKBKB、AR、CASP3、EGFR、MAPK8、ALOX5 等靶点相互作用来治疗RA,说明瘀血痹胶囊治疗RA 具有多成分-多靶点-多通路的特点。
槲皮素、木犀草素、山柰酚作用的RA 靶点数最多,分别为53、23、21 个,分子对接结果也显示其与核心靶点对接活性较高。槲皮素为瘀血痹胶囊复方中没药、红花、川牛膝、香附、黄芪的共有活性成分,为黄酮类化合物,现有研究证明其药理作用广泛,包括抗关节炎、抗糖尿病、抗高血压病、抗病毒、抗感染、抗衰老及心血管保护作用等[9]。现有研究表明,槲皮素可通过降低肿瘤坏死因子-α(TNF-α)、IL-1β、IL-17 和单核细胞趋化蛋白-1(MCP-1)水平从而对C57BL/6 小鼠胶原诱导性关节炎起重要作用[10],并有学者指出包括IL-6、TNF-α、IL-1β、前列腺素E2(PGE2)、环氧合酶2(COX-2)、诱导型一氧化氮合酶(iNOS)在内的炎症介质的含量被槲皮素显著下调[11]。木犀草素为瘀血痹胶囊中红花、香附、丹参的共有活性成分,是一种天然黄酮类化合物,动物实验证明其具有抗炎、抗过敏和抗癌等作用[12],可以通过影响多种炎性信号通路[核转录因子-κB 信号通路、MAPK 信号通路、酪氨酸蛋白激酶家族-信号转导子和转录激活子(JAKSTAT)信号通路、磷脂酰肌醇3-激酶-蛋白激酶B(PI3K-Akt)信号通路]抑制炎性细胞因子和炎症介质的表达等缓解炎症成纤维细胞样滑膜细胞的侵袭性迁移,显著影响类风湿性关节炎病理过程[13],现有研究表明木犀草素可抑制胶原诱导的关节炎大鼠滑膜成纤维细胞的增殖及降低IL-6、IL-8、IL-15 和转化生长因子-β(TGF-β)的表达从而发挥治疗RA的作用[14]。山柰酚为瘀血痹胶囊中红花、香附、黄芪的共有活性成分,亦为黄酮类化合物,具有抗氧化、抗菌和抗炎作用[15-16],为有效的免疫抑制剂,可减少有害的免疫反应,包括自身免疫和慢性炎症[17]。Pan等[18]研究结果表明,山柰酚通过阻断MAPK通路激活而不影响TNF-α受体的表达来抑制RA 中成纤维细胞样滑膜细胞的迁移和侵袭。在本研究中,槲皮素、山柰酚和木犀草素与大量RA 靶点相互作用,表现出抗炎、镇痛等作用。此外,槲皮素、木犀草素、山柰酚具有较高的OB,可能为瘀血痹胶囊主要发挥药效的潜在物质基础。其余瘀血痹胶囊活性成分如黄芩苷[19]、丹参酮ⅡA[20]及共存于5 种中药中的β-谷甾醇[21]和豆甾醇[22],均有研究表明其可减轻RA等炎症反应。
此外,分子对接活性较好的还有PARP1、EGFR、MAPK8 等核心靶点。PARP1 是一种核酶,主要是通过减少炎症介质表达、减少炎症细胞与炎症区域坏死细胞以及炎症部位的募集受损从而显示出抗炎作用。PARP1还通过调节PARP-1酶活性从而调节促炎基因的激活过程,如NF-κB、激活蛋白1(AP-1)、AP-2、转录阻遏物蛋白YY1(YY1)、转录因子Oct-1(Oct-1)、信号转导因子和转录激活因子1(Stat-1)、Myb 相关蛋白B(B-MYB)、缺氧诱导因子-α(HIF-α)、转录因子SP-1(SP-1)[23]。对称性肿胀的滑膜关节是RA 的一个特征,由白细胞浸润、抑制滑液白细胞凋亡和部位滑膜增生引起[24]。EGFR 在侵袭性肿瘤生长中起着至关重要的作用[25]。最近的研究表明,RA 患者的血清和滑液EGFR 水平均显著高于健康对照组[26],EGFR 是治疗RA 患者关节炎症的关键靶点[27]。RA 是一种骨代谢紊乱疾病,成骨细胞的骨形成与破骨细胞的骨吸收之间的不平衡已被证明对该疾病的发生有直接影响,线粒体的选择性自噬可能在调节成骨细胞和破骨细胞的增殖、分化和功能方面发挥重要作用,而MAPK8/叉头框蛋白O3(FOXO3)通路,已被揭示在线粒体自噬过程中发挥调节作用[28]。Gómez-Puerto 等[29]研究了人骨髓间充质干细胞(MSCs)的成骨分化,发现FOXO3 被ROS 激活过程主要依赖于MAPK8 诱导FOXO3 的Ser294 磷酸化,并且FOXO3 激活在通过自噬激活调控ROS水平方面作用显著。
综上,本研究基于网络药理学手段系统分析并总结出瘀血痹胶囊活性成分通过靶点蛋白发挥抗RA的药理学作用机制,通过GEO 数据库挖掘出常规滑膜炎患者与RA 患者差异表达基因并取交集基因,并通过分子对接手段验证了上述研究结果的合理性。网络药理学的研究结果显示,瘀血痹胶囊中的多个活性成分通过作用于多个靶点、多条通路共同实现对RA 的治疗作用。这些靶点和通路主要涉及细胞炎性因子、细胞生长因子及影响线粒体自噬过程等,提示瘀血痹胶囊治疗RA 的作用机制与调节炎性信号通路、促进血管新生及调控线粒体自噬相关。该结果对瘀血痹胶囊的临床合理使用及二次开发具有重要理论价值。

