七叶一枝花中两个尿苷二磷酸糖基转移酶基因的克隆和原核表达
宋发军,吕昕芮,刘祖懿,杨瑞霜,王红莹,孟艳艳
(中南民族大学 生命科学学院&生物技术国家民委重点实验室&武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉 430074)
七叶一枝花(Paris polyphyllavar.Chinensis)是百合科重楼属(ParisL.)多年生草本植物,其根状茎中所含的重楼皂苷是七叶一枝花最主要的药用成分.重楼皂苷具有抗癌、止痛、解蛇毒等多重功效[1].目前,重楼皂苷的获取主要依赖于从药源植物根状茎中提取[2],但重楼野生资源匮乏,重楼属植物的种子自然萌发率低、休眠期长,重楼皂苷的供需矛盾日益突出[3].因此,解析及表征重楼皂苷生物合成途径中的关键基因,对实现人工合成重楼皂苷和保护野生重楼种质资源具有重要意义.
目前研究将重楼皂苷合成途径分为4个部分:第一部分与萜类皂苷合成途径上游一致,主要经过甲羟戊酸途径或2-甲基-D-赤藓糖醇-4-磷酸途径[4];第二部分主要生成具有甾体皂苷环状骨架的环阿屯醇[5];第三部分为甾体皂苷元生成过程中的多种结构修饰[6-9];最后部分是甾体皂苷元经过糖基转移酶的催化,形成各类重楼皂苷,该步骤决定了重楼皂苷的生物学活性和功能.糖基转移酶广泛存在于不同植物中,其中与植物次生代谢产物合成密切相关的为尿嘧啶核苷二磷酸依赖型糖基转移酶(UDPGlycosyltransferase,UGT)[10].目前重楼皂苷合成途径的第三、第四部分过程仍然未被解析清楚,重楼属植物中有关UGTs的研究还很少.因此研究重楼中参与皂苷合成的多个UGTs有助于揭示重楼皂苷的合成机制.本研究在获得可能参与重楼皂苷合成的2个候选UGTs基因(PpUGT01和PpUGT42)的基础上,进一步利用电子克隆、原核表达、体外酶促反应等方法对其展开深入研究,以期为筛选与重楼皂苷合成相关的UGTs及解析其作用提供基础.
1 材料与方法
1.1 材料与试剂
实验室前期保存的七叶一枝花根状茎、茎、叶、花、果荚及种子的cDNA样品.pET-28b(+)载体(武汉淼灵生物);pATX-SUMO载体(武汉普健生物惠赠);pMD18-T载体(TaKaRa);质粒提取、胶回收试剂盒(OMEGA);E.coliDH5α感受态细胞、E.coliBL21感受态细胞(昂羽生物);Bradford法蛋白浓度测定试剂盒(北京索莱宝);高保真Taq酶(北京聚合美生物);DNA限制性内切酶(Neb);T4 DNA Ligase(Thermo).
1.2 实验方法
1.2.1 候选UGTs基因全长的电子拼接
将NCBI网站上滇重楼(Paris polyphyllavar.yunnanensis)的34个SRA数据库与本实验前期得到的两个候选UGTs基因(PpUGT01和PpUGT42)进行本地Blast分析并拼接其全长.利用ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)预测ORF.
1.2.2 候选UGTs基因的生物信息学分析
利用ProtParam(http://web.expasy.org/protparam/)分析两个候选UGTs基因所编码蛋白的基本理化性质,如氨基酸数量、分子量及等电点等.采用Blastn(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对同源核酸序列.使用MEGA-X-10.0.5软件构建Neighbor-joining系统进化树.
1.2.3 候选UGTs基因的克隆
以七叶一枝花cDNA为模板扩增候选基因,引物设计选择primer 5.0软件(引物序列见表1),使用2×M5 HiPer plus Taq HiFi PCR mix(with blue dye)进行基因cDNA序列的扩增.PCR程序为:95℃,3 min;94℃25 s,70℃25 s(每个循环降低1℃),72℃25 s,35个循环;72℃,5 min.扩增结束后,取2µL扩增产物电泳检测,回收目的片段并测序.本实验所有测序均由上海生工完成.

表1 基因扩增的引物序列Tab.1 Primers for gene amplification
1.2.4PpUGT01和PpUGT42原核表达引物的设计
PpUGT01ORF序列的酶切位点不含NdeⅠ和SalⅠ位点,故在其引物的上游和下游分别引入NdeⅠ和SalⅠ位点.PpUGT42的酶切位点分别为BamH I和XhoI.所用引物见表2.

表2 原核表达的引物序列Tab.2 Primers for prokaryotic expression
1.2.5PpUGT01的连接及转化
反应体系:1µLPpUGT01,2.5µL pET-28b(+),0.5µL T4 DNA Ligase,1µL 10×T4 Ligase buffer,ddH2O补齐至10µL.混合后于16℃培养4 h,转化E.coliDH5α(DE3).提取质粒,回收目的片段并测序.将测序正确的质粒pET-28b(+)-PpUGT01和pET-28b(+)分别转化E.coliBL21(DE3)和E.coliRosetta(DE3).
1.2.6PpUGT42的连接及转化
反应体系:5µLPpUGT42,1µL线性化pATX-SUMO载体,4µL同源重组酶.混合后50℃培养45 min,转化E.coliDH5α(DE3).菌液PCR鉴定,对阳性克隆质粒测序.将测序正确的质粒pATX-SUMO-PpUGT42和pATX-SUMO分别转化E.coliBL21(DE3)和E.coliRosetta(DE3).
1.2.7PpUGT01和PpUGT42的原核表达
将转有不同载体的E.coli菌株分别接种于含对应抗性的LB培养基中,37℃,200 r/min过夜培养.吸取250µL培养液至对应抗性的LB培养基中培养5 h.加入终浓度为1 mM的异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactoside,IPTG),于16℃150 r/min培养16 h;37℃,150 r/min培养4 h.冰浴,离心收菌.裂解菌体后通过SDS-PAGE电泳及Western blot检测蛋白.
1.2.8 Western blot反应
电泳:起始电压为120 V,待跑到浓缩胶下面后调为200 V直至电泳完毕.转膜:恒流200 mA,50 min.脱脂奶粉封闭1 h,洗膜.一抗孵育1 h,洗膜.二抗孵育1 h,洗膜.曝光显色.
1.2.9 PpUGT42的体外酶促反应
将转化有pATX-SUMO-PpUGT42质粒的E.coliBL21(DE3)在16℃条件下诱导16 h,收集菌体超声破碎后获得上清液.使用Bradford染色法测定蛋白浓度,随后进行蛋白催化反应(表3).酶促反应的底物分别为薯蓣皂苷元及偏诺皂苷元,糖基供体包括尿苷二磷酸葡萄糖(Uridine diphosphate glucose,UDP-Glc)、尿苷二磷酸葡萄糖醛酸(Uridine diphosphate glucuronic acid,UDP-GIcA)和尿苷二磷酸半乳糖(Uridine diphosphate galactose,UDP-Gal).

表3 蛋白催化反应体系Tab.3 Protein catalyzed reaction system
2 结果与分析
2.1 七叶一枝花候选基因的扩增
从本实验室已有的七叶一枝花转录组数据库中,筛选得到的候选基因PpUGT01和PpUGT42的长度分别为1161 bp和1026 bp.利用SRA数据库拼接获得了PpUGT01和PpUGT42两个候选基因的全长,其长度分别为1485bp(GenBank:OL854108)和1446 bp(GenBank:OL854107).使用特异性引物扩增目的基因的全长序列.电泳可见两条序列均在1500 bp左右(图1),且PpUGT01略大于PpUGT42,与SRA数据库拼接得到的长度基本一致,初步推断扩增得到目的基因.

图1 PpUGT01和PpUGT42基因cDNA扩增产物Fig.1 cDNA amplification products of PpUGT01 and PpUGT42 genes
将PpUGT01和PpUGT42连接T载体并转化E.coliDH5α.挑取单克隆菌落测序,测序结果表明:PpUGT01与PpUGT42的菌落扩增目的片段与电子克隆片段相似度分别为97.86%和97.71%,且测序结果长度一致,说明扩增得到目的基因.
2.2 PpUGT01和PpUGT42的生物信息学分析
根据ProtParam预测PpUGT01和PpUGT42的理化性质(表4).其中,PpUGT01的分子量为53836.69Da、不稳定指数为34.22,预测该蛋白质为稳定性蛋白;PpUGT42的分子量为53241.54 Da、不稳定指数为47.38,预测该蛋白质不稳定.PpUGT01和PpUGT42的脂肪指数分别为90.22和90.15,表明PpUGT01和PpUGT42可能含有较多的脂肪族氨基酸.

表4 PpUGT01和PpUGT42的理化性质Tab.4 Physical and chemical properties of PpUGT01 and PpUGT42
根据NCBI网站上Blast比对结果,选取常见模式植物及部分与甾体生成相关的糖基转移酶基因序列构建系统进化树(图2).由图2可知,PpUGT01和PpUGT42确定为糖基转移酶基因.其中,PpUGT01与小果野蕉(XM009396029.2)、海枣(XM039134135.1)及几内亚薯蓣(XM039282497.1)的亲缘关系较近,且与郭思远等[11]从滇重楼中获得的PpUGT7(MT160184.1)具有一定的亲缘关系(序列一致性为42.03%);PpUGT42与吴长桥等[12]从七叶一枝花中获得的Pp-GT(MW208819.1)序列一致性最高(序列一致性为97.72%),暗示本研究所获UGTs与上述物种基因序列的亲缘关系较近;但PpUGT01、PpUGT42与常见模式植物拟南芥(KJ138869.1)、水稻(XM015773988.2)的基因及甾体类糖基转移酶(steroid glycosyltransferase)基因具有较远的亲缘关系.此外,本研究所得的PpUGT01与PpUGT42两条序列的一致性为45.33%,两者在进化树中的分布也较远,说明这两条序列可能催化不同类型的糖基化反应.

图2 PpUGT01和PpUGT42核酸序列系统进化分析Fig.2 Phylogenetic analysis of PpUGT01 and PpUGT42 nucleotide sequences
2.3 PpUGT01和PpUGT42的原核表达分析
2.3.1 原核表达载体构建
(1)PpUGT01原核表达载体的构建.
以PpUGT01的PCR纯化产物为模版,利用表2中的引物进行PCR扩增.扩增产物连接T载体并转化E.coliDH5α,挑取单克隆菌落进行PCR鉴定,可见1~10号菌株均可扩增出1500 bp左右的条带,初步证明亚克隆载体构建成功(图3).随后,对能扩增出目的条带的菌株进行测序验证,选择测序结果正确的菌株提取质粒并进行酶切,酶切产物与pET-28b(+)的酶切片段连接并转化,对重组质粒再度双酶切,分别获得了约1500 bp的目的条带和约5300 bp的载体条带,表明PpUGT01表达载体构建成功(图4).
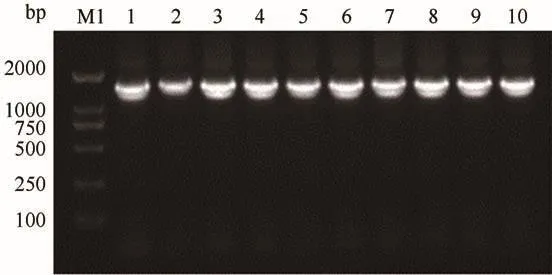
图3 E.coli DH5α/pMD18-T-PpUGT01阳性克隆的PCR筛选Fig.3 PCR screening of E.coli DH5α/pMD18-T-PpUGT01 positive clones
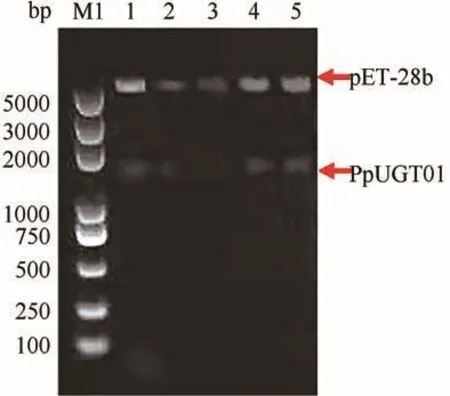
图4 pET-28b-PpUGT01的双酶切检测Fig.4 Double enzyme digestion of pET-28b-PpUGT01
(2)PpUGT42原核表达载体的构建.
以PpUGT42的PCR纯化产物为模板,利用表2中的引物进行PCR扩增.PCR结果显示获得的目的条带在1000 bp至2000 bp之间(图5),将目的条带回收并进行测序后初步推断得到目的片段.

图5 PpUGT42基因片段的扩增Fig.5 Amplification of PpUGT42 gene fragment
回收得到PpUGT42基因与线性化pATX-SUMO载体进行同源重组.重组体系转化E.coliDH5α,挑取单克隆菌落PCR鉴定(图6).由于菌落PCR检测的是目的基因与长度为321 bp的SUMO标签融合后的基因片段,可见1~8号菌株均扩增出2000 bp左右的条带,初步证明亚克隆载体构建成功.随后对能扩增出目的条带的菌株进行测序验证,测序结果与PpUGT42序列完全一致,可见pATX-SUMO-PpUGT42表达载体构建成功.

图6 pATX-SUMO-PpUGT42的菌落PCRFig.6 Colony PCR for pATX-SUMO-PpUGT42
2.3.2 原核表达分析
将表达载体pET-28b-PpUGT01和pATX-SUMOPpUGT42分别依次转入E.coliBL21和E.coliRosetta,在不同条件下进行诱导表达.表达产物的SDS-PAGE结果显示,转入载体pET-28b-PpUGT01的大肠杆菌所得的沉淀(precipitation,DPE)在50 kDa左右有条带.预测的带His-Tag的蛋白大小为56.13 kDa(图7(a)),与电泳结果基本一致.但上清(supernatant,NPE)中不确定是否有目的蛋白;转入载体pATX-SUMOPpUGT42的大肠杆菌所得的DPE在65 kDa有条带,预测的带His-Tag的蛋白大小为65.76 kDa(图7(b)),与电泳结果基本一致,但在NPE中难以确定有无表达蛋白.
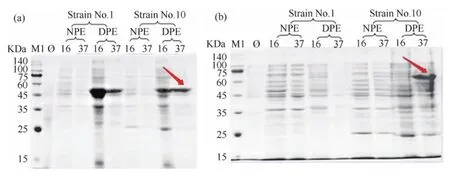
图7 PpUGT01和PpUGT42的大肠杆菌诱导表达与SDS-PAGE检测Fig.7 E.coli induced expression and SDS-PAGE detection of PpUGT01 and PpUGT42
随后进一步利用Western印迹(含His-Tag抗体)检测上述表达产物.结果表明,转入载体pET-28b-PpUGT01的E.coliRosetta在37℃的条件下诱导培养后,NPE中出现了目的条带,说明表达产物有可溶性蛋白,但是可溶性蛋白的量比较少(图8(a));在16℃条件下诱导表达后,NPE中除了有少量目标蛋白存在外,在70 kDa左右还有一个非目标条带.此外,Western印迹检测表明,转入载体pATX-SUMO-PpUGT42的E.coliBL21在16℃条件下诱导效果较好,NPE中能看到较为明显的目的条带(图8(b)),说明该基因的表达产物为可溶性蛋白,可为后续蛋白酶促反应验证等实验提供材料.

图8 PpUGT01和PpUGT42蛋白的Western印迹检测Fig.8 Western blot analysis of PpUGT01 and PpUGT42 proteins
2.4 体外粗酶促反应分析
以可溶性较好的PpUGT42为目标蛋白,收集在16℃条件下诱导的E.coliBL21菌体,获得其上清液进行体外粗酶促反应.分别以薯蓣皂苷元/UDP-Glc、薯蓣皂苷元/UDP-GlcA、薯蓣皂苷元/UDP-Gal为底物和糖基供体时,PpUGT42粗酶液的酶促反应结果与阴性对照的出峰情况一致,没有出现新的峰(图9);以偏诺皂苷元为底物分别添加UDP-Glc、UDP-GlcA或UDP-Gal为糖基供体时,体外酶促催化反应的结果也与阴性对照的出峰情况一致,也没有检测到新峰出现(图10).表明PpUGT42粗酶液在上述反应条件下未能催化薯蓣皂苷元及偏诺皂苷元的糖基化反应.
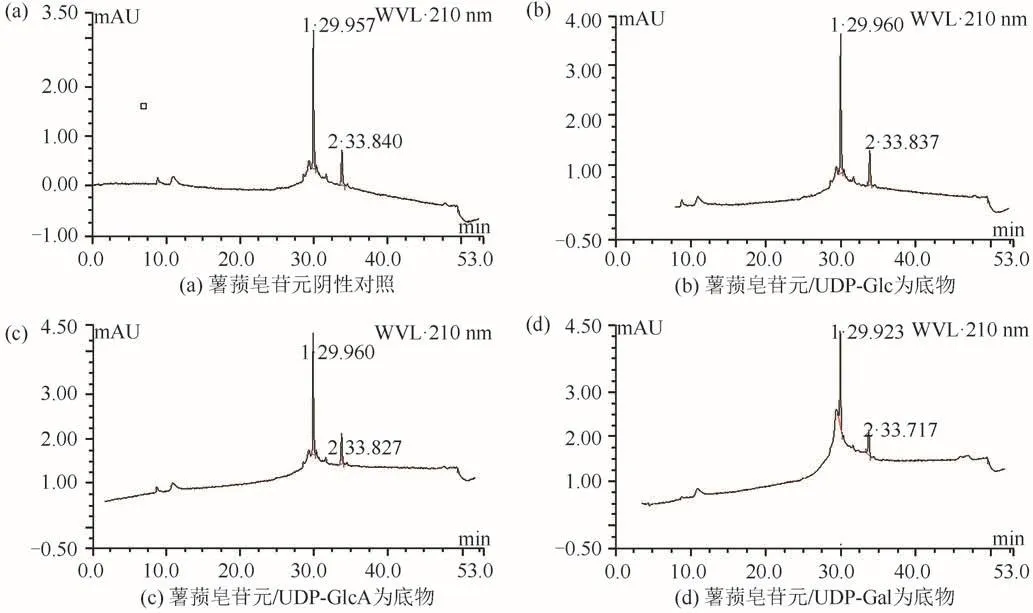
图9 PpUGT42蛋白粗酶促催化薯蓣皂苷元色谱图Fig.9 Chromatogram of diosgenin catalyzed by PpUGT42 protein
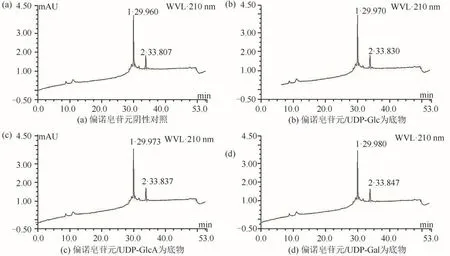
图10 PpUGT42蛋白粗酶促催化偏诺皂苷元色谱图Fig.10 Chromatogram of pennogenin catalyzed by PpUGT42 protein
3 讨论
研究获得的两个UGTs基因长度均在1400 bp左右,这与已有研究中获取的UGTs基因长度基本一致[13];也与郭思远和董栩等人的研究结果相一致[11,14].郭思远从对滇重楼糖基转移酶的研究中获取了2个分别推测为甾体类糖基转移酶和三萜类糖基转移酶的UGTs并进行了原核表达,均获得可溶性目的蛋白[11].董栩从滇重楼中提取并鉴定到1个GT,进行原核表达后也获得了可溶性表达蛋白[14];上述研究中获得的UGTs序列长度与本研究中的蛋白长度略有差异,这可能是由于选取的表达蛋白标签及载体不同所致.
生物信息学分析表明,本研究所选择进行原核表达的PpUGT01和PpUGT42均属于UGTs家族中的D亚组蛋白[15],该组的UGTs成员已被证实可参与各类皂苷合成[16].原核表达分析结果显示:PpUGT01蛋白在实际的表达中可溶性产物很少且有非目标条带出现,而PpUGT42的可溶蛋白量也不多,大多为包涵体形式,这可能与所表达蛋白的序列特性有关,也与表达载体及表达条件有关.此外,PpUGT01和PpUGT42蛋白的Western印迹结果显示E.coliRosetta菌株表达的可溶性蛋白量更多,推测E.coliRosetta更适用于该类蛋白的表达,因此将在后续的研究中改进现有的表达载体及条件,以获取更多可溶性蛋白.
根据原核表达的结果,选取PpUGT42蛋白进行体外酶促反应,但结果显示PpUGT42粗酶液未能催化薯蓣皂苷元及偏诺皂苷元的糖基化反应.这可能是由于PpUGT42的粗酶液未经纯化,其中杂蛋白含量较高,目的蛋白含量较少所致;也可能是由于现有的酶促反应条件并非最佳,PpUGT42的活性不够高;此外也可能是本实验所选择的反应底物和糖基供体不合适,从而未能检测到其催化的产物.

