内镜热损伤术后息肉样结节瘢痕的病理性质及处理策略探讨*
杨津,秦斌,朱洪怡,伍洁,秦赟,姜炅,程妍,张莉,全晓静,龚均,邹百仓
(西安交通大学第二附属医院消化内科,陕西西安710004)
内镜下烧灼及热切除是治疗胃黏膜增生性病变(息肉和浅表胃肿瘤)的首选方法。一般直径小于0.5 cm 的息肉样病变可采用氩等离子体凝固术治疗(argon plasma coagulation,APC),小于2.0 cm 或有蒂的病变可采用内镜下黏膜切除术(endoscopic mucosal resection,EMR)切除,大于2.0 cm 的无蒂病变一般采用内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)[1-2]治疗。若病变位于胃窦,部分患者在内镜切除术后,可能会出现异常的术后瘢痕,并伴有相对巨大和突出的息肉样结节,且组织活检显示:再生黏膜没有复发的肿瘤细胞,考虑为息肉样结节瘢痕(polypoid nodule scar,PNS)[3]。这不仅为肿瘤复发的评估增加了困难,同时也为术后处理提出了挑战。本研究通过总结PNS的临床特征,以探讨其发病机制和临床治疗策略。
1 资料与方法
1.1 一般资料
选择2015年3月-2019年3月于本科行胃镜下APC、EMR 和ESD 治疗的胃黏膜增生性病变的患者,回顾性分析发生PNS的7例患者的临床资料。观察并记录患者一般情况、胃肿瘤病变位置、术前诊断、手术方式、标本大小、ESD标本的组织病理学评估、术后处理和随访结果。纳入标准:①为内镜切除术后或补救性ESD术后,组织学证实已根治性切除;②术后内镜检查,发现与治疗部位相对应的PNS;③PNS组织学检查显示增生或再生组织。
1.2 文献复习
分别以“PNS和EMR”“PNS和ESD”“PNS”“瘢痕部息肉”作为检索词,在中国知网、万方数据知识服务平台及中国生物医学数据库进行检索,未检索出相关文献。分别用“PNS”和“polypoid nodule scar”为检索词,在Science Direct Online (SDOL) 以及PubMed中检索到2篇相关文献,1篇文献为ESD术后发生PNS 的个案报道[3],另一篇为多中心报道[4],前一篇文献研究包含在后一篇多中心研究中。
2 结果
2.1 临床资料
本科室579例胃黏膜病变患者中,7例出现PNS,发生率为1.21%。其中,男5 例,女2 例,年龄43~72 岁,病变部位均位于胃窦。1 例增生性息肉行2 次APC治疗后,复查再次发现PNS,追加ESD治疗后复查,再次发现较大PNS。1例增生性息肉病变行EMR术后,原位发现息肉样病变,后行2次ESD术再次切除,瘢痕处仍有息肉样结节增生病变(图1)。1例增生性病变,术前病理提示息肉,行ESD术切除后5个月即发现原位结节样增生,术后48 个月复查,病变增大,但病理提示炎症。1 例腺瘤样增生病变,行EMR 切除后18 个月,复查内镜见前壁瘢痕处有2.0 cm×2.0 cm 黏膜隆起,遂行ESD 再次切除,术后4个月复查,再次出现增生性瘢痕,大小同术前,病理提示慢性黏膜炎症及增生。1例腺瘤性病变行ESD,术后12 个月复查,瘢痕处发现增生性病变,再次行ESD,术后病理提示腺瘤性息肉且切缘阴性,术后3个月复查,瘢痕处发现增生病变,病理提示炎性息肉,未追加治疗。1例胃窦增生病变,病理提示中度不典型增生,行ESD 后复查发现原位结节样增生病变,病理提示炎性增生,未做处理。1例早期胃窦黏膜凹陷性病变行ESD,术后病理提示原位癌且切缘阴性,术后3 个月发现PNS,术后6 个月复查时消失(图2)。
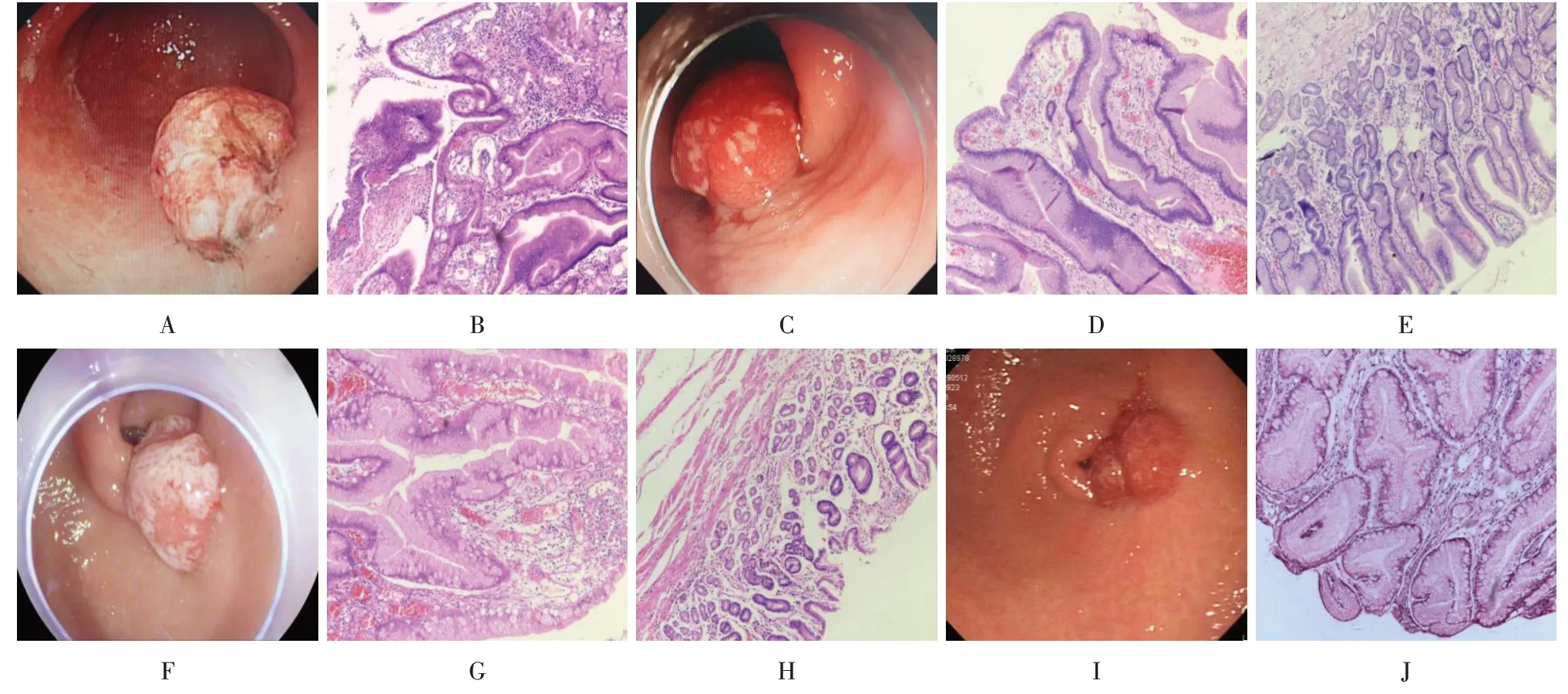
图1 增生性息肉EMR后PNS处理Fig.1 PNS treatment of hyperplastic polyp after EMR
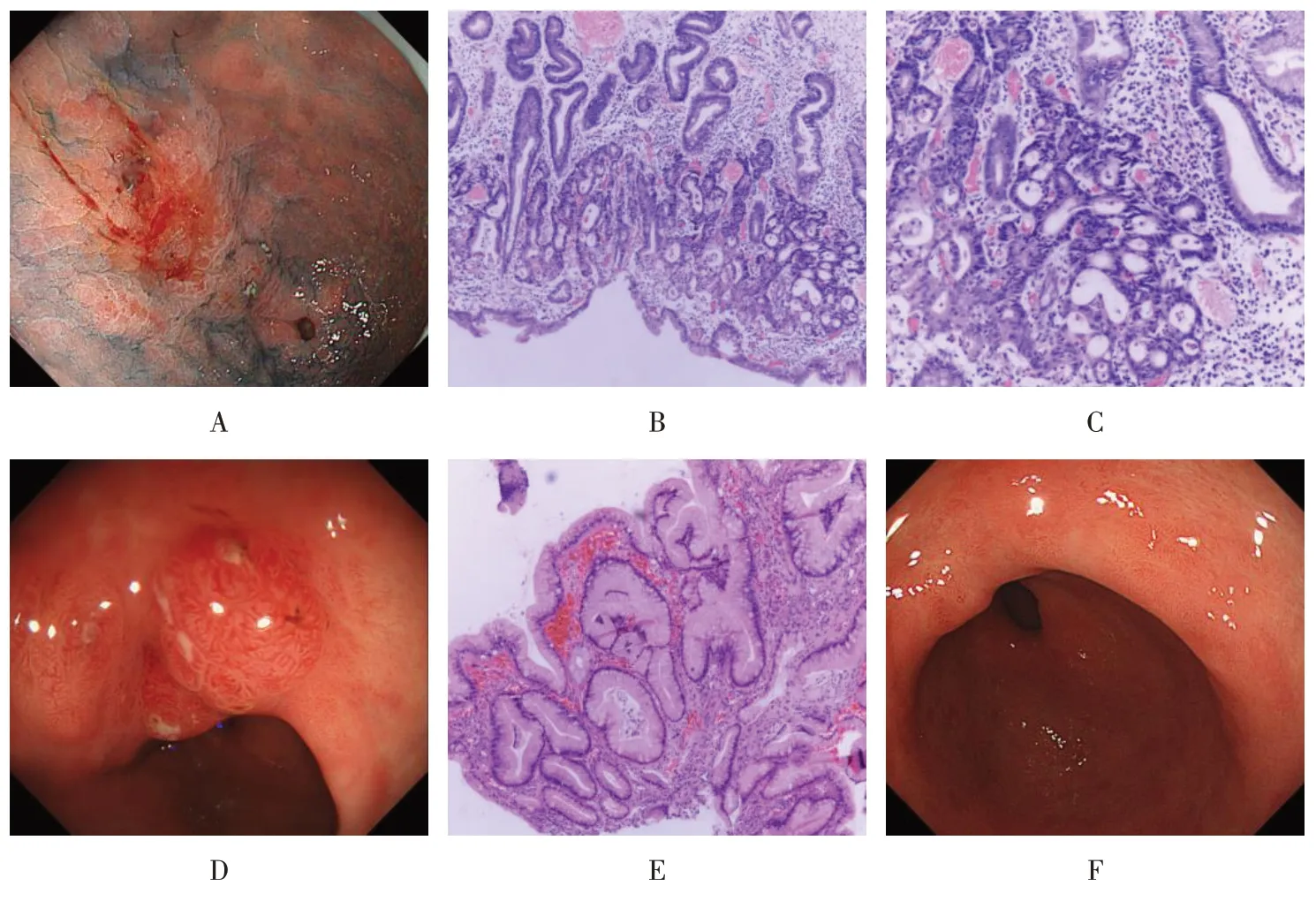
图2 胃窦早期癌病变ESD术后PNS处理Fig.2 PNS treatment of early gastric antrum cancer after ESD
2.2 文献复习结果
多中心研究[4]报道,2 275 例患者接受了胃ESD。其中,28 例(男18 例,女10 例)发生PNS,总体发病率为1.23%,各中心PNS发生率为0.15%~11.40%。所有发生PNS 的患者原发性肿瘤病变均位于胃远端(胃窦)。如只考虑位于胃窦的912例病例,PNS的发生率为3.07%。平均随访43 个月(6~192 个月),无恶性肿瘤复发。其中,5 例(17.86%)PNS 在平均随访18个月后消失。
3 讨论
本组7 例PNS 为中老年患者(43~72 岁),PNS发生率占同期行APC、EMR和ESD治疗患者的1.21%(7/579),病变部位均位于胃窦,随访时间为6~48月。1例APC及2例EMR切除术后,原治疗瘢痕处复查时发现息肉样增生,较治疗前增大,在患者强烈要求下行ESD补救性切除,术后病理证实已完整切除,切缘阴性,但ESD 术后复查时,在原部位再次发现息肉样病变。因术后常规使用质子泵抑制剂(proton pump inhibitor,PPI)会有促进增生性息肉的风险,1 例术后未用PPI,但术后4 个月原部位仍长出息肉样病变,活检提示增生性息肉,结合患者3次胃镜下治疗情况,不能用病变复发解释,考虑PNS 可能。1 例病变为胃窦大弯侧隆起病变,术前病理提示腺瘤,行ESD 术切除,术中切缘靠近瘤体边缘,术后病理评估一侧切缘可疑阳性,患者因故延迟1年后复查,发现ESD 手术瘢痕处再次出现亚蒂隆起性病变,术后病理提示增生性息肉,结合术后病理不排除原位复发,患者强烈要求再次切除,遂行第2 次ESD 切除,术后未用PPI,3 个月后复查再次发现原位增生病变,术后病理提示增生性息肉,考虑PNS 的可能。另有2 例行ESD 术后复查,分别可见白色瘢痕和胃窦前壁隆起病变,随访观察,未追加ESD,未进行特殊处理,其中1 例PNS 在术后6个月随访时消失。
唯一的一项多中心研究[4]报道,在来自日本和巴西的5 个中心接受ESD 治疗的2 275 例患者中,28 例患者(男18 例,女10 例)发生PNS,PNS 总发生率为1.23%,各中心PNS 发生率为0.15%~11.40%,PNS发生率有差异,是否与ESD操作、术后护理、病例总数和种族差异有关,尚不明确。
PNS发生原因不明确,ARANTES等[5]认为,其可能与使用PPI有关,强力抑酸治疗可导致高胃泌素血症,使胃黏膜腺窝上皮增生,肉芽组织形成。PPI可以增加环氧化酶的表达和前列腺素E的合成,前列腺素E 可刺激生长因子的表达,如:血管内皮生长因子、肝细胞生长因子和碱性成纤维细胞生长因子等,从而加速黏膜修复,有助于黏膜再生结节的生长[6]。MARTIN 等[7]在一篇Meta 分析中指出,PPI 的使用与胃底息肉患病率增加有关,并且随着使用PPI时间的延长,患病率明显增加。日本也有过长期使用PPI后出现出血性息肉的病例报道[8]。早期日本有文献[9]报道,使用PPI治疗消化性溃疡后,会出现肉芽组织过度增生,表现为隆起型溃疡,推测与使用PPI 有关。但是,在使用PPI比日本更多的欧美国家,未见有隆起型溃疡的报道。本文作者曾对此做过综述[10],认为:PPI治疗后的肉芽组织过度增生,与强烈抑酸治疗有关,这一观点证据尚不充分。本组3例患者ESD术后曾常规应用PPI,1 例患者在最后一次ESD 后,有意不用PPI,但术后4 个月仍出现增生性息肉样结节,考虑PNS 与使用PPI 无关,可能是瘢痕体质缘故。本组报道的7 例PNS 中,仅3 例有幽门螺杆菌感染,样本较少,无法说明问题。ARANTES等[4]报道的28 例病例中,一半患者幽门螺杆菌阳性,感染率为50.0%,这表明:幽门螺杆菌感染与PNS 可能无明显相关性,幽门螺杆菌根除治疗对PNS的影响,有待于进一步的研究。
本组病例及多中心报道[4]的患者,PNS 均发生在胃下部(胃窦),可能与胆汁反流和局部蠕动有关。此外,胃窦黏膜下层较厚,炎症反应和再生反应会较其他部位明显。目前,尚缺乏食管、大肠部位ESD后发生PNS的报道。
PNS的预后及处理措施尚不明确。ARANTES等[4]报道的28 例PNS 中,5 例患者平均在随访18 个月后PNS 消失,余病例平均随访43 个月,未发现PNS 恶变。本组病例中,1例PNS在随访6个月后消失,2例定期随访,4例多次行内镜下治疗,但PNS均长期存在,可能与患者体质有关。
综上所述,PNS 为良性病变,且追加治疗无效,建议不作特别处理,应定期复查。PNS的发病机制及预后,仍需进一步观察研究。

