外周血循环肿瘤细胞形态学分析技术在临床检验中的应用
俞 琦, 孙 懿, 王琼丽, 蔡逸婷, 李 莉
(1.上海市第一人民医院检验科,上海 200080;2.保山市人民医院检验科,云南 保山 678000)
随着现代检测技术的发展和应用,无创循环肿瘤细胞(circulating tumor cell,CTC)检测方法的敏感性和特异性不断提高,其在临床检验中的应用价值得到越来越多的重视。2000年,VONA等[1]首次利用CTC和正常血液细胞大小、形态等物理学差异和肿瘤细胞特有的形态特征,建立了上皮肿瘤细胞大小分离法(isolation by the size of epithelial tumor cell,ISET ),在外周血中通过显微镜检出CTC。此项技术能完整地检出各种表型的CTC,且快速、便捷、成本低,有利于后续实验和研究的开展[2]。目前的主流富集技术中,免疫学技术缺乏广谱且高特异性的肿瘤标志物,会造成异质性CTC无法检出,ISET技术的缺点在于一些较大的单核细胞等容易与CTC混在一起,而一些较小的CTC容易被滤过而无法检测到[2]。因此,目前还没有一种方法可以完美地捕捉到循环中所有的CTC[3]。在CTC鉴定技术方面,免疫学仍然存在标志物特异性问题,逆转录-聚合酶链反应(polymerase chain reaction,PCR)技术灵敏度高,但不能观察到完整细胞;而形态学方法具有快速、直观、成本低等优势。本研究采用获得中国国家食品药品监督管理局认证的CTCBIOPSY异常细胞分离染色系统,统计6类我国常见肿瘤患者外周血CTC的检出情况,分析这种基于ISET技术和形态学判读标准的CTC检测技术在肿瘤临床检验及科学研究中的应用价值。
1 材料和方法
1.1 研究对象
选取2018年4月—2020年1月上海市第一人民医院初次手术后经病理检测确诊的肿瘤患者,排除既往接受过肿瘤医疗干预,或合并严重心、肺、肝、肾功能疾病患者,纳入212例肿瘤患者,其中肺癌患者72例、肠癌患者46例、胃癌患者38例、甲状腺癌患者24例、乳腺癌患者18例、前列腺癌患者14例。TNM分期:原位癌3例、Ⅰ期45例、Ⅱ期55例、Ⅲ期55例、Ⅳ期54例。所有研究对象年龄、性别差异均无统计学意义(表1)。本研究通过上海市第一人民医院伦理委员会审核(伦理批件编号:2018KY177),所有研究对象均签署知情同意书。
1.2 方法
1.2.1 标本采集 在患者手术或进行化疗治疗前,采用乙二胺四乙酸抗凝(ethylenediaminetetraacetic acid,EDTA)真空采血管采集其肘静脉血5 mL。为避免采血过程中发生上皮细胞污染,采用第2管之后抽取的血液标本用于CTC检测。采血后,上下颠倒采血管,使血液与抗凝剂成分充分混合,血液标本在采集后2 h内处理。
1.2.2 标本前处理 用1 mL 75%医用乙醇润洗滤器(武汉友芝友公司),再用2 mL 0.9%Nacl溶液漂洗3次。向15 mL离心管中加入3 mL 0.9%Nacl溶液和200 μL固定剂(8% PFA)混匀,再加入5 mL血液标本颠倒混匀,室温固定10 min,然后将待测标本加入滤器中,采用CTCBIOPSY异常细胞分离染色仪(武汉友芝友公司)检测。
1.2.3 制片 分离完成后,取出滤器,向滤器内加入300 μL甲醇,室温固定1 min后取出滤膜,将滤膜贴于玻片中央,室温晾干后进行瑞-吉染色,50 ℃干燥箱放置30 min,滴加100%甘油封片后,进行镜检。
1.2.4 油镜观察 富集细胞形态评判参数[4-5]:(1)细胞核异型性,呈不规则的结节状、分叶状等;(2)核质比>0.8;(3)细胞直径(长端)>15 μm;(4)核深染且着色不均匀;(5)核膜增厚,出现凹陷或皱褶,核膜呈锯齿状;(6)细胞核染色质边移,或巨大核仁,或异常核分裂。评判标准[5]:(1)4个或4个以上参数符合判读为CTC;(2)满足评判参数(6)外的任意3个条件或单独满足评判参数(6)判读为疑似CTC;(3)3个及以上的细胞成团,且能鉴定为CTC,但因相互连接重叠无法准确判读为CTC的细胞团,判读为循环肿瘤微栓(circulating tumor microemboli,CTM);(4)3个及以上的细胞成团,但不足以判定为CTC的细胞团,判读为疑似CTM;(5)不能判断为血液来源的细胞,但同时也不符合上述4种类型的其他细胞,判读为非血液细胞。计数判读为CTC、疑似CTC、CTM和疑似CTM的细胞数量,并记录坐标。
1.2.5 免疫组化检测 镜检后,将玻片放入去离子水中上下润洗去除甘油,依次放入100%乙醇(1 min)、95%乙醇(1 min)、75%乙醇(>20 min),在去离子水中润洗脱色。然后分别滴加100 μL 0.1% Triton X-100,室温孵育15 min,洗净后滴加100 μL 0.3% H2O2,室温(18~26 ℃)孵育10 min,洗净后分别加入100 μL CD45一抗(美国Abcam公司)和100 μL CD31一抗(美国Abcam公司),室温(18~26 ℃)孵育2 h(或4 ℃过夜)。洗净后加入100 μL山羊抗兔/小鼠IgG/HRP(上海威奥生物公司),室温(18~26 ℃)孵育20 min。洗净后滴加100 μL DAB显色液显色3~10 min,苏木素染色5 min,盐酸乙醇分化8 s,自来水返蓝5 min。采用75%乙醇(1 min)、95%乙醇(1 min)、100%乙醇(1 min)梯度脱水,晾干,用中性树脂封固,于CX23光学显微镜(日本奥林巴斯公司)下镜检。
1.3 统计学方法
采用R软件(3.5.0版)进行统计学分析,采用Kolmogorov-Smirnov检验判断数据是否呈正态分布(检验水准设定为0.10)。正态分布连续变量采用±s表示,组间比较采用独立样本t检验。偏态分布的连续变量采用中位数(M)[四分位数(P25,P75)]表示,组间比较采用Mann-Whitney U检验。分类变量的比较采用χ2检验。等级变量先进行秩转换后,再用Mann-Whiney U检验进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1 外周血CTC形态学检出情况
细胞形态学检查结果显示,212例肿瘤患者外周血标本中有88例(41.51%)检出CTC,其中16例检出CTM。进一步通过CD45和CD31抗体同时进行免疫组化验证,发现所有检出CTC和CTM者CD45、CD31均为阴性,符合CTC和CTM免疫学特征。见图1。
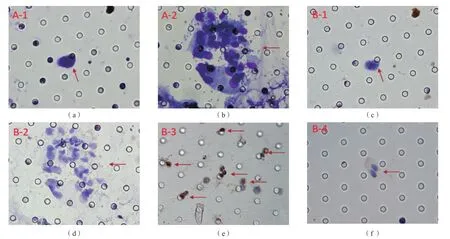
图1 外周血CTC及CTM形态学检查结果
2.2 CTC阳性组与阴性组各项参数比较
CTC阳性组与阴性组患者性别以及是否患糖尿病、高血压和肿瘤类型差异无统计学意义(P>0.05);年龄(P<0.05)、肿瘤原发灶(tumor,T)、区域淋巴结受累(node,N)、远处转移(metastasis,M)及TNM分期(P<0.001)差异有统计学意义。见表1。

表1 CTC阳性组与阴性组各项参数比较
2.3 不同类型或不同分期肿瘤患者CTC检出率比较
72例肺癌患者中,有34例(47.22%)检出CTC,早期(Ⅰ、Ⅱ期)患者和中晚期(Ⅲ、Ⅳ期)患者检出率分别为9.68%和75.61%;46例肠癌患者中,有21例(45.65%)检出CTC,早期和中晚期患者CTC检出率分别为33.33%和53.57%;38例胃癌患者中,14例(36.84%)检出CTC,早期和中晚期患者CTC检出率分别为27.78%和45.00%;24例甲状腺癌患者中,5例(20.83%)检出CTC,早期和中晚期患者CTC检出率分别为11.11%和50.00%;18例乳腺癌患者中,7例(38.89%)检出CTC,早期和中晚期患者CTC检出率分别为35.71%和50.00%;14例前列腺癌患者中,7例(50.00%)检出CTC,早期和中晚期患者CTC检出率分别为16.67%和75.00%。见图2。
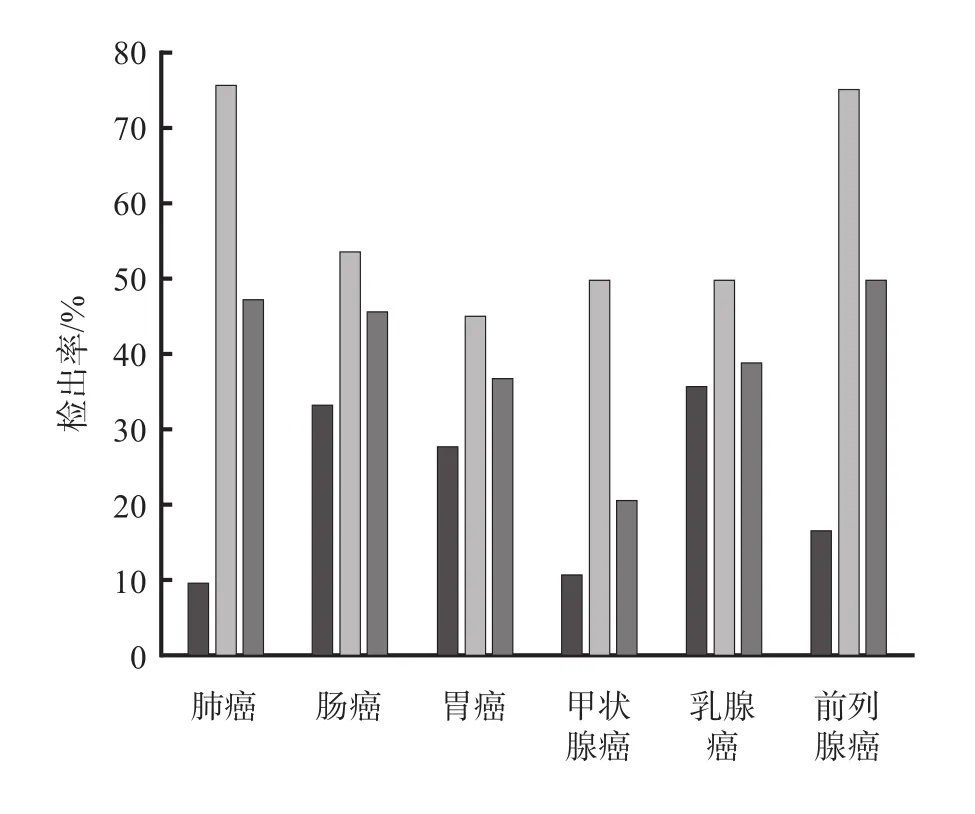
图2 不同类型肿瘤患者不同分期CTC检出率
2.4 不同类型肿瘤患者不同分期CTC计数比较
不同类型肿瘤早期与中晚期患者CTC计数有一定差异。30例肺癌早期(Ⅰ+Ⅱ期)患者CTC计数为(0.80±0.58)个/5 mL,显著低于42例肺癌晚期(Ⅲ+Ⅳ期)患者[(8.64±1.88)个/5 mL](P<0.01);6例前列腺癌早期(Ⅰ+Ⅱ期)患者CTC计数为(2±2)个/5 mL,显著低于8例前列腺癌晚期(Ⅲ+Ⅳ期)患者[(24.63±11.71)个/5 mL](P<0.05)。见图3。
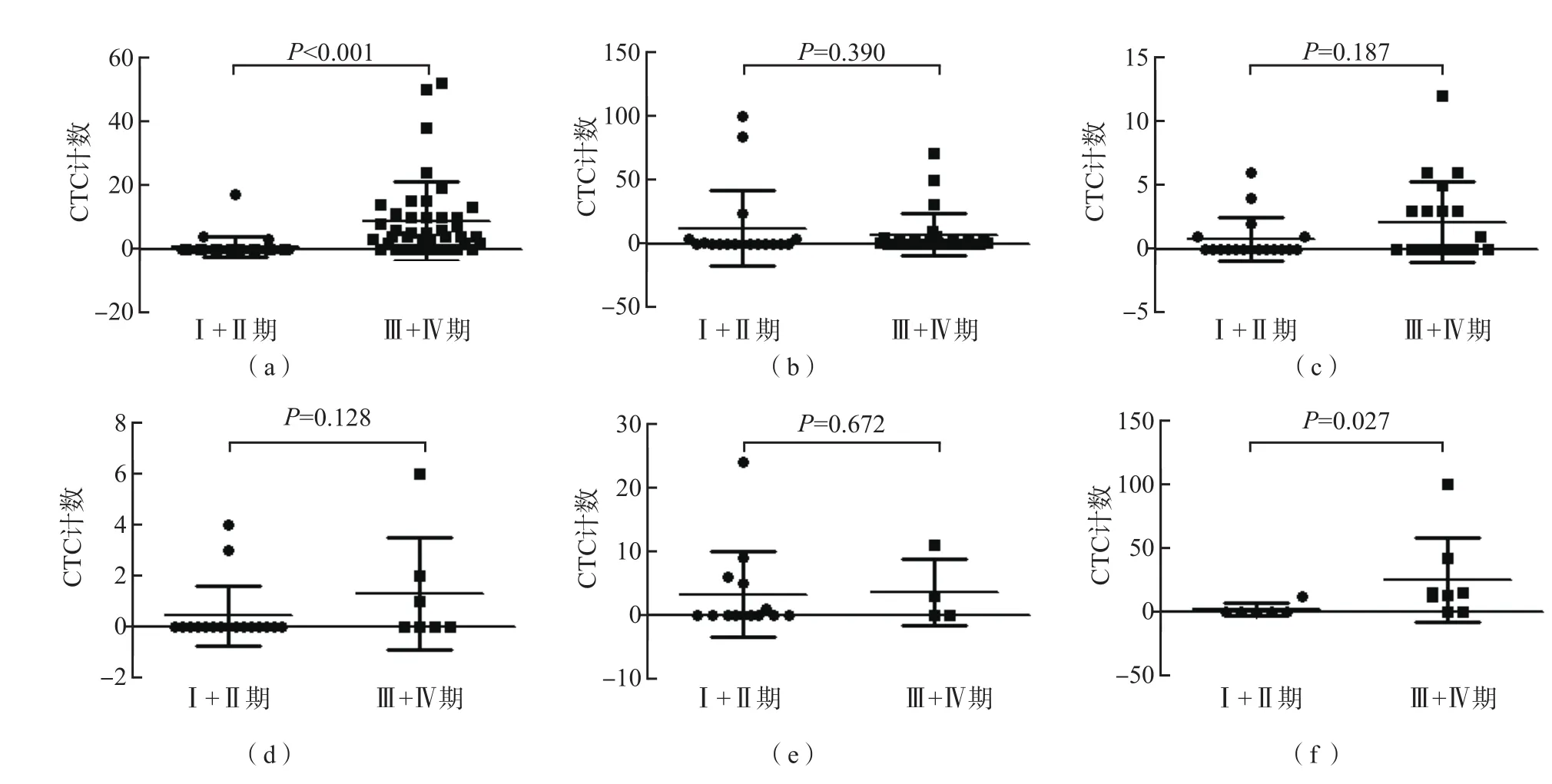
图3 不同类型肿瘤患者不同分期CTC计数比较
3 讨论
本研究采用基于ISET的形态学方法在212例肿瘤患者中检出88例CTC阳性。为了进一步评估该形态学CTC检测方法的特异性,本研究通过CD45抗体免疫组化检测排除形态学特征类似CTC的白细胞,通过CD31抗体免疫组化检测排除形态特征类似CTC或CTM的血管内皮细胞,进而验证形态学技术CTC检测结果的假阳性率。细胞核染色为蓝色(苏木素) 且细胞膜染色为棕黄色(DAB) 即CD45或CD31阳性,为血液细胞或血管内皮细胞;而细胞核染色为蓝色(苏木素)且细胞膜周围无棕黄色即CD45阴性且CD31阴性,为CTC或CTM(图1)。通过免疫组化验证发现,通过本形态学标准检出的所有CTC和CTM细胞均符合CD45-CD31-的免疫学特征,说明该CTC形态学检测方法和判读标准的检测特异性较高。
本研究检测并统计了6种我国常见癌症的CTC,总体检出率为41.51%,其中前列腺癌CTC检出率(50%,7/14)最高,肺癌(47.22%,34/72)次之,以下依次为肠癌(45.65%,21/46)、乳腺癌(38.89%,7/18)、胃癌(36.8%,14/38)、甲状腺癌(20.83%,5/24)。同一类型癌症,采用不同检测方法,CTC的敏感性和特异性不尽相同[6]。如,在可切除非小细胞肺癌(non-small cell lung cancer,NSCLC)中,应用CellSearch可在19%~39%的患者中检出CTC,采用ISET能在36%~50%的患者中检出CTC[7]。迄今为止,尚没有发现肿瘤细胞的特异靶标,最具代表性的CellSearch技术,其标志物EpCAM是上皮细胞的标志,当肿瘤细胞发生上皮-间质转化时,则无法检出[8]。与基于表面标志物的免疫亲和吸附技术比较,本研究采用的方法可以减少肿瘤细胞上皮-间质转化过程中表面标志物表达变化的影响,提高CTC和CTM的检测效率。本研究采用的方法对CTC无选择性,并能较完整地保留细胞成分,可用于后续细胞实验和基因多样性等研究,经济、快捷,适合大批量标本的检测,有较好的临床和科研应用前景。然而,尽管CTC形态上比正常组织细胞的体积稍大,且不易变形,但极少量的微小CTC(直径<8 μm)可能无法被富集,这是本技术的不足之处。
本研究患者相关临床参数比较结果显示,CTC阳性组T4期患者、发生淋巴结转移和远处血行转移患者所占比例较阴性组显著增多(表1)。转移性癌症患者外周血中CTC的频率约为每105~107个外周血单个核细胞中有1个CTC,高于局限性癌症患者108个外周血单个核细胞中有1个CTC的频率[9]。本研究免疫组化验证结果显示,CTC形态学分析技术在发生淋巴结和血行转移性的中晚期癌症患者外周血中检出CTC的频率更高。回顾以往研究,我们发现采用不同技术检测CTC时,不同肿瘤患者临床病理特征的关系不尽相同。一项纳入84例胃癌患者的ISET技术研究发现,CTC和CTM检出情况与瘤块大小、有无淋巴结转移、有无血管侵犯和远处转移灶有关[10];而另一项采用阴性富集联合免疫荧光原位杂交技术的针对32例胃癌患者和36例结直肠癌患者的研究则发现,CTC检出结果与胃癌和结直肠癌患者的性别、年龄、淋巴结转移、远处器官转移、病理分级均无相关性[11]。检测方法学、样本数量和研究群体的差异可能造成了上述差异。此外,本研究发现,CTC阳性组平均年龄较阴性组大,以往未见类似报道,考虑到可能存在抽样误差,还需扩大检测样本量和检测人群,以进一步验证。
以往的研究发现,9.4%~48.6%的早期乳腺癌患者体内可以检出CTC,且提示早期复发和总生存期降低[12]。本研究发现,在肿瘤早期,乳腺癌的CTC检出率最高(35.71%),肠癌、胃癌、前列腺癌依次降低,早期肺癌和甲状腺癌CTC检出率较低,肺癌和前列腺癌早期患者CTC计数与中晚期患者比较差异显著,提示本研究采用的形态学检测方法可以捕捉早期肿瘤患者外周血中的CTC,特别是在早期乳腺癌、肠癌和胃癌患者外周血中更易检出,这可能与不同类型肿瘤不同时期外周血中CTC的丰度有关。
纵观不同CTC检测方法在不同类型肿瘤以及相同类型肿瘤的不同分期的广泛的临床研究,CTC检测方法的敏感度、特异性、精确性和可重复性仍难以客观判断,目前还很难将单纯的CTC定性检测和计数运用到临床决策[3]。值得欣喜的是,CTC的单细胞测序技术能够克服CTC的异质性,发现肿瘤发生发展过程中新的驱动基因,揭示肿瘤转移、耐药及复发等机制[13]。对单个CTC或CTM癌基因和抑癌基因的鉴定、肿瘤生存分子的分析是未来研究的趋势[14]。本研究采用的CTC形态学分析技术在单个CTC及CTM细胞的捕获和鉴定方面具有经济、特异性高、操作快速、高通量且细胞完整等优势,在6类常见肿瘤的早、晚期均可检出CTC,有一定的临床应用价值,未来可以结合细胞显微切割、单细胞测序等技术,针对单病种,结合疗效和预后评估等,开展更深入的研究。

