健康成人白细胞表面CD64和HLA-DR相关指标参考区间的建立及其影响因素分析
苗林子, 陆 遥, 屈晨雪, 由 然, 龚 岩
(北京大学第一医院,北京 100034)
CD64是免疫球蛋白IgG Fc段的Ⅰ型受体,属于免疫球蛋白超家族的成员,主要分布于外周血单核巨噬细胞、树突细胞等抗原提呈细胞表面[1]。近年来,CD64作为一种新的感染相关指标,受到越来越多的关注[2-5]。有文献报道,相较于系统性炎症反应综合征,脓毒血症患者中性粒细胞CD64明显升高[6];脓毒血症早期表达CD64的中性粒细胞绝对数值低于2 500个/μL的患者,预后较好[7];CD64在鉴别感染与其他原因引起的发热中有重要的作用[8]。HLA-DR分子表达在巨噬细胞、树突细胞、B淋巴细胞等抗原提呈细胞和单核细胞表面,参与抗原提呈和T淋巴细胞的活化,对特异性免疫十分重要[9]。有研究发现,单核细胞表面HLA-DR表达降低的创伤患者并发感染和脓毒血症的比例更高[10]。LEKKOU等[11]发现,死亡组严重社区获得性感染和脓毒血症死亡患者单核细胞HLA-DR在入院3、10、13和17 d时,均显著低于存活患者,因此HLA-DR可作为预后判断的早期和持续性监测指标。目前,我国尚未将白细胞表面CD64和HLA-DR广泛应用于临床,原因之一是未建立健康成人的参考区间。由于使用流式细胞术检测白细胞表面CD64和HLA-DR的成本较高等因素,目前只有极少数的临床实验室用极少量样本建立了自己的参考区间,用于科研和极少数临床需要,但因其健康人群筛选不严格,样本例数较少而不具代表性。本研究旨在通过流式细胞术检测健康成人白细胞表面CD64和HLADR的表达,并通过公式计算相应的指标,初步分析其在不同年龄、不同性别健康成人之间的差异,建立健康成人白细胞表面CD64和HLADR相关指标的参考区间,为这些指标的临床应用奠定基础。
1 材料和方法
1.1 研究对象
选取2019年3—11月北京大学第一医院行健康体检的22~60岁成人200名。通过调查问卷和体格检查确定研究对象身体健康、无现病史;排除乙型肝炎、丙型肝炎、获得性免疫缺陷综合征和梅毒感染者,排除急、慢性感染性疾病和自身免疫性疾病、过敏性疾病或癌症患者,以及3个月内服用过影响免疫系统的药物、4周内接种过疫苗、1年内接受过输血或6个月内献血者。此外,参考血常规、血生化(肝、肾功能)、尿常规等实验室指标是否完全正常,以决定研究对象是否入选。最终纳入126名符合标准的健康体检者,其中男69名、女57名。本研究通过北京大学第一医院伦理委员会审核[伦理编号为(2018)科研第(145)号]。
1.2 仪器和试剂
美国BD公司CD64(克隆号10.1)、HLA-DR(克隆号L243)、CD45(克隆号2D1)、CD14(克隆号MφP9)单克隆抗体。美国BD公司FACS CantoⅡ流式细胞仪和FACS Diva分析软件。
1.3 方法
1.3.1 样本采集 采用美国BD公司Vacutainer乙二胺四乙酸采血管,以无菌静脉穿刺方式采集研究对象至少1 mL的全血,用于完成体检临床实验室检测后,使用剩余全血样本(血常规样本)进行染色和上机检测。
1.3.2 细胞染色 抗凝全血样本采集后8 h内完成细胞染色。分别将20、20、20、5 μL的CD64、HLA-DR、CD14、CD45单克隆抗体加入上样管,再加入100 μL抗凝全血,轻轻混匀振荡,室温(20~25 ℃)环境下避光孵育15 min,然后加入2 mL FACS溶血素,充分混匀,于室温(20~25 ℃)环境下避光孵育10 min,300×g离心5 min后弃去上清,加入2 mL磷酸盐缓冲液混匀,300×g离心5 min后弃去上清,再加入500 μL磷酸盐缓冲液混匀,上机检测。如果无法立即上机检测,则将染色后的样本室温(20~25 ℃)放置,避光储存。
1.3.3 流式细胞仪检测和结果分析 首先进行流式细胞仪的日常设置和自动质控,确保仪器和质控在控。细胞染色后1 h内进行流式分析检测。检测前,充分混匀振荡细胞(低速)以减少细胞聚集;调整阈值,使细胞碎片降至最低,确保检测包含目标细胞群。按照单核细胞数2 000个设定收集终点,收集结束后,用FACS Diva软件来进行分析,以CD14阳性设门圈出单核细胞,以CD45设门圈出淋巴细胞和中性粒细胞,显示各细胞群CD64、HLA-DR平均荧光强度和荧光强度中位数。分别列出中性粒细胞、单核细胞、淋巴细胞的CD64和HLA-DR平均荧光强度、荧光强度中位数,计算中性粒细胞CD64指数、中性粒细胞与单核细胞CD64比值、中性粒细胞与淋巴细胞CD64比值、CD64比率,以及HLA-DR相关指标(单核细胞HLADR平均荧光强度、单核细胞HLA-DR荧光强度中位数、单核细胞与淋巴细胞HLA-DR比值,单核细胞与中性粒细胞HLA-DR比值)。计算公式为:CD64指数平均荧光强度=(中性粒细胞CD64平均荧光强度/淋巴细胞CD64平均荧光强度)/(单核细胞CD64平均荧光强度/中性粒细胞CD64 平均荧光强度);中性粒细胞与单核细胞CD64比值%平均荧光强度=中性粒细胞CD64平均荧光强度/单核细胞CD64平均荧光强度×100%;中性粒细胞与淋巴细胞CD64比值平均荧光强度=中性粒细胞CD64平均荧光强度/淋巴细胞CD64平均荧光强度;CD64百分比平均荧光强度=(中性粒细胞CD64平均荧光强度-淋巴细胞CD64平均荧光强度)/(单核细胞CD64平均荧光强度-中性粒细胞CD64平均荧光强度)×100%;CD64指数荧光强度中位数=(中性粒细胞CD64荧光强度中位数/淋巴细胞CD64荧光强度中位数)/(单核细胞CD64荧光强度中位数/中性粒细胞CD64荧光强度中位数);中性粒细胞与单核细胞CD64比值%荧光强度中位数=中性粒细胞CD64荧光强度中位数/单核细胞CD64荧光强度中位数×100%;中性粒细胞与淋巴细胞CD64比值荧光强度中位数=中性粒细胞CD64荧光强度中位数/淋巴细胞CD64荧光强度中位数;CD64百分比 荧光强度中位数=(中性粒细胞CD64荧光强度中位数-淋巴细胞CD64 荧光强度中位数)/(单核细胞CD64荧光强度中位数-中性粒细胞CD64荧光强度中位数)×100%;中性粒细胞与单核细胞CD64比值荧光强度=中性粒细胞CD64平均荧光强度/单核细胞CD64平均荧光强度×100%;单核细胞与淋巴细胞HLA-DR比值平均荧光强度=单核细胞HLA-DR平均荧光强度/淋巴细胞HLA-DR平均荧光强度;单核细胞与中性粒细胞HLA-DR比值平均荧光强度=单核细胞HLA-DR平均荧光强度/中性粒细胞HLA-DR平均荧光强度;单核细胞与淋巴细胞HLA-DR比值荧光强度中位数=单核细胞HLA-DR荧光强度中位数/淋巴细胞HLA-DR荧光强度中位数;单核细胞与中性粒细胞HLA-DR比值荧光强度中位数=单核细胞HLA-DR荧光强度中位数/中性粒细胞HLA-DR荧光强度中位数。
1.4 统计学方法
采用SPSS 25.0软件进行统计分析。若数据服从正态分布,2组间比较采用两独立样本t检验,多组间比较采用完全随机设计的方差分析检验,多组间两两比较采用LSD检验,参考区间以x±1.96s表示;若不服从正态分布,2组间比较采用Mann-WhitneyU检验,多组间比较采用Kruskal-WallisH秩和检验,多组间两两比较采用bonferroni方法对检验水准进行调整,参考区间以P2.5~P97.5表示。以P<0.05为差异有统计学意义。
2 结果
2.1 健康成人白细胞表面CD64和HLA-DR相关指标参考区间
白细胞表面CD64和HLA-DR相关指标数据均呈偏态分布。检测结果和参考区间见表1。
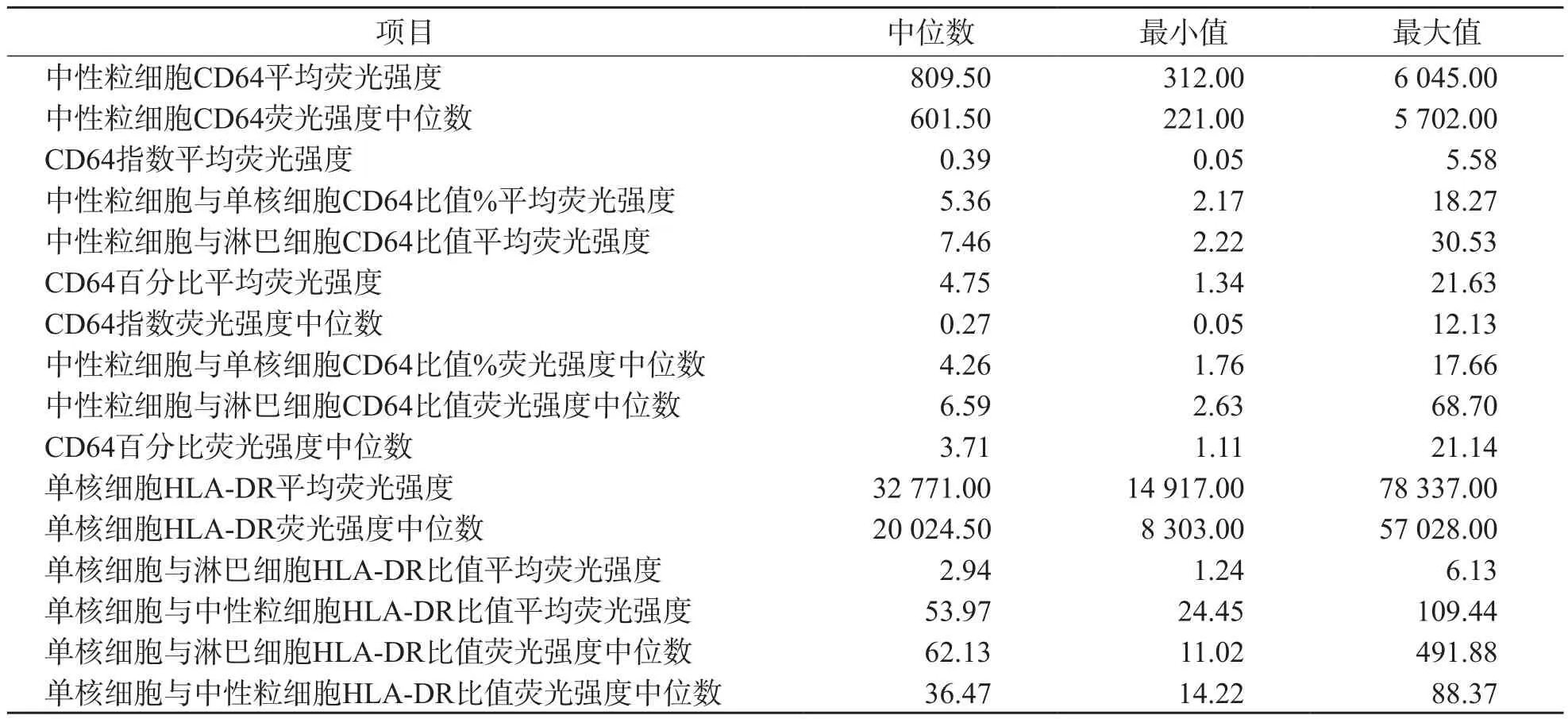
表1 126名健康成人白细胞表面CD64和HLA-DR相关指标检测结果
2.2 不同性别健康成人白细胞表面CD64和HLA-DR相关指标检测结果比较
男性与女性健康成人白细胞表面CD64和H L A-D R相关指标差异无统计学意义(P>0.05),故无需按性别建立参考区间。
2.3 不同年龄组白细胞表面CD64 和HLA-DR相关指标检测结果比较
将126名研究对象按年龄分为22~29岁(28名)、30~39岁(22名)、40~49岁(28 名)和50~60岁(48名)4个组。各年龄组之间CD64相关指标差异均无统计学(P>0.05),单核细胞HLA-DR平均荧光强度、单核细胞HLA-DR荧光强度中位数、单核细胞与中性粒细胞HLA-DR比值(平均荧光强度)差异均有统计学意义(P<0.05)。22~29岁组单核细胞HLADR平均荧光强度低于40~49岁组和50~59岁组(P值分别为0.023、0.007),18~29岁组单核细胞HLA-DR荧光强度中位数低于50~59岁组(P=0.034),其他各年龄组之间单核细胞表面HLA-DR相关指标差异均无统计学意义(P>0.05)。见表2。
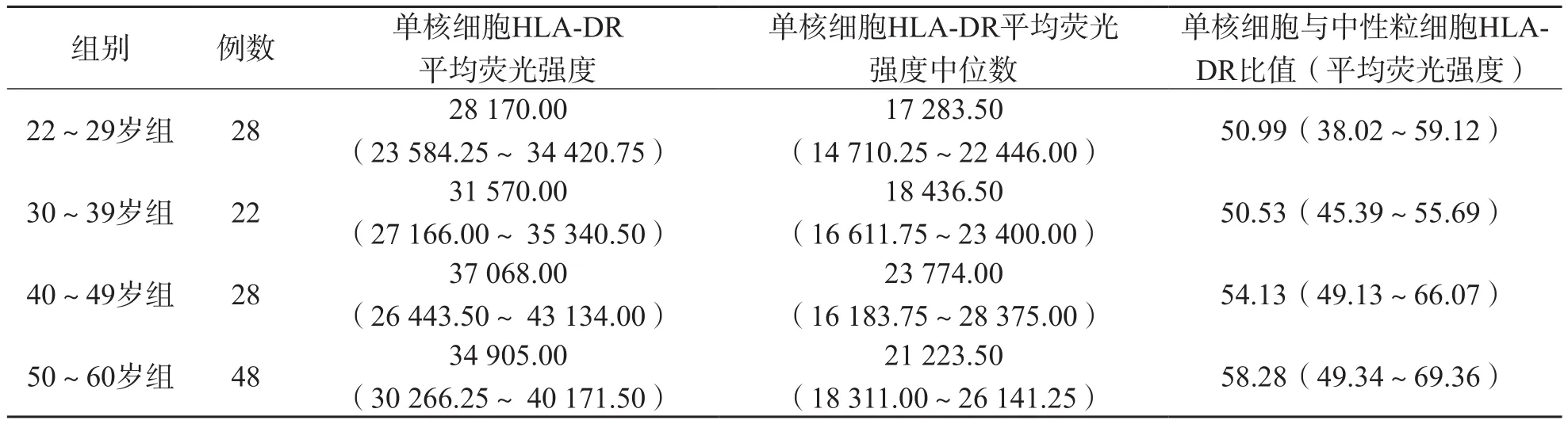
表2 不同年龄组单核细胞表面HLA-DR相关指标检测结果比较
2.4 健康成人白细胞表面CD64和HLA-DR相关指标参考区间的初步建立
因白细胞表面CD64和HLA-DR相关指标数据均呈偏态分布,因此以百分位数法(P2.5~P97.5)建立各项目参考区间。根据性别和年龄的分组比较结果,除单核细胞HLA-DR平均荧光强度合并年龄组后建立22~39岁及40~59岁的参考区间,单核细胞HLA-DR荧光强度中位数合并年龄组后建立22~49岁及50~59岁的参考区间外,其他各项目均建立统一的参考区间。见表3。
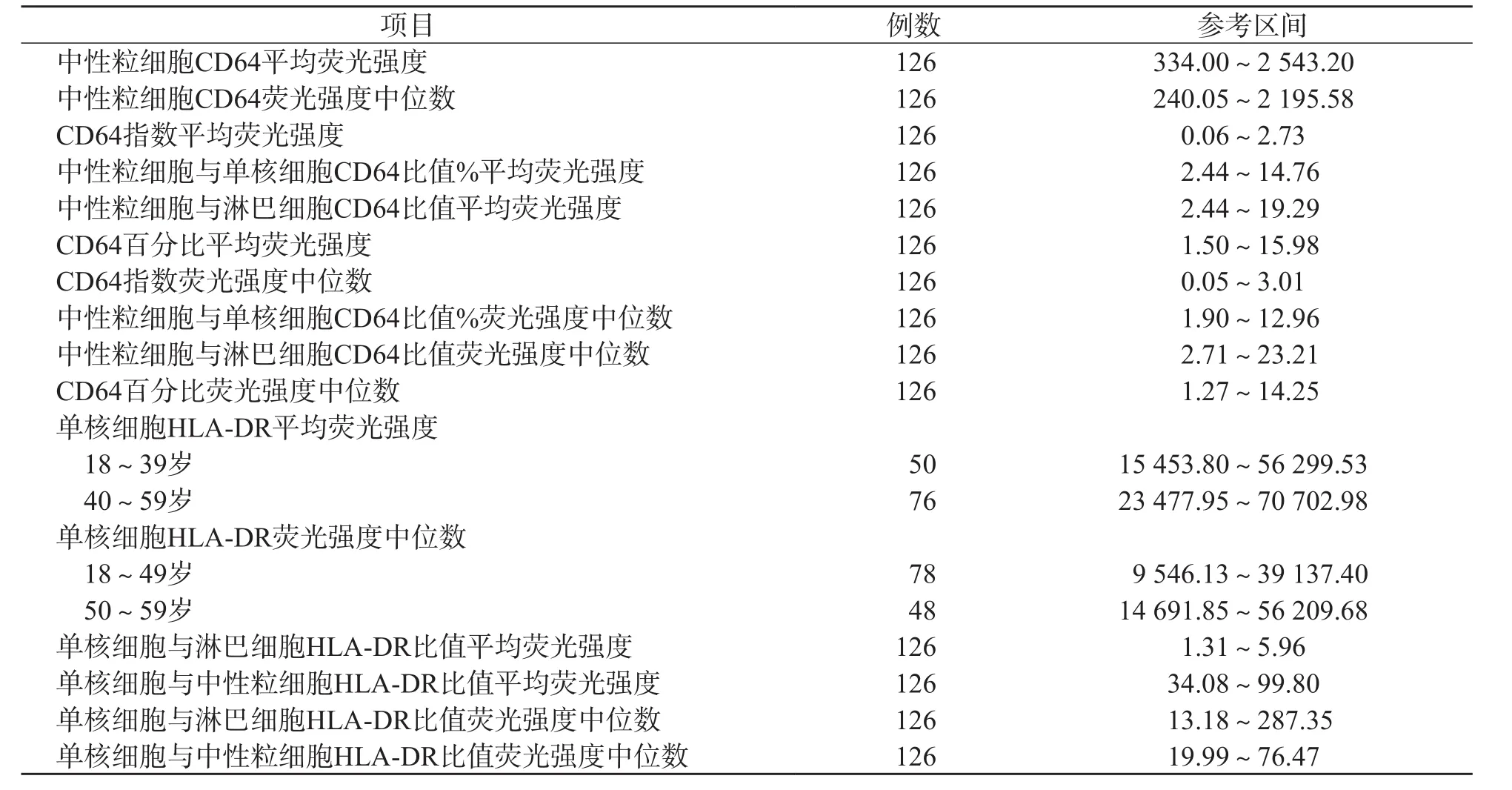
表3 健康成人白细胞表面CD64和HLA-DR相关指标的参考区间
3 讨论
CD64主要表达于单核细胞、巨噬细胞、树突细胞等抗原递呈细胞表面[1]。正常情况下,CD64在这些细胞表面高表达,而在淋巴细胞和多形核细胞表面低表达。当机体发生感染时,会产生抗体,此时中性粒细胞表面CD64表达上调。这是由于CD64能以高亲和力结合单体IgG,所以在抗体反应过程中,CD64上调使中性粒细胞与病原体特异性IgG结合,增强抗体依赖性细胞介导细胞毒作用,促进中性粒细胞吞噬细菌[12]。
HLA-DR表达在巨噬细胞、树突细胞、B淋巴细胞等抗原提呈细胞以及单核细胞表面,参与抗原提呈和T淋巴细胞活化[9]。人体对脓毒血症的免疫反应分为2个连续阶段,在脓毒血症初期会出现全身炎症反应,此时可表现为单核细胞HLA-DR表达正常或升高,之后的免疫反应中,代偿性抗炎反应占主导地位,表现为免疫系统抑制,使机体从炎症状态中恢复稳态,抗炎反应会引起单核细胞下调HLA-DR表达[13-14]。单核细胞HLA-DR表达下调是脓毒血症诱导免疫抑制的标志[15]。
因此,检测白细胞表面CD64和HLA-DR表达,对感染性疾病的早期诊断、治疗监测、预后判断有重要价值[6-8,15-17]。由于CD64和HLA-DR均表达于细胞表面,且分子结构较稳定,适合采用流式细胞术检测,与其他生物学标志物相比,具有用血量少、检测所需时间短的优势。
合理的参考区间是实验室检测的基础,是临床医生进行疾病诊断的重要标准。由于急慢性感染、肿瘤、自身免疫性疾病、服用药物、输血等均可能对检测结果造成影响,因此我们在问卷调查中设计并排除了这些情况;此外,我们通过参考血常规、血生化(肝、肾功能)、尿常规等实验室指标排除了其他一些健康影响因素,采用流式细胞术检测采集筛选到的健康人样本中白细胞表面CD64及HLA-DR的表达,初步建立了健康成人白细胞表面CD64和HLA-DR相关指标的参考区间。
与其他流式细胞术检测指标相同,CD64和HLA-DR也缺乏标准化的指标,目前相关文献中提到的CD64指标主要包括:中性粒细胞CD64阳性百分比、中性粒细胞CD64平均荧光强度、中性粒细胞CD64荧光强度中位数、CD64指数。荧光强度、阳性百分比受试剂、仪器电压、补偿等设定参数和阴性对照设置、人员差异影响较大,不易实现较好的重复性和实验室间可比性。另外,由于中性粒细胞表面CD64表达上调是整个细胞群体CD64分子数的上调,CD64阳性细胞数量所占比例的改变不能反映CD64表达的变化[18]。目前,大多数研究采用CD64指数反映CD64表达变化[19-24]。关于CD64指数的计算公式,各实验室并不统一,国外研究大多应用商品化试剂盒,计算公式为:CD64指数=中性粒细胞CD64平均荧光强度/微球平均荧光强度[19-20],但试剂盒成本较高,不适合临床常规使用。我国早期一些研究将中性粒细胞CD64指数定义为中性粒细胞CD64平均荧光强度/淋巴细胞CD64平均荧光强度[22-24];近年来的计算公式为:CD64指数=(中性粒细胞CD64平均荧光强度/淋巴细胞CD64平均荧光强度)/(单核细胞CD64平均荧光强度/中性粒细胞CD64平均荧光强度)[18,21],该公式综合考虑了作为阴性对照的淋巴细胞和作为阳性对照的单核细胞CD64平均荧光强度因素,既可对CD64进行量化,又可减少人为因素带来的误差,从而使结果更客观[18],本研究将此公式计算结果定义为CD64指数。本研究基于平均荧光强度和荧光强度中位数计算健康成人CD64指数较其他CD64相关指标的变异系数均较小,更适合临床使用。本研究计算CD64指数参考区间上限与之前研究的临界值[18,21]略有差异,建立的基于平均荧光强度计算的CD64指数参考区间为0.06~2.73。闫佩毅等[18]的研究结果显示,42名健康对照者CD64指数的波动范围为0.40~1.31,可能由于人数过少,因此波动区间更小,但中位数与本研究接近。万岁桂等[21]通过受试者工作特征曲线计算得到血液病患者感染组与非感染组CD64指数的最佳临界值为4.96,较本研究参考区间上限略高,可能是选择的人群不同所致。
同样,单核细胞HLA-DR平均荧光强度、单核细胞HLA-DR荧光强度中位数、单核细胞HLADR阳性百分比也受仪器电压、补偿等设定参数以及对照的设置影响较大,因此不适合在临床检测中使用;基于平均荧光强度及荧光强度中位数计算的健康成人单核细胞与中性粒细胞HLA-DR比值的变异系数均较小,更适合临床使用,然而相关文献中大多应用单核细胞平均荧光强度[25],因此无法与本研究结果进行比较。
此外,本研究初步探索了年龄、性别对健康成人白细胞表面CD64和HLA-DR相关指标参考区间的影响,结果显示,随着年龄的增长,白细胞表面CD64和HLA-DR相关指标呈现不同的变化趋势。本研究将研究对象划分为18~29岁、30~39岁、40~49岁和50~59岁4个年龄组,结果显示,白细胞表面CD64相关指标在各年龄组间差异无统计学意义(P>0.05);单核细胞HLA-DR平均荧光强度、单核细胞HLA-DR荧光强度中位数、单核细胞与中性粒细胞HLADR比值(平均荧光强度)有随年龄增长逐渐升高的趋势,可能与年龄增长使累积暴露的感染因子增多,引起免疫上调有关。本研究初步分析了各年龄段健康成人白细胞表面CD64和HLADR相关指标的参考区间,但由于年龄分组后例数较少,可能存在偏移,建议在使用单核细胞HLA-DR平均荧光强度、单核细胞HLA-DR荧光强度中位数、单核细胞与中性粒细胞HLA-DR比值(平均荧光强度)这些指标时进行进一步验证,或建立各年龄段的参考区间,更有利于作出准确、合理的临床决策。本研究未发现男性和女性的白细胞表面CD64和HLA-DR相关指标存在差异,提示性别差异不是白细胞表面CD64和HLA-DR相关指标参考区间的影响因素。
综上所述,白细胞表面CD64和HLA-DR相关指标在感染性疾病的诊断、鉴别诊断、预后判断及治疗检测上应用前景较好,本研究初步建立了健康成人白细胞表面CD64和HLA-DR相关指标的参考区间,是少数采用严格筛选标准筛选健康成人建立的参考区间,为进一步将这些指标应用于临床提供了必要的参考。同时,本研究发现年龄是影响白细胞表面HLA-DR相关指标参考区间的因素,建议进一步建立各年龄段的参考区间,会更有利于临床参考。

