血浆游离DNA甲基化靶向测序在结直肠癌中的应用价值*
张丽静,万智毅,孙利群,徐岩,王霞,张倩倩,周长江
(1.大连大学附属新华医院消化科,辽宁大连 116011;2.上海琨远生物技术有限公司,上海201318)
结直肠癌(colorectal cancer, CRC)是消化道常见的恶性肿瘤之一。我国CRC发病率、病死率在恶性肿瘤中均位居前5 位,且保持上升趋势[1]。半数以上CRC患者确诊时已是中晚期,且目前缺乏敏感性高、特异性强的CRC肿瘤标志物,因此,寻找有效的早期诊断标志物具有重要的意义。循环肿瘤DNA(circulating tumor DNA, ctDNA)是由肿瘤细胞在坏死、凋亡后释放到血浆中的游离DNA(cell-free DNA,cfDNA),其携带的遗传信息与原发肿瘤组织保持着高度一致性,能克服常规组织活检所无法突破的肿瘤异质性问题[2]。同时ctDNA能在外周血循环中直接检出,可以实时、动态地了解肿瘤的状态,已成为新一代肿瘤标志物[3]。郑照正等[4]研究发现,结直肠癌组cfDNA浓度显著高于健康人对照组,且血浆cfDNA水平与TNM分期密切相关。在Ⅱ/Ⅲ期大肠癌患者中,术后连续进行ctDNA检测可预测高复发风险[5]。因此,血浆cfDNA在肿瘤的诊断、治疗及预后等方面发挥重要的作用,可能作为一种新的无创检测方法。本研究通过提取CRC患者和健康人对照组血浆cfDNA,采用高通量cfDNA甲基化靶向测序技术检测血浆cfDNA甲基化水平,并分析其对CRC筛查的价值及临床意义。
1 材料与方法
1.1研究对象 选取2018年6月至2019年9月大连大学附属新华医院消化内镜中心行肠镜检查,随后在肛肠科行手术治疗,术后病理组织学确定为CRC的患者。纳入标准:(1)年龄45~80岁;(2)入组患者为初诊、经结肠镜或术后病理组织学确诊;(3)未接受手术、放疗、化疗、靶向治疗或其他肿瘤相关干预;(4)肝、肾功能正常或基本正常;(5)停用华法林、阿司匹林、硫酸氢氧吡格雷片等抗凝药物1周;(6)临床病历资料完整。排除标准:(1)既往肠癌病史,经历过结、直肠切除手术;(2)有其他癌症史;(3)妊娠期和哺乳期妇女;(4)有凝血功能障碍或血小板异常者;(5)严重心血管病史。共纳入CRC患者38例,年龄46~80岁,中位年龄为65岁,男性13例,女性25例。选取同期体检健康者38例作为健康人对照组,年龄49~78岁,中位年龄63岁,男性16例,女性22例。两组性别构成差异无统计学意义(χ2=0.502,P=0.479),年龄差异亦无统计学意义(t=0.628,P=0.534)。本研究经大连大学附属新华医院医学伦理委员会审核批准(No.XH2018A006),各研究对象均知情同意。
1.2主要仪器及试剂 QIAamp血清血浆核酸纯化试剂盒(德国Qiagen 公司),ZYMO EZ DNA Methylation-Gold 试剂盒(上海吉泰公司),癌胚抗原(carcinoembryonic antigen, CEA)检测试剂盒(美国Roche公司)。Qubit3.0荧光定量仪(美国Thermo Fisher公司),高通量靶向测序仪(Hiseq, 美国Illumina公司),LabChip GX Touch微流控毛细管电泳系统(美国PerkinElmer公司),电化学发光分析仪(E-801,美国Roche公司)。
1.3方法
1.3.1标本采集 CRC患者于手术前采集血液标本,健康人对照组于体检时采集血液标本。清晨空腹抽取各研究对象肘静脉血(EDTA-K2抗凝)约4 mL,置于4 ℃温育30 min,1 600×g离心10 min,小心吸取上清转入2 mL离心管中,4 ℃、16 000×g离心10 min,分离血浆标本分装于0.5 mL离心管中,置于-80 ℃保存。处理过程在4 h内完成,应用时所有样本冻融≤2次。
1.3.2血浆cfDNA的提取 按照QIAamp血清血浆核酸纯化试剂盒说明书进行血浆cfDNA提取。血浆cfDNA 浓度使用Qubit3.0荧光定量仪进行检测,质控标准:片段大小的主峰为100~300 bp,通过质控的cfDNA样本用于后续甲基化检测及二代测序文库构建。
1.3.3DNA亚硫酸盐处理 将上述提取的cfDNA产物进行亚硫酸盐处理,按EZ-DNA Methylation-Gold 试剂盒说明书操作。采用2 μg/mL载体RNA处理cfDNA,以避免核酸的损失;重亚硫酸盐处理时间为95 ℃ 10 min,64 ℃ 20 min。
1.3.4甲基化文库构建测序及分析 构建及测序均由上海鹍远生物技术公司完成。基于单链单特异性引物扩增建库[6],采用高通量靶向测序cfDNA进行检测。文库大小分析采用LabChip GX Touch微流控毛细管电泳系统检测。所用Panel共包括2 478条引物,检测覆盖基因组约0.5 Mb,包含约2 000个甲基化区域(包含Sept9、MGMT、IGIF2、BUB3、FOXD3、HOXD9、PAX6等基因)进行靶向捕获。每个样本测序数据量应大于400万条序列。以上区域主要基于TCGA数据库中全基因组甲基化数据以及文献[7-8]报道的癌症甲基化数据,筛选出CRC特异性高甲基化的区域[7]。根据测序结果计算出每个靶区域的平均甲基化水平(AMF)。利用逻辑回归(logistic regression,LR)分类的方法计算出每个样本的甲基化得分[6]。
1.3.5CEA检测 采用化学发光法,由本院检验科采用CEA检测试剂盒及配套的电化学发光分析仪检测,参考区间:0~4.0 ng/mL。
1.4统计学分析 采用SPSS 25.0统计软件对数据进行分析。数据经正态性检验,非正态分布的计量数据用M(P25,P75)表示,数据间比较采用 Mann-WhitneyU检验;符合正态分布的计量资料以均数±标准差表示,组间的比较采用配对或独立样本t检验;计数资料采用卡方检验或Fisher′s精确检验。ROC曲线评价血浆cfDNA甲基化及CEA单独及联合检测对CRC的筛查价值。以P<0.05为差异有统计学意义。
2 结果
2.1CRC组及健康人对照组血浆cfDNA甲基化评分 CRC组与健康人对照组血浆cfDNA含量差异无统计学意义(34.41±5.00 vs 36.59±4.46,t=0.326,P=0.745)。此外,CRC组中cfDNA甲基化评分(0.53±0.27)显著高于健康人对照组(0.26±0.18),差异有统计学意义(t=6.134,P<0.001)。
2.2CRC组及健康人对照组CEA检测结果 CRC组CEA的表达水平显著高于健康人对照组[3.93(0.42,72.34)ng/mL vs 2.01±0.99 ng/mL],差异有统计学意义(U=269.5,P<0.001)。
2.3血浆cfDNA甲基化与CRC患者临床病理参数之间的关系 伴有淋巴结转移者cfDNA甲基化阳性率较无淋巴结转移者明显升高(χ2=4.323,P=0.038),但在不同性别、年龄、肿瘤位置等参数中的差异无统计学意义(P均>0.05)。见表1。

表1 血浆cfDNA甲基化水平与CRC患者临床病理参数的关系[n(%)]
2.4血浆cfDNA甲基化检测对CRC的筛查价值 以CRC患者作为疾病组,健康人作为对照组,绘制ROC曲线。cfDNA甲基化评分筛查CRC的ROC曲线下面积(AUCROC)为 0.892(95%CI:0.814~0.970),当cut-off值为0.280 5时,其敏感性为84.21%,特异性为86.84%,阳性预测值为86.49%,阴性预测值为84.62%,准确性为85.53%。CEA筛查CRC的AUCROC为0.810(95%CI:0.707~0.909),当cut-off值为4.0 ng/mL时,其敏感性为42.1%,特异性为97.3%,阳性预测值为94.12%,阴性预测值为62.07%,准确性为69.33%。二者联合检测筛查CRC的AUCROC为0.930(95%CI:0.867 4~0.996 7),其敏感性为89.47%,特异性为91.89%,阳性预测值为91.89%,阴性预测值为89.47%,准确性为90.67%。见图1。
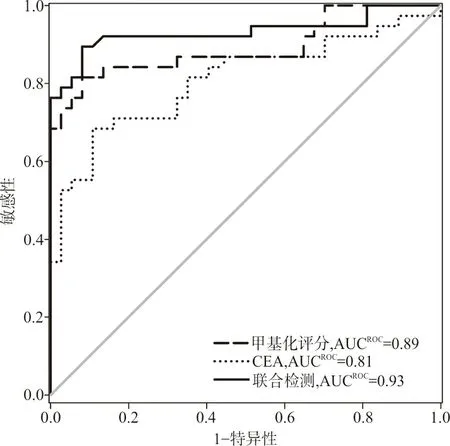
图1 血浆cfDNA甲基化、CEA单独及联合检测筛查CRC的ROC曲线
3 讨论
本研究收集Ⅰ~Ⅲ期CRC患者和健康人对照组血浆标本,检测结果证实二者血浆cfDNA浓度差异无统计学意义,分析其原因可能与CRC分期有关。有学者发现,通过检测ctDNA突变来诊断早期CRC的效果亦不理想,Ⅰ~Ⅲ期CRC患者中ctDNA突变的检出率<60%,即使测序深度达到60 000×[9]。分析原因首先考虑CRC本身存在异质性,并不是所有的CRC组织都存在DNA突变。其次,血浆中ctDNA含量很低,临床取样时采集的血液量有限(一般10 mL),很可能无法检出带有突变信息的DNA片段。
与DNA突变不同,DNA甲基化的修饰具有组织特异性、变化范围广、高敏感性等特点,非常适合作为癌症早期检测的标志物[10-11]。张春燕等[12]研究发现,血浆Septin9基因甲基化检测对于CRC的检出率为62.5%,明显高于粪便隐血试验(FIT)及CEA。笔者与上海鹍远基因公司合作,基于血浆cfDNA的无创甲基化检测技术[6,8],进行高通量的靶向甲基化测序,一次性检测超过2 000个特异性甲基化区域。其中包括常见的CRC相关甲基化基因如Septin9、SHOX2、AP、GATA、HOX、ONECUT等,结果发现CRC组cfDNA甲基化阳性率较健康人对照组明显增加。进一步分析其与CRC患者临床病理参数之间的关系,结果发现伴有淋巴结转移患者的cfDNA甲基化阳性率较无淋巴结转移者明显升高,提示cfDNA甲基化程度与CRC的转移、进展和预后相关;而与患者性别、年龄、肿瘤位置等无明显关系,但该结论需进一步扩大样本量深入分析。
血清肿瘤标志物CEA、CA199是目前临床常用的CRC的筛查指标,有学者发现血细胞炎性指标如中性粒细胞与淋巴细胞比值、血小板与淋巴细胞比值、红细胞分布宽度等联合CEA和CA199有助于CRC早期筛查[11]。张春燕等[12]研究表明,Septin9基因甲基化检测的AUCROC为0.762。笔者采用高通量的靶向甲基化测序分析血浆cfDNA甲基化筛查CRC效能,结果发现AUCROC为 0.892,敏感性为84.21%,特异性为86.84%,准确性为85.33%。此外,与血清CEA相比,其敏感性和准确性显著升高。提示血浆cfDNA甲基化可以作为 CRC早筛的辅助手段。本研究分析发现,血浆cfDNA甲基化、血清CEA联合检测可显著提高筛查CRC的敏感性和准确性,在CRC早筛中具有较好的应用价值。
本研究的不足之处主要有2个方面:一是样本量较小,二是未纳入结直肠腺瘤等其他一些良性病变。在今后的研究中需增加样本例数,同时开展结肠腺瘤、炎症性肠病患者血浆cfDNA甲基化检测,进一步验证其诊断效能。综上所述,CRC患者外周血中的cfDNA浓度与健康人群无差异,不能通过cfDNA浓度区分二者。而通过高通量测序检测cfDNA中特定多区域的甲基化,可以有效地区分CRC患者与健康人群。血浆cfDNA水平与CRC淋巴结转移相关,且检测敏感性优于CEA、Septin9甲基化。cfDNA无创甲基化多靶点检测联合血清CEA可显著提高CRC筛查的敏感性和准确性,在CRC早筛中具有较好的临床价值,可作为潜在的CRC辅助诊断指标。

