一株鹅源鸭疫里默氏杆菌的分离鉴定
李春来 王利丽 刘勃兴 史秋梅

摘要 为对河北省张家口赤城县某肉鹅养殖场的雏鹅死亡病原进行检测,剖检雏鹅进行初步诊断后采用常规方法分离细菌病原,并对分 离菌进行鉴定试验以及药物敏感性试验。结果表明,分离菌经鉴定为鸭疫里默氏杆菌,对雏鹅具有较强致病性,分离菌对庆大霉素、卡那霉素和大观霉素等 8 种抗生素表现耐药,仅对阿莫西林表现敏感。
关键词 鹅;鸭疫里默氏杆菌;分离鉴定
鸭疫里默氏杆菌病是由鸭疫里默氏杆菌 (riemerella anatipestifer,RA)引起的接触性传染病,是制约世界各国鸭、鹅、火 鸡等家禽的健康养殖的重要疾病[1,2]。家禽感染鸭疫里默氏杆菌后,临床表现为纤维素性心包炎、肝周炎、气囊炎等纤维素性炎症。雏 鹅感染疫里默氏杆菌发病率极高,病死率在 10%~40%,最高可达 90%[3]。近年来,在我国有关鹅源鸭疫里默氏杆菌分离鉴定的报道 日益增多,并对我国鹅的健康养殖造成影响。
2019 年 6 月,河北省赤城县某家鹅养殖场雏鹅大量死亡,1 周 内发病率为 20%(1,000/5,000),病死率高达 90%(900/1,000),笔 者对该肉鹅养殖雏鹅死亡病因进行检测以及药物敏感性试验,以 期为该地区鹅鸭疫里默氏杆菌病的防治提供参考。
1 材料与方法
1.1 病料来源
河北省赤城县某鹅养殖场送检发病雏鹅。
1.2 试验动物
15 日龄雏鹅,购自赤城县某养鹅场,试验前试验室饲养 1 周。
1.3 方法
1)雏鹅发病及剖检 询问并记录养殖户雏鹅发病情况,剖检送检的病死雏鹅。
2)细菌的分离纯化 无菌采集病死雏鹅肝脏,用高压灭菌后的 棉拭子采集肝脏内部细菌,涂布于鲜血琼脂平板,参考文献中的方法将平板放置于烛缸中进行培养[4]。挑取优势菌株在小牛血清体积 分数为 0.05 的 TSB 培养基进行纯化培养,并对分离菌进行革兰氏 染色,镜检。
3)分离菌的生化鉴定 参照生化反应管说明书对分离菌进行生化鉴定,并参照说明书统计试验结果。
4)分离菌的 16S rDNA 序列分析 提取分离菌 DNA 作为模板, 16S rDNA 通 用 引 物 (序 列 为 16S-F:AGAGTTTGATCCTGGCTCAG,16S-R:GGTTACCTTGTTACGACTT)进 行 PCR,随 后进行产物测序,用 Lasergene 软件上的 Megalign 功能建立進化 树和同源性分析。
5)分离菌的致病性试验 参考文献中的方法制备菌液浓度为 1× 108cfu/mL 的分离菌菌液[5]。试验分为试验组和对照组,每组 5 只雏鹅。试验组雏鹅肌肉注射 0.5mL 调整浓度后的菌液。对照组每 只雏鹅注射 0.5mL 无菌的 PBS,观察雏鹅状态,并将病死雏鹅进行 剖检,分离病死雏鹅内脏细菌并鉴定。
6)分离菌的药物敏感性试验 按照美国临床和试验室标准协会 (CLSI)的 K-B 纸片扩散法操作标准进行分离菌的药物敏感性试验。
2 结果
2.1 雏鹅临床症状及病理变化
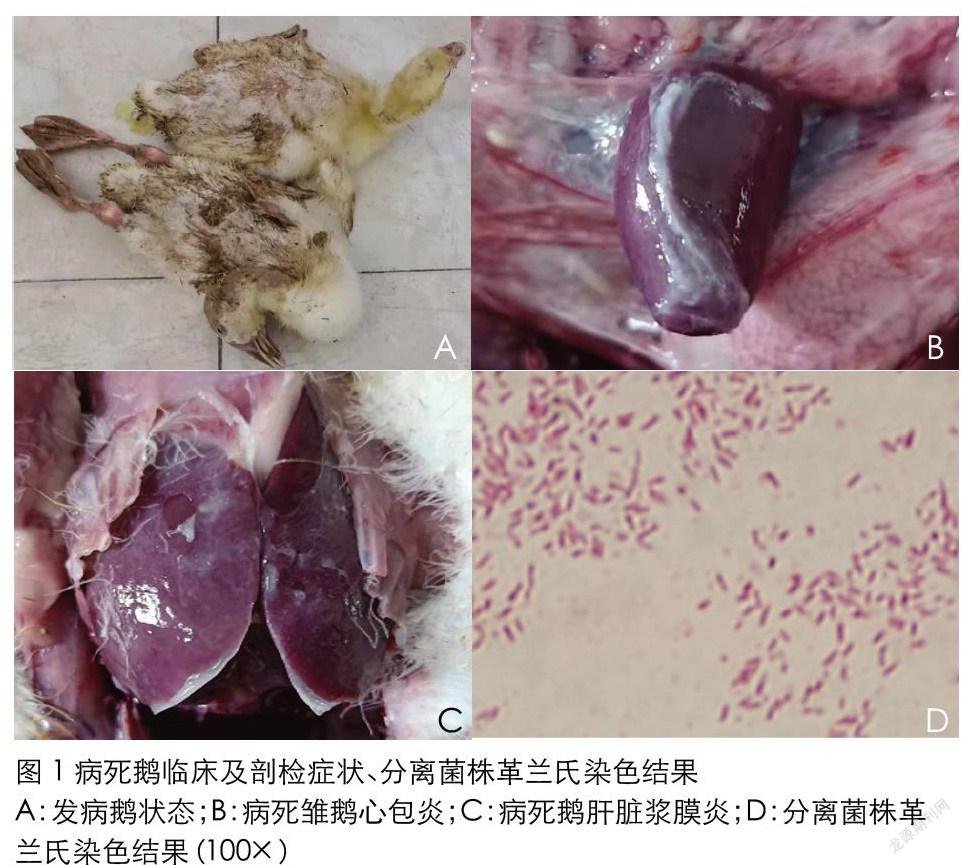
该养殖场共饲养雏鹅 5,000 只,发病雏鹅 1,000 只,发病率为 20%,病死率 90%。发病雏鹅精神倦怠,不食,排黄绿色稀粪,运动 失调。对病死雏鹅进行剖检,发现其心包膜以及肝脏表面有明显纤 维素性渗出物。
2.2 菌落与细菌形态
在鲜血琼脂平板上,菌落呈露珠状,表面光滑,湿润。半透明, 直径约为 1mm。分离菌为革兰氏染色阴性小杆菌,大部分单个散落存在。
2.3 分离菌的生化鉴定
试验结果显示,分离菌不发酵葡萄糖、果糖、蔗糖,VP 试验、硫化 氢产生、尿素分解、硝酸盐还原、甲基红试验、枸橼酸盐利用和靛基质试验均为阴性。将试验结果与《伯杰氏细菌鉴定手册》(第八版)中鸭 疫里默氏杆菌的生化特性比较,符合鸭疫里默氏杆菌的生化特性。
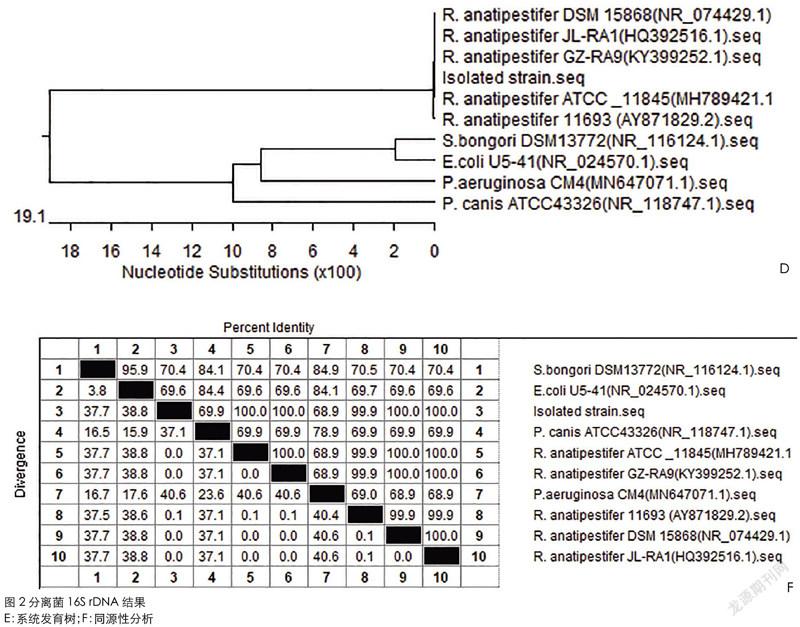
2.4 分离菌 16S rDNA 序列分析
结果显示,分离菌与 NCBI 中的鸭疫里默氏杆菌参考菌处于同 一分支,与大肠杆菌、沙门氏菌、铜绿假单胞菌与巴氏杆菌的不处 于同一分支。同源性分析结果显示分离菌与 NCBI 中的鸭疫里默氏杆菌参考菌同源性在 99%以上。上述结果表明分离菌为鸭疫里默氏杆菌。
2.5 致病性试验
分离菌感染雏鹅后,雏鹅出现精神萎靡,站立障碍、不食、腹泻等症状,96h 后全部死亡。观察对照组雏鹅连续 2 周,未出现病征 以及死亡。剖检病死雏鹅,其心包膜与肝脏表面有明显纤维素性渗 出。从人工感染后病死雏鹅肝脏、心脏等脏器同样分离出鸭疫里默氏杆菌,对照组未分离出该菌。表明分离到的鸭疫里默氏杆菌对雏 鹅具有一定的致病性。
2.6 药物敏感性试验
试验结果显示,分离菌仅对阿莫西林表现敏感,对青霉素、氨 苄西林和新霉素等 7 种抗生素表现中敏,对庆大霉素、卡那霉素和大观霉素等 8 种抗生素表现耐药。表明分离菌具有多重耐药性。
3 讨论
鸭疫里默氏杆菌病是在雏鹅养殖过程中的常见疾病之一,并 且在雏鹅养殖过程中有较高的发病率及死亡率[6]。近年来,从雏鹅 上分离到鸭疫里默氏杆菌的报道日益增多,江苏、四川、山东、上海 等省市均有鹅感染鸭疫里默氏杆菌的报道[3,5,7-10],并且分离菌株具 有较高的致病性。本次研究从河北省赤城县的某肉鹅场病死鹅体 内分离到 1 株鸭疫里默氏杆菌,并采用肌肉注射的方式感染雏鹅, 该方法是目前临床研究中较常见的鸭疫里默氏杆菌的感染方式, 结果显示分离菌株可致雏鹅死亡,表明分离菌株具有一定的致病性,因此,在鹅养殖过程中,鸭疫里默氏杆菌病的防治应得到重视。目前细菌病主要通过抗生素类药物进行治疗[11]。试验的 6 类 16 种 药物中(其中诺氟沙星、氧氟沙星为农业部公告的禁用兽药,仅用 于研究),分离菌仅对阿莫西林表现敏感,对庆大霉素、卡那霉素等 8 种药物表现为耐药,具有多重耐药性,并且对同一类的不同药物 敏感性差异较大,这可能与该场在送检前应用抗生素类药物治疗有关。将药物敏感性试验结果反馈该养殖场,该场应用阿莫西林治疗病鹅,2d 后,雏鹅发病情况得到控制。姜安安等[7]、杨永胜等[8]、赵 宝华等[10]的研究表明,从安徽、四川、扬州分离 RA 菌株对 β - 内酰 胺类药物敏感性最高,而且本次研究与赵宝华等[10]的药物敏感性 试验中发现阿莫西林的抑菌效果最佳,但该现象是否普遍存在需 进一步研究。本次分离到的 RA 与其他报道菌株相比,耐药性更强, 这可能与地方用药以及治疗情况不同有关。
本次研究从河北省赤城县某发病鹅场的雏鹅分离到 1 株鸭疫里默氏杆菌,并对分离菌进行致病性试验和药物敏感性试验,发现 分离菌对雏鹅具有一定的致病性和多重耐药性。
参考文献:
[1] Glunder G, Hinz K H. Isolation of Moraxella anatipestifer from embryonated goose eggs[J]. Avian Pathol. 1989, 18(2):351-355.
[2] Rubbenstroth D, Ryll M, Behr K P, et al. Pat,hogenesis of Riemerella anatipestifer in turkeys after experimental mono-infection via respiratory routes or dual infection together with the avian metapneu movirus[J]. Avian Pathol, 2009, 38(6):497-507.
[3] 王永坤,钱钟,秦淑美,等.鹅浆膜炎的防治研究[J].中国禽业导刊,2005(4):22-24.
[4] 云水麗,杨勇,王小波,等.11 型鸭疫里默氏杆菌分离鉴定及致病性研究[J].中国预防兽医学报,2009,31(8):605-609.
[5] 刘小龙,卢荣辉,程龙飞,等.鹅源血清 11 型鸭疫里默氏杆菌分离株生物学特性分析[J].中国家禽,2017,39(1):47-49.
[6] P. SEGERS, W. MANNHEIM, M. VANCANNEYT, et al. Riemerella anatipestifer gen. nov., comb. nov., the causative agent of septicemia anserum exsudativa, and its phylogenetic affiliation within the flavobacterium-cytophaga rRNA homology group [J]. International Journal of Systematic Bacteriology, 1993, 43(4):768-776.
[7] 姜安安,王小兰,王少辉,等.血清 15 型鹅源鸭疫里默氏杆菌的分离鉴定及交叉免疫保护研究[J].中国动物传染病学报,2015,23(3):17-23.
[8] 杨永胜,陈研,薛亚飞,等.4 株鹅源鸭疫里默氏杆菌部分生物学特性分析[J].中国动物传染病学报,2020,28(5):62-66.
[9] 廖勤丰.鹅浆膜炎病原调查及其免疫、微量凝集试验方法的研究[D].西南大学,2007.
[10] 赵宝华,徐步,范建华.鹅源鸭疫里默氏杆菌的分离和鉴定[J].中国畜牧兽医,2010,37(8):189-192.
[11] Johnson J K, Perencevich E N, Lincalis D P, et al. Dog bite trans mission of antibiotic-resistant bacteria to a human [J]. Infect Control Hosp Epidemiol, 2006, 27(7):762-763.

