多糖组合物对特应性皮炎的功效评价及机理研究
杨凯业 陈俊松 刘光荣 林丽 韩萍 马诗经 谭译楷 吴显仪 张蓝月 杜志云




本研究通过DNFB模拟的特应性皮炎(AD)模型,基于南沙参多糖、枸杞多糖、玫瑰多糖、云芝多糖以及黄芩多糖良好的免疫调节以及抗炎功效,将5种多糖配方组合制备成5种天然多糖组合物,研究該多糖组合物的抗炎、抗氧化、免疫调节等机制,探索利用天然多糖缓解AD的作用及机理。
关键词:天然多糖组合物;特应性皮炎;抗炎
皮肤是保护人体免受外界伤害与刺激的重要保护层,当外界刺激给人体造成损伤时,皮肤的免疫系统会启动信号,促进炎症因子(如白介素等)以及组胺过度表达[2],引起血流加快、细胞的通透性增加,导致皮肤出现紧绷和发红、瘙痒、脱屑甚至烧灼和刺痛等症状[3]。
特应性皮炎(atopicdermatitis,AD)是以慢性、炎症性、瘙痒性为主要表现的皮肤病。过去30年,AD患病率在全球范围内逐步上升,欧美国家儿童患病率为7%~30%,成人1%~10%。我国2015年一项流行病学调查显示,1~7岁儿童AD患病率为12.94%,而成人AD的患病率尚无大样本流行病学调查数据[1]。
临床上对于AD治疗主要应用糖皮质激素类外用药物进行,但是长期应用激素类外用药物会导致皮肤出现萎缩、色素沉着以及毛细血管扩张等不良现象[6-8],进一步对皮肤加以损害。
2,4-二硝基氟苯(DNFB)模拟的AD模型,可通过破坏皮肤的屏障功能达到表皮厚度增加和表皮出现红斑等症状来模拟AD症状[4-5]。本研究通过DNFB模拟的AD模型,基于南沙参多糖、枸杞多糖、玫瑰多糖、云芝多糖以及黄芩多糖良好的免疫调节以及抗炎功效,将5种多糖配方组合制备成5种天然多糖组合物,研究该多糖组合物的抗炎、抗氧化、免疫调节等机制,探索利用天然多糖缓解AD的作用及机理。
沙参在历代本草中都有记载,《本草从新》首次把沙参分为南沙参和北沙参。南沙参性甘,微寒;归肺、胃经;有养阴清肺,化痰,益气等功效,用于肺热燥咳,阴虚劳嗽,干咳痰黏,气阴不足,燥热口干。枸杞子始载于《神农本草经》,被列为上品。《本草纲目》对枸杞子的功效记载颇为详细,可补肾生精,养肝,明目,坚筋骨,去疲劳,易颜色,明目安神,令人长寿[9]。云芝隶属真菌门担子菌亚门多孔菌科栓菌属,具有增强免疫、抗氧化等功效[10]。玫瑰在《药性考》中有记载,可行血破积,损伤瘀痛,浸酒饮。黄芩是中医临床常用药材,具有清热解毒、活血祛瘀、消肿止痛之功效[11]。
南沙参多糖能够对血清抗体的水平产生显著的提高作用,从而对免疫有一定的调节作用[12];枸杞多糖作为枸杞子中主要化学成分及活性成分,具有多种生物活性,有很好的消炎止痛作用,且不良反应小、药物依赖性弱[13];云芝多糖能提高机体免疫功能,增强机体抗感染能力,对自身免疫性疾病、感染性疾病的治疗有重要意义[14];玫瑰多糖可以增强鼠巨噬细胞的白细胞介素6的产生,具有有效的免疫调节活性[15-16]。
01材料与方法
1.1主要材料、试剂、仪器与试验动物
丙二醇(≥99.9%),华韵生物;九水合硫化钠(≥99.9%),阿法埃莎;生理盐水(0.9%),广州美仑生物科技有限公司;无水乙醇,广州化学试剂厂;多聚甲醛(4%),阿拉丁;橄榄油(酸度≤0.3%),黛尼;DNFB(98%),麦克林;蒸馏水,实验室自制。
超高压均质机JN-02HC,广州聚能纳米有限公司;电热恒温水浴锅DK-S22,上海精宏试验设备有限公司;离心机Z326K,德国贺默公司;数控超声波清洗器KQ3200DE,昆山市超声仪器有限公司。
1.2天然多糖的制备、筛选及多糖组合物的复配
1.2.1天然多糖的提取
参考王淑萍等的实验方法[17],取晒干之后的南沙参,粉碎后取20g,与200mL体积分数为95%的乙醇溶液混合,密闭静置过夜。后过滤加入150mL纯化水,置于90℃恒温水浴锅恒温加热3h,用300目滤袋过滤得悬浊液,静置2h后,将悬浊液用双层中速定性离心纸过滤,得到植物多糖水溶液,烘干得到植物多糖提取物。枸杞多糖、玫瑰多糖、云芝多糖、黄芩多糖的提取方法与南沙参多糖提取方法相同,均为水提醇沉法提取。
1.2.2天然多糖的含量测定
移取一定量植物多糖水溶液至100mL容量瓶,用纯化水定容至刻度线,移取2mL该溶液至试管,再各加5%苯酚溶液1.0mL,摇匀,然后加入5.0mL浓H2SO4使其充分混匀,置于沸水浴中加热15min,取出后在冰浴中冷却至室温。取100μL溶液于96孔板中,在酶标仪中在490nm处对样品测定吸光值。将吸光度与多糖标准曲线对比,得出该溶液多糖含量。
1.2.3天然多糖组合物复配
多糖组合物包括复配1~5:枸杞多糖、玫瑰多糖、云芝多糖组合形成复配1;黄芩多糖、南沙参多糖、云芝多糖组合形成复配2;南沙参多糖、枸杞多糖、玫瑰多糖组合形成复配3;黄芩多糖、云芝多糖、玫瑰多糖组合形成复配4;黄芩多糖、枸杞多糖、南沙参多糖组合形成复配5。以上5种复配的多糖质量浓度均为0.5%(w/v)。
1.3AD动物模型及给药方法
参考MotoyamaK等的实验方法[18],取BALB/c雄性小鼠70只,4周龄,体重20~25g,购自广东省医学试验动物中心【动物批号:SCXK(粤)2016-0041】。小鼠标准环境饲养,室温维持在(24±0.2)℃,保持昼夜12h节律,自由饮水、摄食。适应性饲养1周后进行实验。小鼠随机分为空白组、模型组、复配1、2、3、4、5组(共7组,每组10只)。实验前一周剔除小鼠背部毛发(面积约2cm×4cm),直至皮肤完全显露。脱毛次日,除空白组外,其余各组用0.5%DNFB涂抹小鼠背部脱毛皮肤,每只100μL,连续涂抹7d。造模第7天,模型稳定,各给药组开始给予相应的受试物,连续给药15d。给药期间,除正常组外,其余各组每周3次动物背部及右耳涂抹0.2%DNFB,其中背部100μL,右耳50μL。各治疗组从造模第7天开始外用涂抹给药,1次/d,连续15d,将受试物少量涂于患病右耳及背部皮肤,模型组及空白组不涂抹。
1.4PASI评分
观察各组小鼠每天的背部皮损变化情况,依据PASI评分标准给予小鼠皮损处红斑(erythema)、鳞屑(scales)和浸润增厚程度(thickness)0~4的積分:0,无;1,轻度;2,中度;3,重度;4,极重度。将三者积分相加得到总积分(0~12),对各组小鼠积分取平均值后绘制趋势线。
1.5H&E染色
将耳部及背部皮肤组织用4%多聚甲醛固定,常规脱水后,石蜡包埋。将修整好的蜡块放置在石蜡切片机上切成厚度为4μm的切片。切片漂浮于摊片机40℃温水上,将组织展平,用载玻片将组织捞起,并放进60℃烘箱内烤片。待水烤干蜡烤化后取出常温保存备用。切片于显微镜下观察并随机选取视野进行拍照并测量其厚度。
1.6甲苯胺蓝染色测定皮肤肥大细胞密度
用于实验的石蜡切片的皮肤组织用曲别针反贴固定在硬质塑料卡上,防止组织固定时卷曲。经10%福尔马林固定后,进行石蜡包埋和常规切片,甲苯胺蓝染色法对小鼠皮肤组织石蜡切片进行染色,观察各组小鼠患部皮肤组织中肥大细胞数量变化。使用ImageJ1.48软件在放大倍率200×下进行肥大细胞计数。
1.7实时荧光定量PCR检测
将受试小鼠处死后剪去受试小鼠背部皮肤约1cm×1cm的面积(>100mg)的全层皮肤组织。检测皮肤组织中IL-6mRNA、MCP-1mRNA、cAMPmRNA表达。使用总RNA提取试剂盒,从小鼠皮肤组织中提取mRNA,测定RNA含量、纯度符合要求。使用反转录试剂盒合成cDNA。以GADPH作为内参基因,根据2-ΔΔCt算法进行各组mRNA表达量检测。引物由广州赛维尔生物科技有限公司合成,总RNA提取试剂盒购自赛维尔,货号:G3013。引物序列见表1。
1.8统计学处理
实验结果采用单因素方差分析,采用GraphPad软件作图。使用ImageJ软件处理甲苯胺蓝染色图片,所有数值均用“均数±标准误差”。各组间差异比较用单因素方差分析(One-WayANOVA),进行组间两两多重比较。
02结果
2.1多糖提取及含量测定结果
5种植物提取的多糖如表2所示,其中枸杞多糖固重达到8.44g,多糖含量达到43.85%;黄芩多糖固重达到7.10g,多糖含量达到35.50%。
2.2DNFB模型小鼠背部皮肤PASI评分
与空白组比较,模型组小试背部皮肤出现红、肿等症状;与模型组比较,各多糖复配组红、肿等症状明显好转;其PASI评分如图所示。各多糖复配组的第17天PASI评分均明显低于模型组。
2.3DNFB模型小鼠背部皮肤厚度测量及统计
通过对小鼠背部皮肤HE染色,测量其背部皮肤厚度,结果如图2所示。与空白组比较,模型组小鼠背部表皮厚度增厚;与模型组比较,各多糖复配组的小鼠背部表皮厚度均显著下降,其中复配3组的小鼠背部表皮厚度接近空白组。
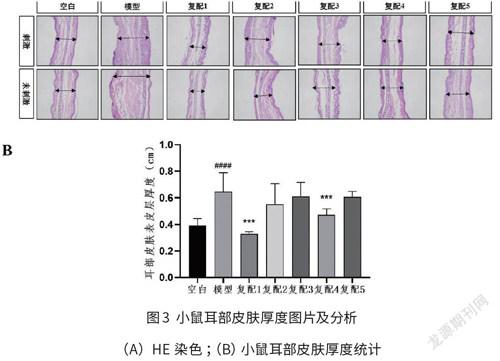
2.4DNFB模型小鼠耳部皮肤厚度测量及统计
通过对小鼠耳部皮肤HE染色,测量其耳部皮肤厚度,结果如图3所示,图3A中刺激为涂抹了98%DNFB的小鼠右耳,未刺激为没有涂抹98%DNFB的小鼠左耳。涂抹了98%DNFB的模型组小鼠与空白组比较,模型组小鼠耳部表皮厚度增厚;与模型组比较,各多糖复配组的小鼠耳部表皮厚度均显著下降,其中复配1、复配4组的小鼠耳部表皮厚度接近空白组。
2.5各天然多糖组合物复配对小鼠背部炎症皮肤组织中肥大细胞密度抑制情况
与空白组比较,模型组肥大细胞密度显著升高;与模型组比较,各多糖复配组肥大细胞密度均显著降低,见图4。
2.6CAMP、MCP-1、IL-6在mRNA中的表达量
实时荧光定量PCR结果表明,与模型组相比,给予多糖复配1的小鼠背部全层皮肤组织中CAMPmRNA的表达量显著升高,如图5所示。
与空白组比较,模型组小鼠背部全层皮肤组织中MCP-1mRNA的表达量显著升高。与模型组相比,给予多糖复配1、3、4、5组的小鼠背部全层皮肤组织中MCP-1mRNA的表达量明显降低,给予多糖复配2、4组的小鼠背部全层皮肤组织中IL-6mRNA的表达量明显降低。
03讨论
患AD后,皮肤免疫屏障受损,导致免疫调节下降,体内肥大细胞活化,炎症反应增强[19-22]。肥大细胞是炎症的主要启动细胞,发生炎症反应时,肥大细胞向外周组织过度浸润加剧、放大炎症反应[23-24]。
有研究表明,AD患者外周血中肥大细胞的数量增多。
AD慢性期,免疫屏障受损,白介素-6等Th1型细胞因子和趋化因子表达水平提高,Th2细胞因子蛋白表达受抑制,刺激肥大细胞、巨噬细胞等炎症细胞增多[25-28]。但同时,患AD后,巨噬细胞的迁移过程受阻,吞噬作用降低,导致无法抵御污染源,MCP-1在巨噬细胞的迁移过程中起到至关重要的作用。研究表明,cAMP参与了多种重要炎症信号通路的调控,如MAPKs、NF-κB、JAKSTAT等通路。
本研究通过DNFB诱导小鼠成功模拟AD模型。结果表明,通过给予多糖复配的小鼠皮肤状况显著好转,明显抑制了小鼠耳部及背部红、肿等症状。
从组织学结果可以看出,南沙参多糖、枸杞多糖、玫瑰多糖、云芝多糖以及黄芩多糖组合物通过调节提升小鼠体内Th1/Th2平衡,从而抑制了肥大细胞的活化,降低肥大细胞密度。实时荧光定量PCR检测结果表明,多糖组合物提升了cAMP在mRNA中的表达水平,同时调节MAPKs、NF-κB通路中MCP-1的表达,增强了皮肤角质层屏障功能,修复了受损细胞。同时,多糖组合物通过抑制白介素-6在mRNA的表达量,使机体Th1/Th2平衡得以调节以及巨噬细胞的活化,从而有效缓解了AD的症状。

