低氧下α-MEM、DMEM高糖培养基对HepG2细胞线粒体Tom20表达水平及脂肪沉积量的影响※
颜然然,蔡 浩,曹学锋,3,冉 丽,王志彪,格日力,3,白振忠,3*
(1.青海大学医学院高原医学研究中心,青海 西宁 810001;2.青海省第五人民医院肿瘤科,青海 西宁 810001;3.青海大学青海-犹他高原医学联合重点实验室,青海 西宁 810001)
低氧与葡萄糖含量差异都会显著影响细胞能量代谢水平,而线粒体膜蛋白数量和脂肪沉积量是细胞能量代谢变化的直接表型。HepG2细胞是最为常用的肝细胞体外培养细胞株,可以直接反映正常肝细胞的代谢变化。美国典型培养物保藏中心(ATCC)培养HepG2细胞采用α-MEM(MEM Eagle,alpha modification)基础培养基,或采用DMEM(high-glucose Dulbecco’s modified Eagle’s medium)高糖培养基[1-3]。线粒体外膜转位酶复合体蛋白20(Translocase Of Outer Mitochondrial Membrane 20,Tom20)是线粒体外膜上主要的膜转运受体蛋白,反映细胞的线粒体物质代谢活力。目前,对于低氧下采用不同糖含量培养基对细胞代谢的影响的研究未见报道。故本研究拟探究低氧下α-MEM、DMEM高糖培养基对HepG2细胞线粒体Tom20表达水平及脂肪沉积量的影响。
1 材料与方法
1.1 材料
HepG2细胞株(普诺赛生命科技有限公司,CL-0103);α-MEM基础培养基(普诺赛生命科技有限公司,PM150410),DMEM基础培养基(普诺赛生命科技有限公司,PM150210);胎牛血清(普诺赛生命科技有限公司,164210);青链霉素混合液(普诺赛生命科技有限公司,PB180120);胰蛋白酶(北京索莱宝科技有限公司,T1350);无菌PBS(Boster Biological Technology,PYG0021),Cell Counting Kit-8(北京索莱宝科技有限公司,CA1210);油红O染色液(北京索莱宝科技有限公司,G1262);Tom20 抗体(Cell Signaling Technology,42406S),β-actin 抗体(Sigma-Aldrich,A5441);Anti-rabbit IgG HRP-linked Antibody(Cell Signaling Technology,7074p);低氧培养箱(MEMMERT),二氧化碳培养箱(Thermo Scientific);酶标仪(Bio-Rad xMark)。
1.2 实验方法
将HepG2细胞分为常氧α-MEM组(21%O2)、常氧DMEM组(21%O2)、低氧α-MEM组(1%O2)、低氧DMEM组(1%O2);各组细胞接种培养稳定后分组刺激72 h;分别观察测定各时间点细胞生长密度、细胞活力,提取各组细胞蛋白,通过Western blot法检测Tom20蛋白表达水平,固定细胞,用油红O染色法检测低氧下各组细胞脂肪沉积情况。具体方法如下所示:
1.2.1 HepG2细胞分组及基础培养
HepG2细胞常规体外培养方案采纳普诺赛公司推荐方案:37 ℃,5%CO2;低氧组采用1%O2,常氧组采用21%O2。细胞培养基分别为α-MEM基础培养基+10%胎牛血清+1%P/S双抗、DMEM基础培养基+10%胎牛血清+1%P/S双抗。HepG2细胞培养生长至汇合度为70%~80%时,用PBS洗涤、0.25%的胰蛋白酶消化处理细胞后按照计划安排接种。为测定不同生长环境细胞活性、增殖毒性,接种两组细胞(6孔板)进行CCK-8实验,每个实验组分别设定复孔及空白组。同时于6孔板中接种细胞行染色观察、6cm培养皿中接种实验组细胞收取蛋白进行蛋白质免疫印迹实验(Western blot)。密切观察细胞生长状态,各组细胞经饥饿处理后进行刺激,低氧组O2浓度为1%,常氧组O2浓度仍为21%,刺激72 h。
1.2.2 HepG2细胞代谢检测
更换HepG2细胞培养基予低氧刺激,并于0、1、12、24、48、72 h时检测各组细胞活力。操作流程如下:从培养箱中取出待测细胞培养板,向96孔板中各检测试验孔分别加入10 μL CCK-8检测试剂,将细胞培养板置细胞培养箱中孵育3 h,用酶标仪在450 nm处测定吸光度。计算各组细胞的活力,计算公式:细胞活力(%)=[A(刺激组)-A(空白组)]/[A(无刺激组)-A(空白组)]×100%。
1.2.3 HepG2细胞增殖代谢观察
将行细胞染色观察的HepG2细胞分别接种于6孔板上,细胞贴壁生长后分别置α-MEM、DMEM培养基,并分别置1%、21%氧浓度的培养箱中培养。分别于刺激开始后第24、48、72 h时观察每组细胞生长状况,观察细胞的形态变化并评估细胞密度。
1.2.4 HepG2细胞线粒体检测
HepG2细胞以低氧刺激72 h,迅速用PBS清洗3遍后加含有1 mM浓度PMSF工作液的RIPA裂解细胞,震荡(冰浴)30 min,离心(4℃,12000r/min)15 min,转移上清液至新的无菌离心管中即为样本蛋白。采用BCA法定量各组蛋白浓度,将各组蛋白稀释至2 μg/μL,加入蛋白上样缓冲液后煮沸15 min使蛋白变性。各组样本冻存于-80 ℃冰箱,避免反复冻融。WB检测:上样量为10 μg,电泳(80V、30min恒压浓缩胶;120V、60min恒压分离胶);以300 mA恒流电场将各蛋白转至PVDF膜。目的条带Tom20的分子量为16 kDa,选择分子量为42 kDa的β-actin为内参。依据各自分子量裁剪PVDF膜,用5%脱脂牛奶封闭,一抗孵育条件:4 ℃,过夜;二抗孵育条件:室温,1 h。将现配现用的Millipore Immobilon Western化学发光HRP底物均匀覆盖PVDF膜(用TBST洗膜3次)后立即进行曝光。上述实验重复3次。用ImageJ软件(取灰度值)获取曝光结果。
1.2.5 HepG2细胞脂肪沉积检测
油红O染色用于判定各组细胞中脂肪沉积情况。参照试剂盒说明书进行染色操作。首先收集的待染色细胞经PBS漂洗后,采用Oil red O(ORO)Fixative固定液固定细胞,以ORO Stain染色脂滴、Mayer苏木精复染细胞核,最后用ORO Buffer固定细胞、蒸馏水覆盖细胞。在荧光显微镜下观察、摄像。
1.3 统计学方法
2 结果
2.1 低氧条件下α-MEM和DMEM高糖培养基上的细胞生长密度
HegG2细胞暴露低氧72 h后细胞的状态较差,如图1所示。采用细胞汇合度计算,结果如表1所示。低氧刺激组细胞密度显著低于常氧组;α-MEM培养基组细胞密度显著低于DMEM培养基组。

图1 细胞生长密度Figure 1 Cell growth density
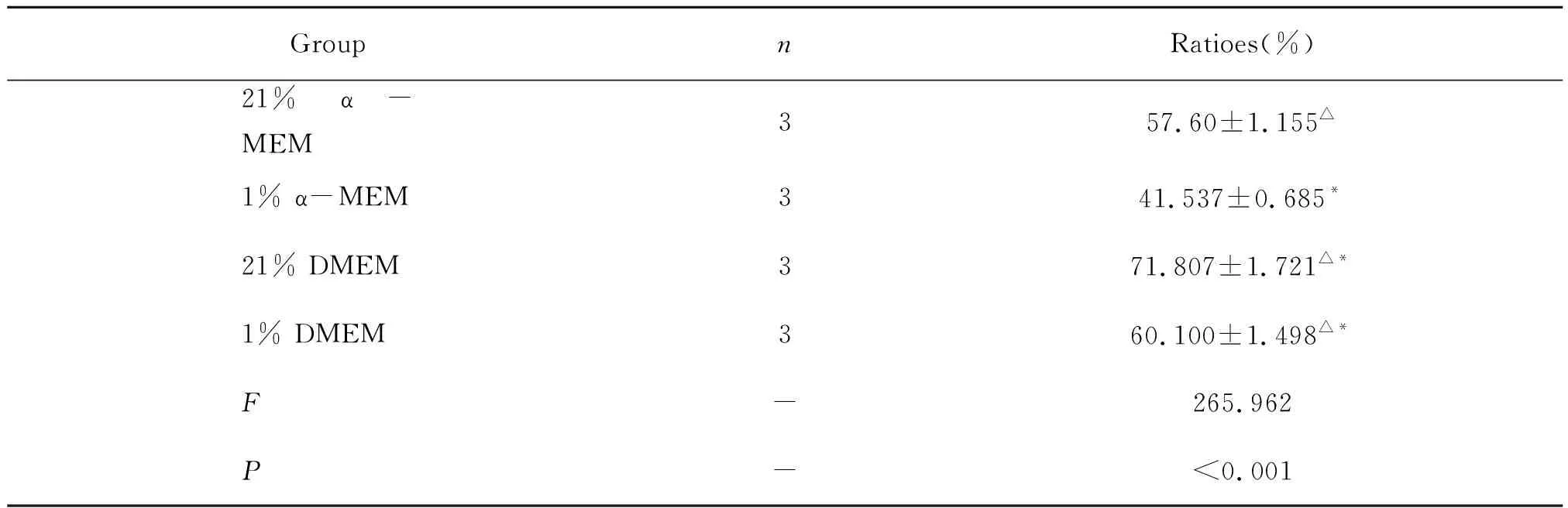
表1 HepG2细胞生长密度Table 1 Growth density of HepG2 cells
2.2 低氧条件下α-MEM和DMEM高糖培养基上的细胞活力
在α-MEM、DMEM培养基上、1%低氧条件下培养72 h,CCK8实验结果显示,细胞活力较21%O2组下降,如图2所示。

图2 细胞生长活力Figure 2 Cell growth viability
HepG2细胞在未行低氧刺激时,不同基础培养基组的常氧及低氧组细胞的活力完全相同,予1%低氧刺激后,第1 h细胞的活力明显降低,随后回升且逐渐升高,低氧刺激第24 h时细胞活力恢复到80%以上且趋于稳定。整体分析低氧条件下细胞的活力比常氧条件下显著降低,而高糖DMEM培养基组与α-MEM基础培养基组的差异性变化趋同。
2.3 低氧条件下α-MEM和DMEM高糖培养基上细胞的脂肪沉积量
油红O染色是检测细胞脂肪沉积量的主要形态学方法。α-MEM培养基组培养的HepG2细胞在72 h时对脂肪的摄取量较低,表现为脂肪团块较小,脂滴直径较小,颜色较浅;而在DMEM培养基组细胞胞质中油红O脂滴较大,颜色显著增高,结果如图3所示。低氧下HepG2细胞中脂肪沉积量显著增加,而且DMEM较α-MEM增加更为明显。
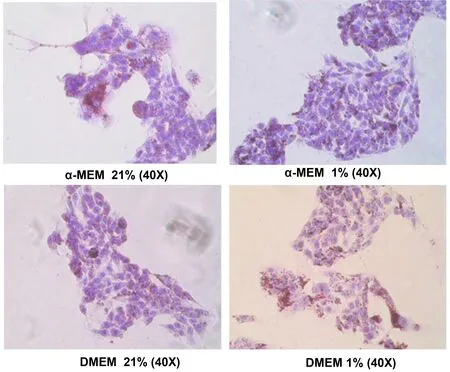
图3 细胞油红O染色图Figure 3 Cells staining with Oil Red O
2.4 低氧下α-MEM和DMEM高糖培养基上的细胞Tom20表达水平
Tom20是细胞线粒体的标志性蛋白。蛋白印迹结果如图4所示。条带灰度值采用ImageJ法分析,结果如表2所示,常氧下Tom20的表达水平在α-MEM中表达更高(较DMEM中)。低氧下α-MEM和DMEM培养基中Tom20的表达显著减少,在DMEM培养基中下降更为明显。不同培养基间DMEM培养基组Tom20表达水平降低明显;不同氧浓度组间低氧组表达水平降低显著。

表2 Tom20表达水平Table 2 Expression levels of Tom20

图4 不同刺激下HepG2细胞线粒体标志蛋白Tom20的表达图Figure 4 Expression of mitochondrial marker protein Tom20 in HepG2 cells under different stimulations
3 讨论
细胞低氧导致包括线粒体在内的多种细胞器损伤,它激活了氧化应激反应,进而产生大量自由基活性氧簇,损伤细胞,造成机体不可逆性损伤[4,5]。在代谢研究中,用α-MEM培养基培养细胞时,仅能维持细胞生长所需的基本能量,而DMEM培养基糖含量较高,可为细胞培养提供丰富的能量。本实验通过研究低氧下α-MEM和DMEM培养基对HepG2细胞的影响,观察细胞脂肪沉积量及Tom20的表达水平差异[6-8],证实了低氧可以在最初阶段显著降低细胞活力,随后逐渐升高。无论是否低氧,HegG2细胞在基础培养基或高糖培养基条件下均可正常生长,但在高糖培养基下细胞线粒体标志蛋白Tom20表达水平降低,脂肪沉积量增加,提示对细胞的能量限制可以增加线粒体的数目和活力,而高糖显著抑制细胞能量活力,增加了脂肪沉积量,这一现象在低氧下更加明显。
3.1 低氧条件下不同培养基对细胞线粒体代谢、脂肪沉积的影响
本研究结果证实了α-MEM培养基为细胞生长和代谢提供了较为友好的条件,但高糖培养基可使细胞内脂肪沉积增多。这一现象可能与线粒体在能量充足时细胞脂肪氧化分解能力下降有关,也可能与线粒体自噬能力下降有关[9,10];还可能与肝细胞在常氧、高糖供应细胞时细胞线粒体呼吸能力增高导致细胞内脂肪沉积减少有关[11,12]。Ringel A E等报道了机体在减少卡路里摄取和供给时,可以显著提高机体的抵御疾病和延长寿命的效果[13]。
3.2 低氧条件对线粒体代谢和脂肪沉积的影响
本研究结果还证实了低氧胁迫可显著性降低HepG2细胞的活力,但增加了其脂肪摄取和沉积能力。脂肪摄取能力是反映细胞脂代谢氧化能力的重要指标之一。线粒体是细胞能量代谢的中枢细胞器,低氧下细胞的多种氧化代谢酶类分子的活力受到抑制,导致线粒体脂肪酸氧化(Fatty acids oxidation,FAO)能力下降,同时细胞低氧使得细胞内的酸性代谢物质如H+增加造成特殊的代谢微环境[14],从而诱发炎症、胰岛素抵抗等。
Tom家族复合体作为线粒体外膜转运体,在线粒体的内外膜间转运蛋白质[4]。本研究中线粒体标志蛋白Tom20是线粒体外膜上主要的膜转运受体。Kaufman DM等研究证实,低氧暴露使秀丽线虫的线粒体质量控制分子伴侣蛋白HSP70等的功能异常,导致大量折叠蛋白的错配和聚集,从而导致线粒体的数量下降和更新能力显著降低[15]。Tom20对氧化应激尤为敏感,Madhu V证实低氧活化HIF-1蛋白导致线粒体的有氧氧化能力减弱,并诱发BNIP3启动的线粒体自噬增加,影响体外培养的神经细胞的生长和增殖[16],我们也证实低氧可以抑制线粒体Tom20蛋白表达数量。我们还发现,Tom20在低氧时表达水平显著下降,在高糖培养基上表达水平下降更为明显,提示低氧进一步妨碍了高糖培养基导致的线粒体损伤。Woo C[17]等研究发现,低氧损伤了细胞,引起线粒体功能异常、数目显著下降,致使炎症-低氧和脂肪沉积的恶性循环,表现为低氧影响线粒体自噬、质量控制和线粒体呼吸,致线粒体损伤,加速脂肪沉积。
本研究也存在部分问题,如我们采用的HepG2细胞株是肝癌细胞,具有部分肿瘤细胞的表型特征,是否能反映正常肝细胞的影响还不得而知。
本研究显示,低氧显著抑制了HepG2细胞活力,但仅限于初期,随后有所改善。高糖培养基可以显著影响线粒体功能,改变脂肪沉积,这一效应在低氧下被进一步放大,提示在高原低氧的特殊环境下,高糖饮食会进一步增加肝细胞的脂肪储存,不利于改善脂肪肝。

