Ghd7和DTH8协同调控水稻抽穗期和部分农艺性状
肖冬冬,宗伍辈,孙康莉,李加俊,刘耀光,郭晶心
(华南农业大学 生命科学学院,广东 广州 510642)
抽穗期是水稻重要的农艺性状,决定水稻品种对栽培季节和地域的适应性,与产量密切相关。水稻抽穗期受光照和温度等外部因素调控,同时也受内在信号如苗龄和激素的作用[1]。水稻抽穗期主要由3个因素决定:基本营养生长性、感光性和感温性。水稻是典型的短日植物,短日促进抽穗,长日延迟抽穗[2]。
在长日植物拟南芥中,光周期对开花的主要调控途径是GI-CO-FT[3]。GI是生物钟构成基因,CO是核心转录因子,长日信号经由GI等促进CO在黄昏特异积累,激活成花素基因FT的转录。FT蛋白由叶片转运到茎顶端分生组织促进成花转换[4]。
水稻中成花素基因是Hd3a和RFT1,是拟南芥FT的同源基因[5-7]。Ehd1是水稻特有的1个抽穗基因,编码含341个氨基酸的B型反应调节子,激活Hd3a和RFT1的表达,促进抽穗[8-9]。有研究表明,水稻中存在长日抑制途径(Hd1/Ghd7/DTH8)-Ehd1-Hd3a/RFT1和短日促进途径Hd1-Hd3a/RFT1,协同调控抽穗期和感光性[10]。
在Ehd1、Hd3a/RFT1的上游,存在众多调控基因。其中,水稻感光性的核心基因有Hd1、Ghd7、DTH8、OsPRR37。Hd1是克隆的第1个水稻抽穗期基因,是拟南芥CO的同源基因,蛋白含有B-box和CCT结构域。在一定的遗传背景中,Hd1具有双重作用,长日抑制、短日促进抽穗,但Hd1的转录水平在长、短日下并没有明显差异[11-13]。Ghd7为单子叶植物特有,编码含有CCT结构域的蛋白,长日下特异表达,一因多效,对水稻株高、抽穗和穗粒数有显著促进作用[14]。DTH8编码CCAAT-Box-Binding转录因子中NF-YB(也称为HAP3)亚基,长日下依赖Ghd7促进株高、抽穗和穗粒数[15-17]。OsPRR37编码 PSEUDO-RESPONSE REGULATOR 7的类似蛋白,也含有CCT结构域,长日下抑制抽穗提高产量[18-21]。
研究表明,Hd1、Ghd7、DTH8和OsPRR37之间存在复杂的遗传和分子互作[10,22-23]。无论日长如何,Hd1(在ghd7/dth8/OsPRR37背景中)促进抽穗,Ghd7(在hd1/dth8/OsPRR37背景中)抑制抽穗。长日下Hd1、Ghd7和DTH8存在双基因和三基因的互作,形成不同的蛋白抑制复合体,从而部分抑制(双基因组合)或完全沉默(三基因组合)Ehd1-Hd3a/RFT1开花通路,使水稻不同程度地延迟抽穗或不抽穗。短日下,Ghd7的表达水平很低,Hd1原本促进Hd3a/RFT1表达的作用与抑制复合体的作用存在竞争,不同程度地促进抽穗。其中,无论日长如何,Ghd7和DTH8组合抑制抽穗作用更强。
以往对Ghd7和DTH8的研究是基于其他核心基因有功能的遗传背景,为在不同的遗传背景中,特别是在hd1和prr37无功能的(hd1/prr37)背景中,深入了解Ghd7和DTH8调控水稻抽穗和农艺性状的遗传互作关系,本研究鉴定了1个hd1/prr37背景下Ghd7和DTH8的双基因分离群体,发现Ghd7和DTH8单基因均能抑制抽穗且不受日长影响。DTH8单基因仅微弱抑制抽穗,却能显著增加二级枝梗数和主穗粒数。在长、短日下,Ghd7和DTH8双基因组合更强烈抑制Ehd1-Hd3a/RFT1的表达,延迟抽穗,并且能够明显增加水稻株高、一级枝梗数、主穗粒数等农艺性状,具有重要的应用价值。
1 材料与方法
1.1 供试材料
华南农业大学陈志强教授团队培育了恢复系‘航恢1179’、不育系‘宁A’及杂交稻‘宁优1179’(粤审稻2014044)[24-25],本研究从‘宁优1179’后代中筛选培育了1个F6群体(hd1/prr37背景,Ghd7和DTH8双基因分离)(简写为GgDd),并从中鉴定得到4种基因型纯合材料ggdd、ggDD、GGdd、GGDD。材料种植于广东省广州市天河区华南农业大学教学科研基地,按水稻常规方法栽培管理。在广州自然短日和自然长日条件下种植双基因分离群体。
1.2 试验方法
1.2.1 分子标记鉴定 采用王慧娜等[26]的方法提取水稻叶片基因组DNA。利用亲本基因组中Hd1、Ghd7、DTH8和OsPRR37的序列差异设计分子标记引物(表1),通过PCR和聚丙烯酰胺凝胶电泳进行检测,鉴定F2~F6个体基因型。

表1 分子标记引物序列Table 1 The primer sequences of molecular markers
1.2.2 表型调查 广州 (23.13°N,113.27°E)自然长日 (Natural long day,NLD:4 月下旬到 7 月中旬,包含了1 h曙暮光和日出到日落的时间,总计大于13.5 h)和自然短日 (Natural short day,NSD:8 月中旬到10月,包含了1 h曙暮光和日出到日落的时间,总计小于13.5 h),以单株为单位每天调查抽穗期,本研究以该株主穗抽出1 cm作为始穗的标准,以种子萌动到始穗的天数作为抽穗期。水稻材料成熟后,考察记录株高、穗长、一级枝梗数、二级枝梗数、主穗粒数、千粒质量、分蘖数等农艺性状。
1.2.3 遗传效应的计算 以双基因无功能型植株ggdd为参照,计算Ghd7、DTH8和两者组合的净遗传效应(e)[10]。单基因的净遗传效应计算公式:e(ggDD) =D(ggDD) -D(ggdd)、e(GGdd) =D(GGdd) -D(ggdd),双基因的净遗传效应计算公式:e(GGDD) =D(GGDD) -D(ggdd) -e(ggDD) -e(GGdd);式中,D代表平均抽穗期。
1.2.4 感光指数的计算 以双基因无功能型植株ggdd为参照,计算不同功能型组合感光指数(Photoperiod sensitivity index,PSI)[10],用 mPSIb和mPSIc分别计算同一生长季节和不同生长季节的感光指数。以DTH8为例,mPSIb(ggDD) = (DALD-DNSD)/DNSD,mPSIc(ggDD) = (DNLD-DNSD)/DNSD,同样计算其他基因型组合的感光指数;式中,ALD代表人工长日,NLD代表自然长日,NSD代表自然短日。
1.2.5 qRT-PCR 表达检测 在自然短日和人工长日 (Artificial long day,ALD:自然长日同期种植材料,并在黄昏人工加光,使光照时间维持在14.0~14.5 h)下种植4基因型纯合材料ggdd、ggDD、GGdd、GGDD,苗龄60 d,早上8:00取样,取每个单株的倒一至倒三叶上半段,共取3次生物学重复。采用Trizol法提取植物总RNA,经DNaseI处理后用Oligo d(T)反转成cDNA,用目标基因特异引物进行PCR反应,以Actin作为内参基因(表2),通过计算2-△Ct值来确定目标基因在4种纯合型材料中的相对表达量[10]。
表2 qRT-PCR 引物序列Table 2 The sequences of qRT-PCR primers
1.2.6 对农艺性状贡献度的计算 以双基因无功能型植株ggdd为参照,计算不同功能型组合对农艺性状的贡献度 (Contribution degree,CD)。以DTH8为例,CDDTH8/% = (ATggDD- ATggdd)/ATggdd,式中,AT表示各农艺性状(Agronomic trait)的平均值,同样方法计算其他基因型组合的贡献度。
2 结果与分析
2.1 在 hd1/prr37背景中,Ghd7和 DTH8双基因分离群体的构建和抽穗表型
已有研究表明,Ghd7和DTH8组合抑制抽穗作用更强[22]。为了深入揭示Ghd7和DTH8调控水稻抽穗和农艺性状的遗传互作关系,本研究构建了1个Ghd7和DTH8双基因分离的重组自交群体(hd1/prr37背景,详见“1.1”)。‘宁A’携带功能型Hd1、DTH8和无功能型ghd7、prr37,‘航恢1179’携带无功能型hd1、dth8和功能型Ghd7、PRR37。本研究利用分子标记,在‘宁A’和‘航恢1179’的F2代中选择hd1/prr37纯合无功能、Ghd7和DTH8为杂合的植株 (基因型为Ghd7ghd7DTH8dth8,GgDd),自交留种并持续选择到F5,从F5中选择GgDd基因型单株自交留种,此F6群体用于下一步研究(图1)。

图1 ‘宁 A’(NA)与‘航恢 1179’(HH) 4 个抽穗基因的结构和分子标记Fig. 1 Structures and molecular markers of four heading date genes in ‘Ning A’ (NA) and ‘Hanghui 1179’ (HH)
我们在广州自然短日和自然长日条件下分别种植了116株和188株F6群体,观察植株的抽穗期并进行了分子标记检测。对植株的基因型进行卡方检验,群体中Ghd7和DTH8独立分配,分离符合孟德尔双基因分离遗传定律 9∶3∶3∶1,χ²(9∶3∶3∶1)<χ²0.05,df=3=7.82,无显著差异 (表3)。

表3 F6 群体基因型的卡方检验Table 3 The chi-square test of plant genotypes from F6 population
在自然长日下,Ghd7和DTH8双基因分离群体的抽穗期在 82~118 d 之间呈较连续分布,110 d为抽穗高峰;ggdd和ggD_(_代表DD纯合或Dd杂合)基因型植株早抽穗,G_dd型抽穗稍晚,同时携带功能型G_D_的植株抽穗最晚(图2a)。在自然短日下,分离群体的抽穗期分布在 66~97 d 之间,90 d为抽穗高峰;Ggdd、G_dd和ggDD基因型的植株抽穗明显早于G_D_植株(图2b)。在Ghd7和DTH8双基因分离的群体中,长、短日下二者组合植株抽穗最晚。我们从F6中筛选出4种基因型纯合的植株自交留种,后续用这些纯合体研究Ghd7和DTH8的遗传互作和调控机制。
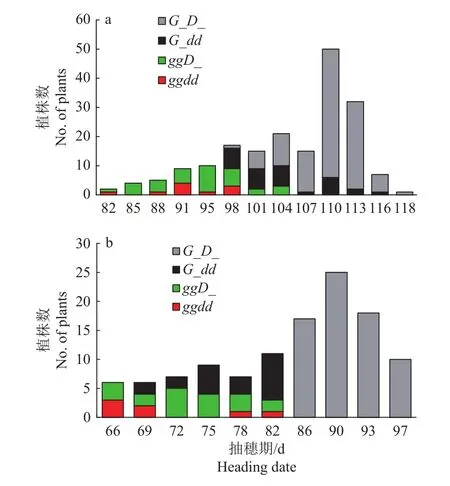
图2 自然长日 (a)、自然短日 (b)下 Ghd7、DTH8双基因分离群体抽穗分布Fig. 2 The distribution of heading date in Ghd7,DTH8 segregating population under natural long day (a)natural short day (b) conditions
2.2 Ghd7和 DTH8 4 种基因型组合材料的抽穗期、感光性、遗传效应及其对下游基因的调控
我们在广州自然短日、同期人工长日以及自然长日下种植了4种纯合型植株ggdd、ggDD、GGdd和GGDD。观察材料的抽穗期,计算基因的净遗传效应和感光指数。
我们对比分析了Ghd7和DTH8单基因以及组合对抽穗的效应。在自然长日、人工长日和自然短日3种日长下,ggDD型植株分别比ggdd型晚抽穗6、5和6 d,表明DTH8有较弱的抑制抽穗的作用。GGdd型植株比ggdd型抽穗晚,Ghd7在3种日长条件下分别抑制抽穗17、10和13 d。GGDD型植株在各种日长条件下抽穗均为最晚,比ggdd型分别晚 31、24 和 29 d (图3、图4)。我们通过计算净遗传效应(e)来分析Ghd7与DTH8组合对抽穗期的影响,结果表明,Ghd7和DTH8组合抑制抽穗的作用,在扣除了Ghd7和DTH8单基因的效应后,还有8~10 d;这说明二者组合后的效应不是简单的加性关系。DTH8对抽穗的影响较小,和Ghd7组合在一起后二者产生了更高阶的互作,表现出更强的抑制作用(表4)。感光指数用来衡量和比较材料的抽穗期对日长的敏感程度,数值越大,感光性越强[10]。4种基因型材料ggdd、ggDD、GGdd和GGDD,在同一生长季节人工长日和自然短日的抽穗期,测得的感光指数(mPSIb)分别是0.08、0.06、0.03和0;在不同生长季节自然长日和自然短日的抽穗期,测得的感光指数(mPSIc)分别是0.19、0.17、0.20和0.15。由于本研究中材料在自然短日和人工长日下的抽穗期是在同一生长阶段观察到的,同一生长季节感光指数更准确。结果表明在hd1/prr37背景中,单基因Ghd7、DTH8以及二者组合株系的感光性弱。

图3 4种纯合型株系在自然长日(a)和自然短日(b)下的表型Fig. 3 Phenotypes of four isogenic lines under natural long day (a) and natural short day (b) conditions

图4 4种纯合型株系在不同日长条件下的抽穗期Fig. 4 Heading dates of four isogenic lines under different day-length conditions

表4 不同日长条件下Ghd7、DTH8对抽穗的净遗传效应(e)1)Table 4 Net genetic effect (e) on heading date of Ghd7 and DTH8 under different day-length conditions
为了研究Ghd7和DTH8不同组合对下游基因的调控,我们利用qRT-PCR检测4种纯合基因型材料的叶片(自然短日和人工长日下,苗龄60 d,早上8:00取样)中Ehd1、Hd3a、RFT1的表达。我们结合遗传效应来分析表达数据,GGDD型植株比ggDD型抽穗晚,Ghd7在长、短日都下调Ehd1、Hd3a和RFT1的表达,抑制抽穗;Ghd7和DTH8的组合在长、短日下更明显地抑制Ehd1、Hd3a和RFT1的表达,对抽穗的抑制作用更强;DTH8在长、短日下微弱抑制抽穗,但对下游基因的调控却没有表现出相应的规律 (图5a~5f)。

图5 4 种纯合型株系人工长日 (a~c)、自然短日 (d~f)下Ehd1、Hd3a和 RFT1的表达Fig. 5 Expression of Ehd1,Hd3a and RFT1 in the four isogenic lines under artificial long day (a-c) and natural short day(d-f) conditions
2.3 Ghd7和 DTH8 4 种基因型组合材料的农艺性状
已有的研究表明Ghd7和DTH8是多效性基因,调控抽穗期、分蘖数、千粒质量等[14,16]。我们系统考察了自然短日和自然长日下Ghd7与DTH8的4种组合材料的农艺性状,包括株高、穗长、一级枝梗数、二级枝梗数、主穗粒数,千粒质量和分蘖数。以ggdd基因型为参照,对农艺性状进行单因素方差分析;总体上,无论日长如何,Ghd7、DTH8以及双基因组合都能不同程度地促进株高、穗长、一级枝梗数、二级枝梗数、主穗粒数和千粒质量,但对分蘖数没有显著影响(表5)。
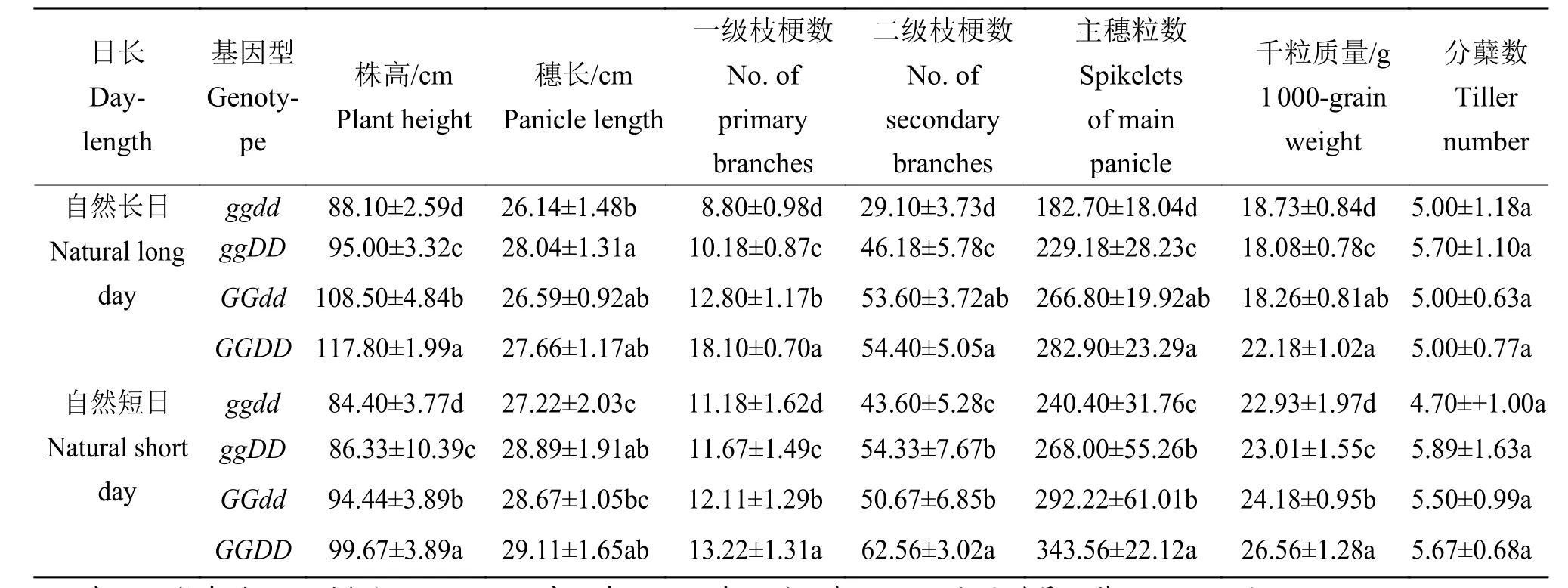
表5 4种纯合型株系自然长日、自然短日下的农艺性状1)Table 5 Agronomic traits of four isogenic lines under natural long day and natural short day conditions
以ggdd为参照,我们计算了Ghd7、DTH8及组合对农艺性状的贡献度(图6a、6b)。ggDD材料相比ggdd,在自然长日下,DTH8对二级枝梗数和主穗粒数的促进作用最强,贡献度分别为59.11%和40.93%;在自然短日下,DTH8对二级枝梗数的促进作用最强,贡献度为24.61%。虽然DTH8对抽穗的作用较弱,但其单基因长、短日下均能显著地促进二级枝梗数。GGdd材料相比ggdd,在自然长日下,Ghd7对二级枝梗数和主穗粒数的促进作用最强,贡献度分别为84.19%和63.98%;在自然短日下,Ghd7对主穗粒数的促进作用最强,贡献度为21.56%。DTH8和Ghd7单基因对农艺性状的作用在长日下明显高于短日下。在长、短日下,Ghd7和DTH8组合对抽穗期的调控存在更高阶的互作,对株高、一级枝梗数、主穗粒数也有明显的增强效应,在农业生产中有重要的应用价值。

图6 自然长日 (a)和自然短日 (b)下 Ghd7、DTH8及组合对抽穗期和农艺性状的贡献度Fig. 6 Contribution degree of Ghd7,DTH8 and their combination on heading date and agronomic traits under natural long day (a) and natural short day(b) conditions
3 讨论与结论
本研究培育了hd1/prr37背景下Ghd7、DTH8双基因分离的群体,深入揭示了无论日长如何Ghd7和DTH8单基因均能抑制抽穗,Ghd7抑制抽穗更强。Ghd7和DTH8之间存在遗传互作,二者更显著抑制Ehd1-Hd3a/RFT1通路,延迟抽穗。二者的关系在Hd1/OsPRR37背景下同样如此[10,27-28],表明它们的互作非常稳定,不受遗传背景和日长的影响。酵母双杂交以及pull-down验证了Ghd7和DTH8存在分子互作,通过BiFC证明了互作发生在细胞核[29]。研究还发现,DTH8可以与NF-YC2形成异源二聚体,3个CCT亚家族的Ghd7、PRR37、Hd1分别可以与DTH8/OsNF-YC2形成三元复合物,进而能够结合特定的DNA序列[30]。因此,在充分的遗传研究的基础上,可以更为深入地研究Ghd7/DTH8复合体作用的分子机制,包括复合物的其他组分,如直接结合的DNA序列和调控的下游基因等。
在一定范围内,水稻抽穗期和产量呈现显著正相关,抽穗期越长,积累的生物量越多,产量越高[21,31]。有趣的是,我们发现DTH8单基因微弱抑制抽穗,却能显著增加二级枝梗数和主穗粒数。在长、短日下Ghd7和DTH8的组合使抽穗期延长,能最大限度地利用光热资源,积累和转运更多的光合产物,明显增加水稻株高、一级枝梗数、主穗粒数等农艺性状。尽管长日下Ghd7和DTH8双基因纯合抽穗期较长,但对杂交稻来说,双基因为杂合状态,抽穗相对纯合型早一些,并且利用了二者对农艺性状的协同促进作用,因此具有重要的应用价值。这同时表明抽穗期基因以及不同组合调控了水稻整体的生长发育,但它们是直接在穗部发挥作用,还是通过调控成花素间接调控农艺性状及产量,相关的机制值得深入研究。

