RASGRF1基因遗传多态性与甘肃地区近视易感性的相关性
汪向利 杨丽媛 金庸 李培强 丁韵涵 谢小冬 杨君
作者单位:1 甘肃省人民医院眼视光中心,兰州 700030;2 兰州大学基础医学院,兰州 730000
近视是全球性的公共卫生问题,近视的发生是遗传因素和环境因素相互作用的结果。通过全基因组关联研究(Genome-wide association studies,GWAS)以及高通量测序等遗传学方法确定了与发生高度近视相关的单核苷酸多态性(Single nucleotide polymorphism,SNP)。GWAS研究发现染色体区域15q25与近视的发生显著相关,其中位于RASGRF1
基因的多个SNPs与屈光不正、近视或等效球镜度(SE)相关联。RASGRF1
基因与近视的相关性在欧洲、美国、澳大利亚和亚洲人群中得到验证,但也有研究报道白种人和亚洲人中并没有发现此种相关性。因此RASGRF1
基因与近视的相关性需要进一步在不同人群中进行验证。近年来,随着“DNA 元件百科全书”计划(Encyclopedia of DNA elements,ENCODE)和表观组路线图计划 (Roadmap epigenomics mapping consortium,Roadmap)及基因型组织表达数据库(Genotype-tissue expression,GTEx)等计划的实施,为促进基因非编码区调控元件和功能性SNPs研究奠定了基础。本研究根据ENCODE确定的人眼组织中RASGRF1 候选顺式调控元件(Candidate cis-Regulatory Elements,ccREs),并通过GTEx数据确定与目的基因表达相关且最小等位基因频率(Minor allele frequency,MAF)高于10%的SNPs,进而在甘肃地区近视人群中进行病例对照分析,分析候选SNPs与近视发生的相关性,探讨RASGRF1
影响近视发生风险的可能分子机制。1 对象与方法
1.1 对象
选取2018年1月至2019年1月在甘肃省人民医院眼视光学中心就诊的258例无亲缘关系的近视患者,根据近视程度分级标准进行分组,其中高度近视组(双眼-10.00 D<SE≤-6.00 D)166例(332眼)和中低度近视组92 例(184 眼) (双眼或单眼-6.00 D<SE≤-0.75 D),并将77例(154眼)无近视的课题志愿者作为正常对照组。本研究遵循赫尔辛基宣言,经甘肃省人民医院医学伦理学委员会批准(批号:2018-103),所有参与患者均知情同意,所有研究操作符合规定。
纳入标准:①年龄18~23 岁;②近视和散光患者,球镜度>-10.00 D,柱镜度数>-2.00 D;③无明显斜视;④无眼部手术史或眼部外伤史;⑤无影响视力、屈光度改变的全身系统性疾病;⑥无长期用药史。
排除标准:①屈光度<-10.00 D;②患有斜视、弱视,圆锥角膜以及其他角膜扩张性疾病;③存在活动性眼部疾病;④患有影响视力的白内障、青光眼、眼底疾病及视神经病变等眼部疾病;⑤具有眼部手术史或眼部外伤史;⑥具有全身病史及药物服用史。
1.2 眼科检查
本研究纳入对象进行的眼科检查包括:裸眼视力、矫正视力、裂隙灯显微镜及眼底、散瞳验光、眼压等检查。
1.3 SNP的选择
本研究针对RASGRF1
基因及其上游100 kb为候选区域,即chr15:79483215-79383215(hg19)。选取的候选位点考虑以下条件:①从千人基因组中国人群中挑选MAF>10%的SNP位点(合计350个SNPs)。②从ENCODE数据库(http://screen.encodeproject.org)获取眼部相关的组织和细胞的顺式调控元件ccRE数据,筛选RASGRF1
及其上游100 kb范围内(chr15:79250289-79483215)的ccRE序列。③GTEx数据库中与候选区域基因表达显著相关的SNPs。最终本研究选择了5个SNPs进行基因分型分析(见表1)。1.4 血样采集和DNA提取
选用QIAampDNA 全血抽提试剂盒(德国Qiagen公司)提取研究样本的基因组DNA。
1.5 SNP基因的分型和测序
利用改进的多重连接酶检测反应技术(Ligase detection reaction,LDR)进行SNP分型(上海天昊生物科技有限公司)。所用聚合酶链式反应(Polymerase chain reaction,PCR)引物和LDR探针见表2。纯化后多重PCR产物用于LDR反应,之后使用ABI3730XL测序仪(美国Applied Biosystems公司)进行检测,使用GeneMapper软件 (version 4.1,Applied Biosystems)进行分型数据分析。分型过程中确保阴性对照无条带,此外10%的样本被随机挑选进行测序和重复实验的验证,确保检测结果的可靠性。
1.6 统计学方法
系列病例对照研究。利用Plink1.9 软件进行候选SNPs 与近视的相关性分析。使用卡方检验在对照样本中进行哈-温平衡(Hardy-Weinbergequilibrium,HWE)检测和性别差异分析。本研究所有候选位点均符合哈-温平衡(P>0.05)。应用t
检验对年龄因素进行统计分析。不同遗传模型下的比值比(Odds ratios,OR),95%置信区间(Confidence intervals,CI)和P
值利用非条件Logistic回归分析进行年龄和性别校正。以P
<0.05 为差异有统计学意义。2 结果
2.1 一般情况
本研究共收集到258例(516眼)近视患者,其中高度近视组166例(332眼),其中男96例,女70例,SE为(-7.55±1.53)D;中低度近视组92例(184眼),其中男51例,女41例,SE(-1.00±0.48)D;正常对照组77 例(154 眼,男53 例,女24 例),SE(-0.16±0.30)D,各组的年龄和性别比较差异无统计学意义(t
=0.43,P
=0.56),SE比较差异有统计学意义(t
=38.73,P
<0.001)。2.2 RASGRF1内含子的rs8033417与高度近视显著相关
本研究涉及的rs8033417、rs2870087、rs4778879、rs12902831、rs939658最小等位基因频率与千人基因组中国人群(CHB和CHS)表现出相近的频率(见表1),同时对照样本符合哈-温平衡检测(P
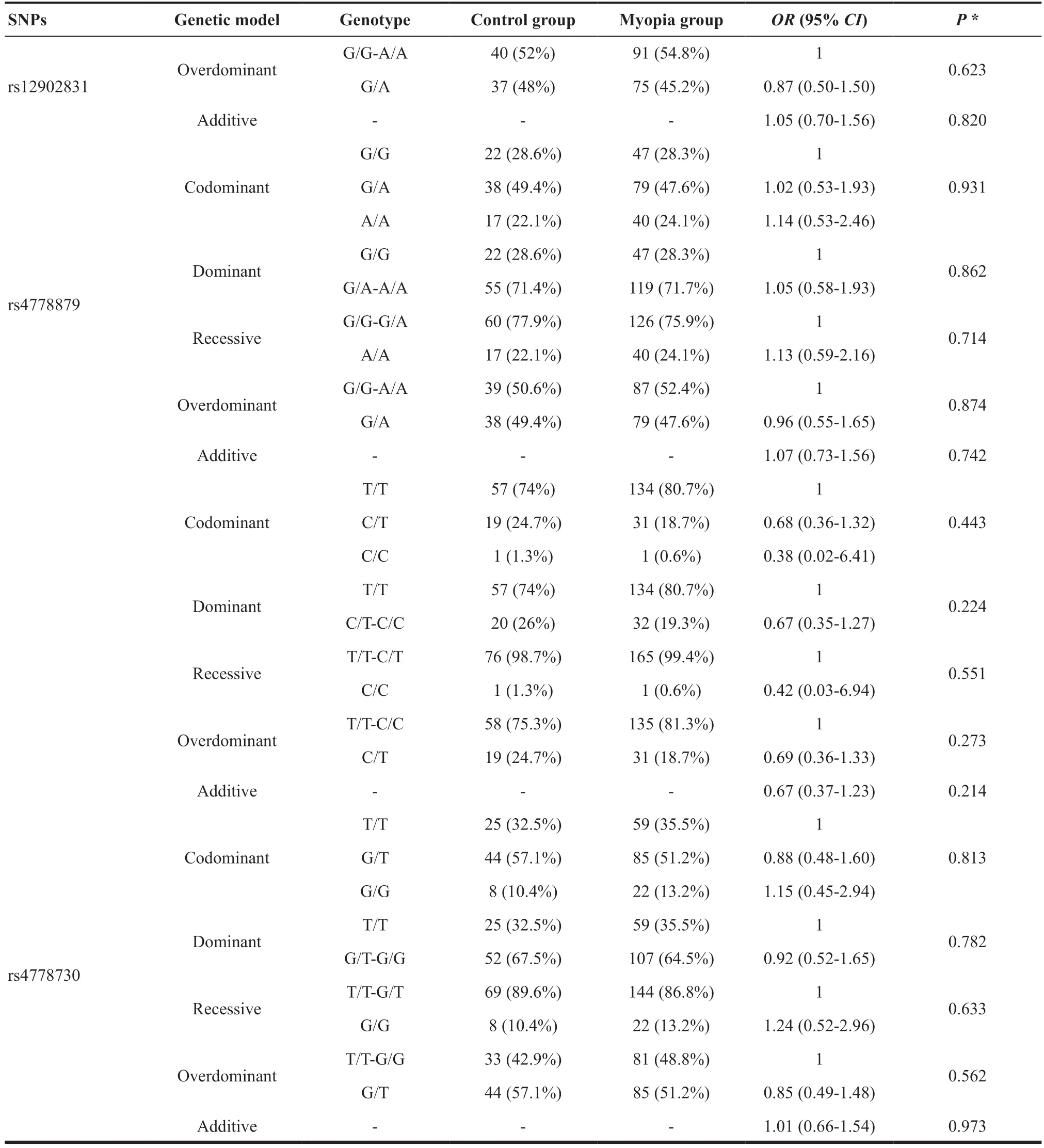
> 0.05)。本研究在对SNPs进行基因分型后,比较了不同SNP基因型在共显性、显性、隐性、超显性、加性5 种遗传模式下的分布差异,见表3。本研究发现rs2870087、rs4778879、rs12902831、rs939658位点在不同遗传模式下,在近视组和对照组中差异均无统计学意义(P
>0.05),然而,在其他4种遗传模式中,rs8033417基因型频率在近视组和对照组中的分布差异均有统计学意义(共显性模式P
=0.026,显性P
=0.007,隐性P
=0.310。超显性P
=0.026,加性P
=0.011),P
值进行Bonferroni校正后,在显性模式下此差异仍有统计学意义(P
=0.034),而在加性模式下,P
值边缘显著(P
=0.055)。显性模式下,与T/T基因型比较,C/T-C/C基因型能显著降低近视的患病风险(OR
=0.49,95%CI
:0.29~0.83,P
=0.035)。
表1.RASGRF1基因的候选SNPs信息Table 1.The candidate SNPs information of RASGRF1 gene was selected
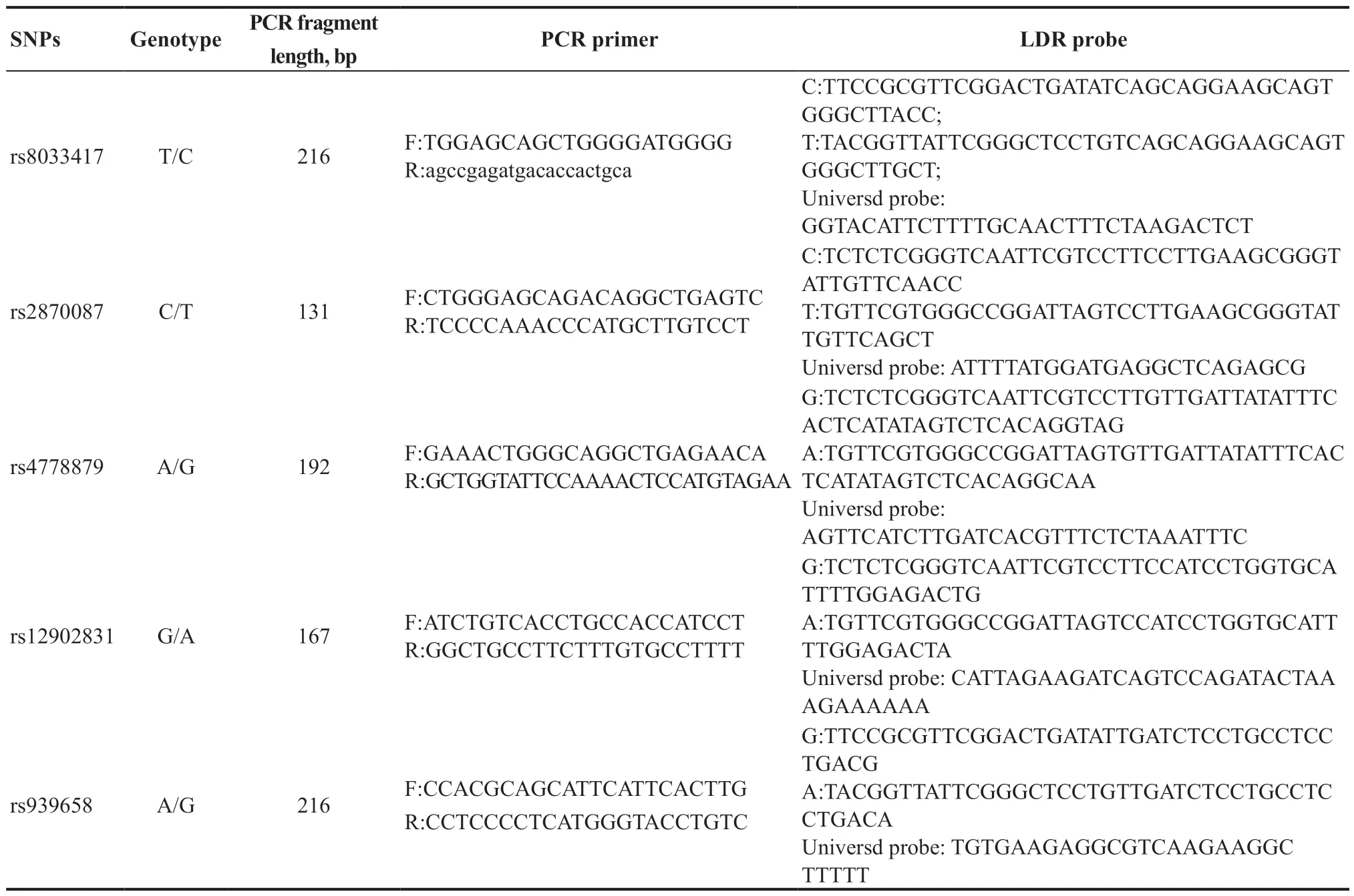
表2.RCR引物和LDR探针Table 2.RCR primer and LDR probe
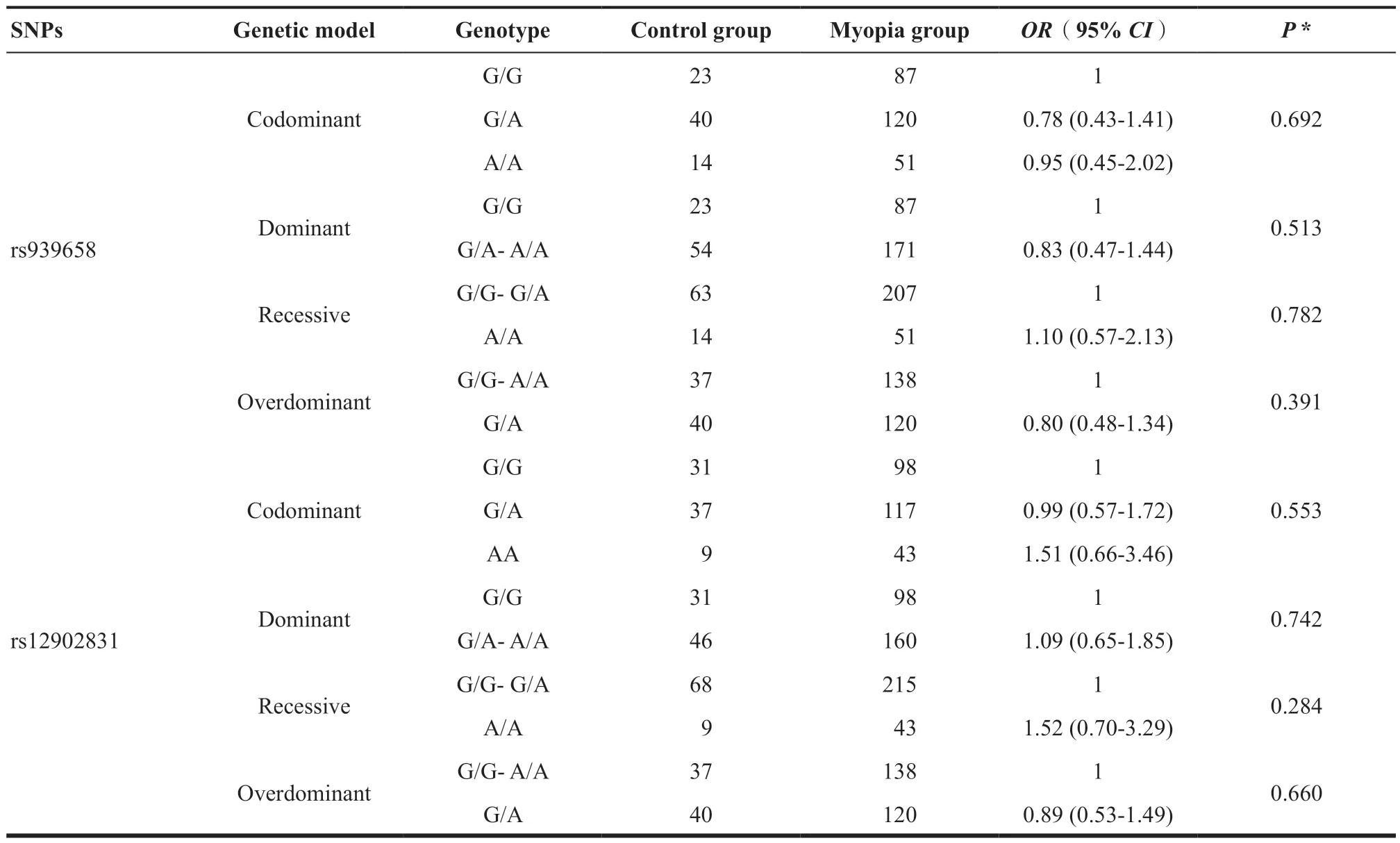
表3.RASGRF1与近视的关联分析Table 3.Association analysis of RASGRF1 and myopia
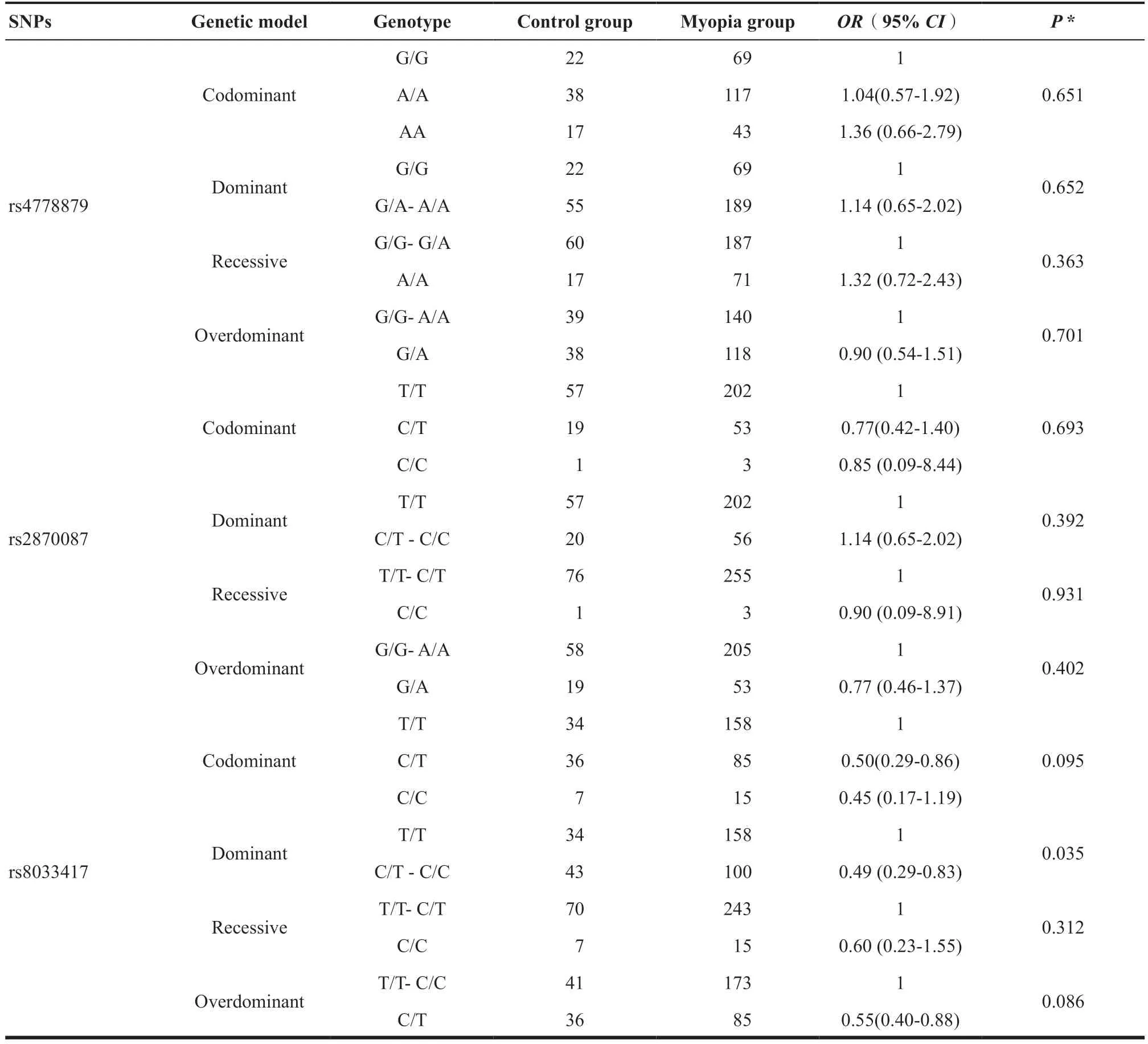
(续表)
本研究根据近视程度,分析候选SNPs与轻度近视和重度近视的相关性,未能发现候选SNP位点与轻度近视的任何相关性。在高度近视人群中,本研究发现rs8033417与高度近视的患病风险明显相关,见表4。在显性模式下,与T/T基因型比较,C/T-C/C基因型能明显降低近视的患病风险(OR
=0.48,95%CI
:0.28~0.83,P
=0.043);在加性模式下,与等位基因T比较,等位基因C能降低高度近视的作用(OR
=0.54,95%CI
:0.34~0.84,P
=0.043),但是这种相关性并不存在于其他候选SNPs中,见表5。2.3 rs8033417 T/C的生物信息学分析和功能预测
rs8033417 位于RASGRF1
的第23 内含子和长非编码RNA(Long non-coding RNA,lncRNA)基因RP11-16K12.1
(又称为LOC100129540)的下游约400 bp处(见图1)。根据ENCODE数据,rs8033417也位于候选顺式调控元件EH37E0380686中,此顺式调控元件具有H3K27ac表观修饰,且位于非色素睫状上皮细胞的DNase-I超敏感位点(见图1),因此该调控元件具有典型的增强子特征。此外,本研究结合GTEx数据进一步分析rs8033417 与基因表达的关系。GTEx的表达数量性状基因座(expression quantitative trait loci,eQTL)数据显示,在人小脑组织中rs8033417与lncRNA
基因RP11-16K12.1
的表达具有显著相关性。与rs8033417T/T和T/C基因型相比,rs8033417C/C基因型与RP11-16K12.1
高水平的mRNA相关(P
=4.63×10-6),但是这种相关性不存在于RASGRF1
基因中(P
=0.474) (见图2)。RP11-16K12.1
转录本长度有1.9kb(ENST00000316148.4),转录方向与RASGRF1
方向相反,属于反义lncRNA。结合关联分析结果,本研究推测rs8033417C/C很可能通过促进lncRNARP11-16K12.1的表达进而调控RASGRF1
基因的转录,从而影响甘肃人群近视的发生发展。
表4.rs8033417与高度近视和低度近视的关联分析Table 4.Correlation analysis of rs8033417 with high myopia and low myopia
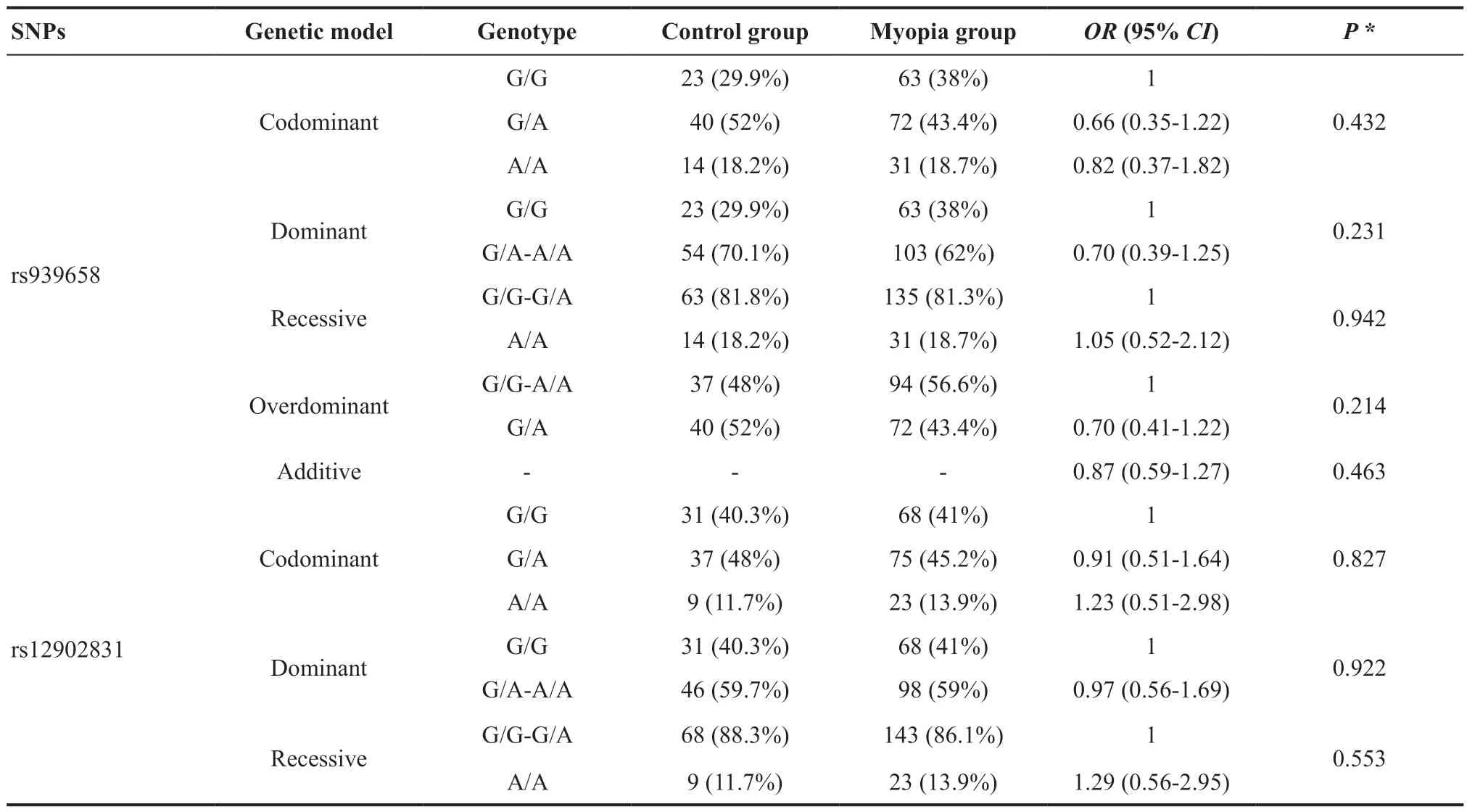
表5.其余4个SNPs与高度近视的关联分析Table 5.Correlation analysis of other 4 SNPs with high myopia
(续表)
3 讨论
RASGRF1
基因与视觉功能具有密切关系,是近视发生的易感基因。RASGRF1
缺陷可导致小鼠的光感、视觉感觉过程受损和晶状体异常。在豚鼠的近视模型中发现RASGRF1
在巩膜上表达显著上调。本研究推测RASGRF1
基因表达失调很可能是近视等视觉相关疾病发生的易感因素之一。为了寻找RASGRF1
基因中与近视发生相关的具有功能性的SNPs,本研究针对RASGRF1
候选调控元件序列中SNPs,在甘肃地区近视人群中通过病例对照研究,发现位于RASGRF1
第23 内含子的rs8033417T/C变异与近视发生显著相关,与rs8033417T等位基因比较,C等位基因能显著地降低高度近视(双眼-10.00 D<SE≤-6.00 D)的发生风险(加性模型P
=0.032,OR
=0.54,95%CI
=0.34~0.84)。本研究发现rs8033417 及其周围序列具有基因增强子特征,进一步分析发现rs8033417T/C与RASGRF1
的mRNA水平不相关,而与长链非编码RNA基因RP11-16K12.1的表达相关。尽管这种相关性是基于GTEx中人小脑组织的eQTL数据,但是有文献报道RASGRF1 在神经元细胞和视网膜等眼组织细胞中均呈高水平表达,据此推断rs8033417T/C与RP11-16K12.1表达的相关性也很可能存在于眼组织细胞中,从而影响近视的发生过程。然而,rs8033417T/C以及RP11-16K12.1与近视发生的相关性需要扩大样本以及在不同种族进行进一步验证。同时,需要通过体外和体内实验进一步研究RP11-16K12.1 是否能调控RASGRF1
基因表达从而参与近视的发生发展过程。
图1.rs8033417位于长非编码RNA基因RP11-16K12.1的顺式调控元件Figure 1.rs8033417 located in the cis-acting element of long non-coding RNA gene RP11-16K12.1.
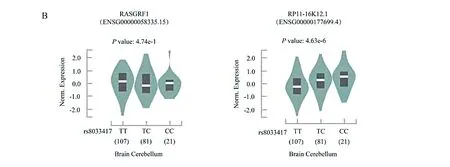
图2.rs8033417表达的相关性在人小脑组织的表达Figure 2.Correlation of rs8033417 expression in human cerebellum.
长链非编码RNA长度一般大于 200 bp,可以通过介导多种转录因子的相互作用、诱导染色质重构和核小体修饰、调控可变剪接模式、作为RNA“海绵”结合miRNA等方式参与基因转录调控、蛋白定位、细胞分化和细胞干性维持等各种细胞活动中。RP11-16K12.1转录长度为1.9 kb,位于RASGRF1
基因的反义链,与RASGRF1
转录方向相反,属于反义长链非编码RNA。甲状腺癌中发现RP11-16K12.1表达增高,其靶基因是RASGRF1
基因,目前尚未有RP11-16K12.1 功能相关的研究报道。长链非编码RNA与眼组织细胞发育、功能维持及眼部常见疾病密切相关。已有多项研究报道RNCR2、Six3OS、Vax2os1及TUG1等长链非编码RNA参与眼的发育和功能维持,它们是视网膜细胞分化、增值、凋亡的重要调控因子,并直接影响光感受器细胞的形成和视网膜的功能。常见眼部疾病的发生过程中长链非编码RNA也扮演着重要作用,如MIAT(Myocardial infarction-associated transcript)基因调控视网膜细胞的生长分化,它的表达上调与糖尿病眼病患者的视网膜病变发生密切相关;GWAS研究发现CDKN2B-AS1 与开角型青光眼和青光眼的视神经变性显著相关。鉴于RASGRF1
与近视发生的密切相关性,进一步研究RP11-16K12.1 在体内的表达模式以及调控RASGRF1
基因的分子机制,对于近视发生的分子机制具有重要作用。本研究在甘肃近视人群中,针对RASGRF1基因顺式调控元件遗传变异进行病例对照研究,发现一个位于RASGRF1
基因反义长非编码RNA附近的rs8033417T/C能显著降低高度近视的发生风险。通过分析公共表观遗传数据发现rs8033417T/C所在区域具有增强子特征,并能显著增强RP11-16K12.1的表达。本研究结果为后续RASGRF1
表达调控方式提供新的研究思路,有助于揭示近视发生的分子机制。利益冲突申明
本研究无任何利益冲突作者贡献声明
汪向利:参与课题选题、设计,数据分析及论文撰写。杨丽媛、金庸、李培强、丁韵涵:参与课题实施,收集数据及统计学分析。谢小冬:参与选题、设计及论文修改。杨君:参与课题选题、设计和论文修改并根据编辑部的意见进行核修
