蟾毒它灵逆转急性髓系白血病HL60/ADR耐药细胞的作用及机制
陈乃川,周智辉,李 宏,李媛媛,李子辉
(1.陕西中医药大学第二临床医学院,陕西 咸阳 712046; 2.陕西中医药大学第二附属医院科研科,陕西 咸阳 712000; 3.陕西中医药大学制药厂,陕西 咸阳 712083)
急性髓系白血病是一种起源于造血干细胞的恶性肿瘤,常伴有贫血、出血、发热、感染等症状。近年来,白血病的发病率逐年上升,其中急性髓系细胞白血病占70%,占小儿白血病的30%,发病年龄的中位数为65岁,也是成年人中最常见的白血病类型,其中急性早幼粒细胞白血病的患者往往更加年轻,平均年龄为44岁[1-2]。急性髓系白血病患者在接受全反式维甲酸和三氧化二砷等靶向治疗的患者中治愈率最高,60岁以下患者5年总生存率为40%,完全缓解后容易复发,复发后很少有患者能够存活超过5年[3]。目前,临床对急性髓系白血病的治疗主要采用“7+3”的治疗方式(静脉滴注阿糖胞苷7天、蒽环类药物3天),其预后主要取决于患者对药物的耐受程度和对药物的敏感性[4],长时间的化疗会大大降低患者对药物的敏感性,在后期化疗过程中必须加大药物剂量,从而逐渐演化成难治性白血病。因此,逆转肿瘤耐药对难治性白血病的治疗和预后具有重要意义。蟾酥是一种取自于中华大蟾蜍和黑眶蟾蜍的耳侧缘和皮肤腺的分泌物。目前在蟾酥中提取出119种化学成分,其中有96种蟾蜍二烯内酯单体和23种吲哚生物碱[5]。研究证实,蟾酥具有消炎止痛、抗菌抗病毒、抗肿瘤和逆转肿瘤耐药的作用[6]。蟾毒它灵是从蟾酥中提取的单体药物,研究表明,蟾毒它灵可以抑制肿瘤细胞的增殖,促进肿瘤细胞的凋亡[7-9],但其在逆转耐药方面的作用尚未见报道。本文主要探讨蟾毒它灵对急性髓系白血病HL60/ADR细胞的作用及逆转耐药的机制。实验结果表明,蟾毒它灵能够抑制HL60/ADR细胞的生长,增加HL60/ADR细胞对阿霉素的敏感性,0.01 μg/mL的蟾毒它灵处理HL60/ADR细胞24 h,能够逆转HL60/ADR细胞对阿霉素的耐药性,其机制主要是通过降低MDR1、MRP1和BCRP 3种耐药蛋白的表达水平进而逆转HL60/ADR细胞对阿霉素的耐药性。实验初步揭示了蟾毒它灵逆转白血病细胞耐药的作用及分子机制,可为蟾毒它灵逆转白血病细胞耐药,尤其是难治性白血病细胞耐药方面的相关研究提供理论依据。
1 材料
1.1 细胞系
人急性髓细胞白血病HL60细胞购于武汉普诺赛生命科技有限公司(货号:CL-0110),人急性髓细胞白血病HL60/ADR阿霉素耐药细胞于陕西省中西医结合心血管病防治重点实验室成功诱导建立并命名为HL60/ADR细胞。
1.2 药品
阿霉素(ADR,adriamycin)购于selleck公司(货号:S1208),蟾毒它灵(bufotalin)购于上海哈灵有限公司(货号:471-95-4)。
1.3 材料
急性髓细胞白血病HL60细胞基础培养基IMDM购于武汉博士德公司(货号:PYG0010),胎牛血清购于中乔新舟(货号:ZQ500-A),CCK8检测试剂盒购于北京博奥森生物技术有限公司(货号:BA00208),单克隆抗体MDR1/ABCB1(E1Y7S) Rabbit mAb、MRP1/ABCC1(D708N) Rabbit mAb、BCRP/ABCG2(D5V2K)Rabbit mAb、GAPDH(D16H11) Rabbit mAb均购自美国Cell Signaling Technology(CST)公司(货号分别为13978S、14685S、42078S、5174S),辣根过氧化物酶标记二抗购自美国Cell Signaling Technology(CST)公司(货号为7074S)。
1.4 仪器设备
CO2细胞培养箱(CLM-170B-8-NF)购自新加坡ESCO科技有限公司,台式离心机(Sorvall ST4R Plus)购自Thermo Fisher,吸收光酶标仪(800TS)购自美国BioTek,小型垂直电泳槽 (BIO-RAD1658033)购自美国BIO-RAD,电泳仪(PowerPac HV Power)购自美国BIO-RAD,化学发光成像系统(TY2021000002)购自上海贝晶生物技术有限公司。
2 研究方法
2.1 细胞培养
人急性髓细胞白血病HL60细胞培养于体积分数为80%的IMDM和体积分数为20%的胎牛血清中并加入总体积2%的青链霉素,HL60/ADR细胞系最终培养于体积分数为80%的IMDM和体积分数为20%的胎牛血清中,并加入总体积2%的青链霉素,最终在质量浓度为0.1 μg/mL的阿霉素中维持其耐药性,所有实验前去除阿霉素培养1个月。
2.2 HL60/ADR细胞的建立
HL60/ADR细胞的建立采用低质量浓度药物梯度诱导法,用质量浓度为0.001 μg/mL的阿霉素作为起始浓度诱导培养,增大培养基血清的体积分数为40%,完全培养基为体积分数为60%的IMDM和体积分数为40%的胎牛血清并加入总体积2%的青链霉素,当细胞背景中出现细胞碎片较多时,死亡率大于20%时去药培养并将细胞分成多个小瓶,待细胞生长至对数生长期时选取状态最好的一瓶细胞增大药物质量浓度培养,增大药物质量浓度后重复此步骤,质量浓度梯度分别为0.001 μg/mL、0.002 μg/mL、0.004 μg/mL、0.008 μg/mL、0.01 μg/mL、0.02 μg/mL、0.04 μg/mL、0.06 μg/mL、0.08 μg/mL、0.1 μg/mL,最终使细胞能够稳定生长在0.1 μg/mL的阿霉素中,更换完全培养基为体积分数为80%的IMDM和体积分数为20%的胎牛血清并加入总体积2%的青链霉素,总共历时3个月,命名细胞为HL60/ADR,去除阿霉素培养1个月后即可用于后续实验。
2.3 CCK8法检测HL60/ADR细胞的建立
将细胞系分为HL60和HL60/ADR 2组,HL60生长于正常培养基中,HL60/ADR生长于含有0.1 μg/mL的阿霉素培养基中,HL60/ADR去药培养1个月后,取用2种生长至对数生长期的细胞并离心,离心后加入适当量的培养基进行细胞计数,最终使细胞悬液中的细胞计数为5×103个/100 μL,总体积为9 mL。取8个15 mL无菌离心管,其中第1个离心管为对照组,其余离心管均为实验组,对照组加入1 mL细胞悬液,实验组中第1个离心管加入2 mL细胞悬液,其他离心管中均加入1 mL细胞悬液,在实验组第1个离心管中加入1 μL阿霉素,使其最终质量浓度为8 μg/mL,从实验组第1个离心管中取1 mL液体加入第2个离心管并以此类推,最后一个离心管中弃去1 mL培养液,最终实验组细胞培养液中的阿霉素质量浓度分别为8 μg/mL、4 μg/mL、2 μg/mL、1 μg/mL、0.5 μg/mL、0.25 μg/mL、0.125 μg/mL,每组取200 μL细胞培养液加入96孔板中,每组4个复孔,放入细胞培养箱中培养24 h、72 h,最终取出96孔板每个孔加入20 μL CCK8溶液,放入细胞培养箱中培养1~2 h,用酶标仪测定450 nm处的吸光度,实验重复3次并用GraphPad prism 9进行作图和统计学分析。
2.4 Western blot法检测HL60/ADR细胞株的建立
分别从培养瓶中取3 mL上述HL60和HL60/ADR细胞离心后转移到1.5 mL Eppendorp管中,加入200 μL的RIPA裂解液,在冰上裂解30 min,每隔10 min充分混匀一次,在4 ℃离心机中12 000 r/min离心15 min,取100 μL上清液用Nanodrop A280法测量蛋白浓度后加入25 μL loading buffer混匀,95 ℃煮10 min,室温冷却后置于-20 ℃环境中保存备用。取总蛋白200 μg进行Western blot上样分析,4 ℃孵一抗过夜,第2天孵二抗,采用ECL化学发光法检测目的蛋白。
2.5 CCK8法检测蟾毒它灵的逆转质量浓度
分别取用HL60和HL60/ADR并离心,加培养液重新悬浮后进行细胞计数,使细胞悬液中的细胞计数为5×103个/100 μL,与2.3中的CCK8法步骤相同,计算蟾毒它灵对HL60/ADR的IC50,并降低蟾毒它灵的质量浓度为0.1 μg/mL、0.01 μg/mL,进行HL60/ADR细胞被蟾毒它灵刺激后的存活率计算。
2.6 CCK8法检测蟾毒它灵逆转耐药的作用
取HL60/ADR细胞用0.01 μg/mL的蟾毒它灵预处理24 h,离心去除蟾毒它灵,与2.3中的CCK8法步骤相同,在24 h、72 h测出HL60/ADR细胞被质量浓度分别为8 μg/mL、4 μg/mL、2 μg/mL、1 μg/mL、0.5 μg/mL、0.25 μg/mL、0.125 μg/mL的阿霉素刺激后的存活率。
2.7 Western blot检测蟾毒它灵逆转耐药的机制
取0.01 μg/mL蟾毒它灵预处理24 h的HL60/ADR细胞离心后转移到1.5 mL Eppendorp管中,加入200 μL的RIPA裂解液,在冰上裂解30 min,每隔10 min充分混匀一次,在4 ℃离心机中12 000 r/min离心15 min,取100 μL上清液加入25 μL loading buffer,用Nanodrop A280法对蛋白浓度进行测量,于95 ℃煮10 min,室温自行冷却后置于-20 ℃环境保存备用。取总蛋白200 μg进行Western blot上样分析,4 ℃孵一抗过夜,第2天孵二抗,采用ECL化学发光法检测目的蛋白。
3 结果分析
3.1 HL60/ADR细胞的建立
采用CCK8法检测阿霉素对HL60、HL60/ADR细胞24 h、72 h生长的影响,采用Western blot法检测3种耐药蛋白MDR1、MRP1、BCRP在HL60和HL60/ADR细胞中的表达变化。
HL60和HL60/ADR细胞在不同质量浓度的阿霉素作用72 h的存活率如图1所示,将阿霉素质量浓度为0作为实验的对照组。由图1可知,在阿霉素质量浓度为0的情况下,2种细胞的生长趋势良好,存活率均为100%;在阿霉素质量浓度为8 μg/mL、4 μg/mL、2 μg/mL、1 μg/mL、0.5 μg/mL、0.25 μg/mL、0.125 μg/mL时,HL60/ADR细胞的存活率分别为14%、16%、29%、53%、68%、79%、109%,其结果显示,HL60/ADR细胞在含有0.125 μg/mL的阿霉素的培养液中生长状态良好,0.125 μg/mL的阿霉素可能对HL60/ADR细胞的生长起到了促进作用,也初步表明HL60/ADR对阿霉素有一定的耐药趋势;HL60细胞的存活率分别为4%、3%、1%、3%、15%、30%、38%,其结果显示,HL60细胞在含有0.5 μg/mL阿霉素的培养液中才开始有生长的趋势,这也提示阿霉素对于HL60细胞有很强的生长抑制作用。经过统计学分析,阿霉素对HL60细胞24 h的IC50=2.344,72 h的IC50=0.085,阿霉素对HL60/ADR细胞24 h的IC50=9.508,72 h的IC50=1.039;经计算,HL60/ADR在24 h的耐药倍数是9.508/2.344=4.06倍,在72 h的耐药倍数是1.039/0.085=12.19倍,其差异具有统计学意义(P<0.001)。综上所述,HL60和HL60/ADR 2种细胞相比较,在同等阿霉素质量浓度的刺激下,HL60/ADR细胞的存活率均大于HL60细胞的存活率(P<0.001),并且阿霉素在24 h和72 h对HL60/ADR细胞的IC50均高于HL60细胞,这说明HL60/ADR细胞对阿霉素更具耐药性,同时也说明了HL60/ADR对阿霉素耐药细胞建模的成功,为下一步蟾毒它灵逆转白血病细胞耐药实验奠定了基础。
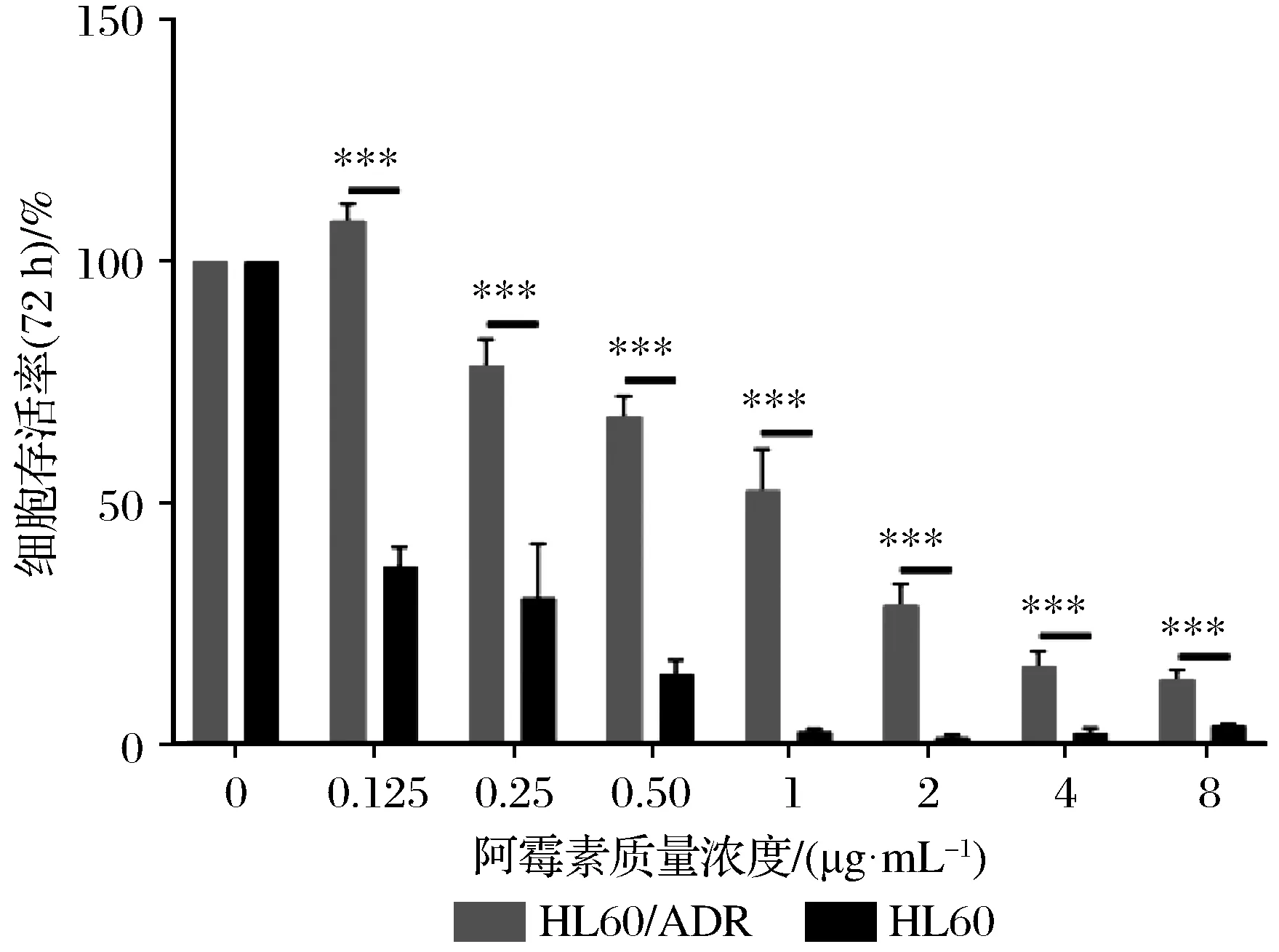
注:***表示和HL60细胞的存活率相比P<0.001。图1 阿霉素作用72 h对HL60和HL60/ADR细胞 生长的影响Fig.1 Effects of adriamycin for 72 h on the growth of HL60 and HL60/ADR cells
在图1中,阿霉素质量浓度为0.125 μg/mL刺激HL60/ADR细胞时,4次CCK8法实验结果均显示HL60/ADR细胞存活率大于100%,在显微镜下对比0和0.125 μg/mL的细胞数量时,也发现0.125 μg/mL中的细胞数量较多,且生长状态良好。HL60/ADR细胞存活率大于100%的可能原因是:(1)实验次数不够多导致的误差;(2)在阿霉素的长期刺激下,细胞已经对低浓度的阿霉素产生了药物抗性,这种低浓度的阿霉素可能会刺激HL60/ADR细胞的生长,增殖数量超过在完全培养基中的HL60/ADR细胞。
HL60和HL60/ADR细胞在采用不同质量浓度阿霉素作用24 h、72 h时的细胞形态学表现如图2所示。由图2(a)可以看出,对照组细胞状态良好,细胞胞质饱满,阿霉素处理组视野内不同阿霉素质量浓度下的细胞数量接近,但细胞形态变大,细胞内出现粗颗粒或小泡,背景中胞质颗粒和死亡细胞碎片增多,有部分细胞皱缩变小或呈现梭形。由图2(b)可以看出,在阿霉素质量浓度为0时,HL60/ADR细胞生长状态良好;在阿霉素质量浓度为8 μg/mL时,大部分细胞呈现皱缩状态,但仍能观察到一部分正常形态的细胞,随着阿霉素质量浓度的降低,HL60/ADR正常细胞所占比例和数量越来越多,说明阿霉素对HL60/ADR的生长抑制作用逐渐减弱;当阿霉素质量浓度为0.125 μg/mL时,HL60/ADR细胞数量和形态同对照组相似,这说明HL60/ADR细胞对阿霉素已经初步形成了耐药性。由图2(c)可以看出,对照组细胞状态良好,经过不同质量浓度的阿霉素刺激后,出现大量的死亡皱缩细胞,极少部分变大,背景中细胞碎片、梭形细胞数量增多。由图2(d)可以看出,在阿霉素质量浓度为0时,HL60/ADR细胞生长状态良好,偶见梭形和死亡细胞,细胞整体呈团株状生长;在阿霉素质量浓度为8 μg/mL、4 μg/mL时,细胞虽然呈现团株状生长,但整体细胞皱缩、缩小,背景中细胞碎片较多,梭形等不规则性状细胞增多,细胞整体呈现一种濒临死亡的状态;当阿霉素质量浓度为2 μg/mL、1 μg/mL时,细胞整体状态与高质量浓度相比有好转现象,但背景中仍有很多细胞碎片和不规则形态细胞;当阿霉素质量浓度为0.5 μg/mL、0.25 μg/mL、0.125 μg/mL时,细胞的形态逐渐恢复为对照组细胞形态,细胞形态大小正常且胞质饱满,随着阿霉素质量浓度的降低,正常HL60/ADR细胞的数量逐渐增多,且在0.125 μg/mL时细胞数量大于对照组细胞数量,这说明在阿霉素质量浓度为0.125 μg/mL时可能刺激了HL60/ADR细胞的增值,也初步说明了HL60/ADR对阿霉素已经产生了耐药性。
对比图2(a)和图2(c)发现,HL60细胞在阿霉素的作用下,72 h的细胞数量较24 h的细胞数量明显减少,且皱缩死亡和细胞碎片的数量明显增加,实验结果表明随着阿霉素作用时间的增长,对HL60细胞形态的影响程度越大。对比图2(b)和图2(d)发现,72 h实验组的细胞数量较对照组相对减少,且在8 μg/mL的阿霉素作用下,72 h的皱缩细胞和死亡细胞碎片数量相对于24 h数量显著增多。结果表明,随着阿霉素作用时间的延长,对HL60/ADR细胞的形态学影响越大。对比图2(a)和图2(b)、图2(c)和图2(d)发现,阿霉素处理2种细胞的时间相同时,HL60/ADR细胞形态较HL60细胞好,数量较HL60细胞多。结果表明,阿霉素处理时间相同时,与HL60细胞相比,阿霉素对HL60/ADR细胞的形态学影响较小。
阿霉素诱导HL60细胞耐药的镜下形态学的变化如图3所示。由图3(a)可以看出HL60细胞的形态学表现,HL60细胞呈圆形或椭圆形,细胞形态较大,胞质饱满,生长分散,不易呈团,背景干净。图3(b)表示在加入一定质量浓度的阿霉素的建模过程中,细胞处于HL60和HL60/ADR细胞的中间形态,此时细胞生长分散,细胞较HL60细胞大,细胞内充满小颗粒,有的细胞中有气泡状物质,背景出现大小不一的死亡细胞碎片,少部分细胞呈现梭状;这也表明了在建模过程中,由于HL60细胞不断受到来自阿霉素的刺激,呈现一种濒临死亡的生长状态,此时要停止加药,分瓶生长,增大血清浓度和营养条件,使很少的一部分能够存活的耐药细胞得以继续增殖,以减少死亡细胞的比例,从而达到逐步分离此类死亡细胞的效果。图3(c)表示建模成功后HL60/ADR的细胞形态表现,相对于最初对阿霉素敏感的HL60细胞来说,HL60/ADR细胞胞体较小,胞质饱满,呈现团株状生长,背景较为干净,偶见梭形细胞,胞内颗粒物质相对较多。综上所述,图3主要展现了HL60/ADR建模过程中的细胞形态学变化,可为建立其他多药耐药细胞模型提供参考。
MDR1、MRP1、BCRP是3种常见的肿瘤细胞耐药蛋白,研究表明,3种蛋白均参与了多药耐药肿瘤细胞的耐药过程。实验在成功建立HL60/ADR细胞模型的基础上,在相同的培养条件下直接提取HL60和HL60/ADR细胞的蛋白进行Western blot实验检测,3种蛋白在HL60和HL60/ADR细胞中的表达变化如图4所示。由图4(a)可知,HL60细胞几乎不表达耐药蛋白MDR1,而HL60/ADR细胞大量表达MDR1蛋白。由图4(b)、图4(c)可知,HL60细胞中表达的MRP1和BCRP蛋白水平较低,但HL60/ADR细胞中的MRP1和BCRP蛋白表达水平显著增加。以上实验结果说明了3种耐药蛋白在建立HL60/ADR细胞耐药模型的过程中起到了重要作用,其耐药机制可能是通过增加耐药蛋白MDR1、MRP1、BCRP的表达水平使HL60/ADR细胞对阿霉素产生耐药。综上所述,采用阿霉素诱导HL60细胞可成功建立HL60/ADR细胞耐药模型。
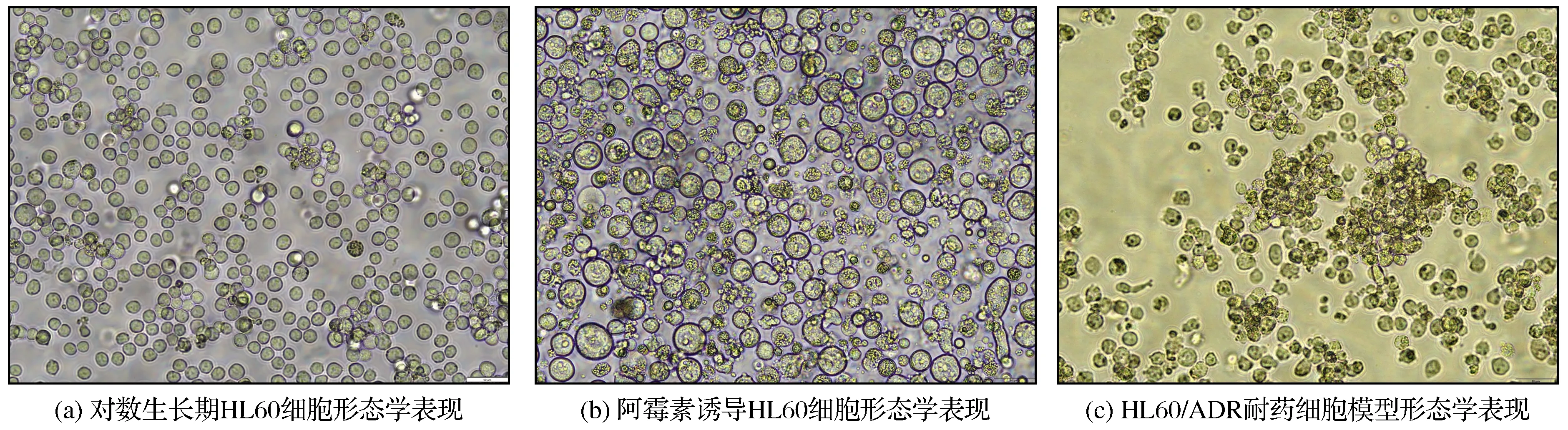
图3 阿霉素诱导HL60细胞耐药的镜下形态学变化Fig.3 Microscopic morphological changes of adriamycin-induced HL60 cells drug resistance
3.2 蟾毒它灵对HL60/ADR细胞的作用
采用CCK8法检测HL60/ADR细胞对作用72 h蟾毒它灵的敏感性,结果如图5所示。蟾毒它灵质量浓度为8 μg/mL、4 μg/mL、2 μg/mL、1 μg/mL、0.5 μg/mL、0.25 μg/mL、0.125 μg/mL时,HL60/ADR细胞的存活率分别为14%、16%、33%、59%、73%、84%、99%,蟾毒它灵对HL60/ADR细胞72 h的IC50=0.624 9 μg/mL,结果表明,当蟾毒它灵质量浓度大于0.5 μg/mL时,对HL60/ADR的生长抑制作用较强,当蟾毒它灵质量浓度为0.125 μg/mL时,对HL60/ADR的存活率几乎没有影响。上述结果提示,蟾毒它灵诱导的HL60/ADR细胞死亡具有质量浓度依赖性。
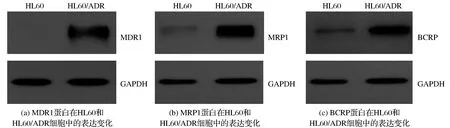
图4 MDR1、MRP1、BCRP蛋白在HL60和HL60/ADR细胞中的表达变化Fig.4 The expression changes of MDR1,MRP1 and BCRP in HL60 and HL60/ADR cells changes
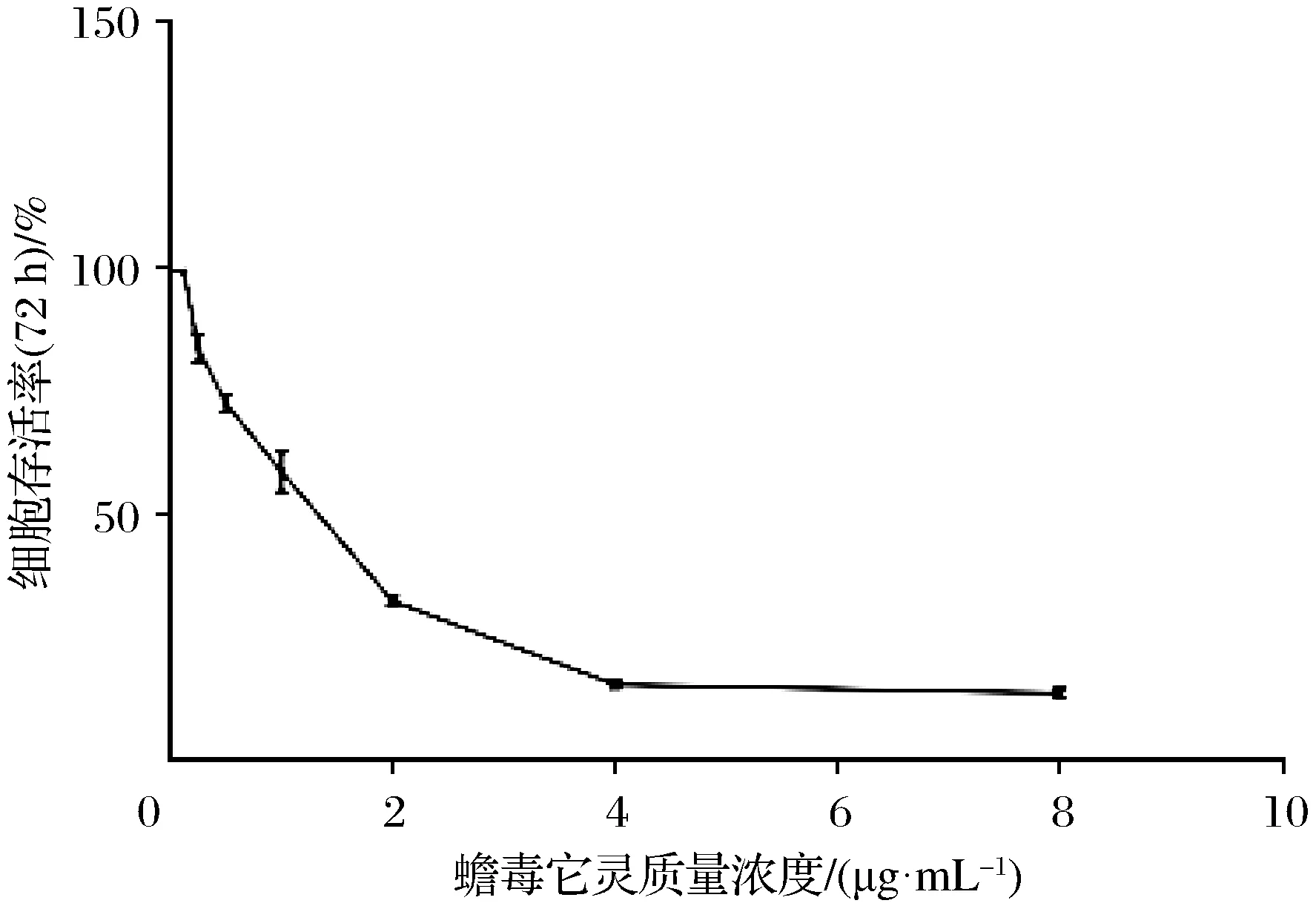
图5 采用CCK8法检测蟾毒它灵对HL60/ADR细胞 生长的影响Fig.5 The effect of bufotalin on the growth of HL60/ADR cells detected by CCK8 assay
不同质量浓度的蟾毒它灵刺激HL60/ADR细胞24 h的形态学表现如图6(a)所示,蟾毒它灵对HL60/ADR细胞刺激24 h,对照组细胞生长状态良好,细胞呈团株状生长,在加入蟾毒它灵刺激后,各组细胞形态稍有皱缩、变小,但变化不明显,细胞较对照组更具有平面感,有少部分细胞呈现梭形,出现少量细胞碎片。不同质量浓度的蟾毒它灵刺激HL60/ADR细胞72 h的形态学表现如图6(b)所示,蟾毒它灵对HL60/ADR细胞刺激72 h,对照组细胞生长良好,呈团株状生长,细胞质饱满,相比对照组,蟾毒它灵刺激的各个分组的细胞均明显皱缩变小,细胞背景中细胞碎片增多,细胞中开始出现颗粒物质,但细胞数量较对照组并未明显减少。对比图6(a)和图6(b)发现,蟾毒它灵作用的时间越长、质量浓度越高,对于HL60/ADR细胞形态的影响越大。
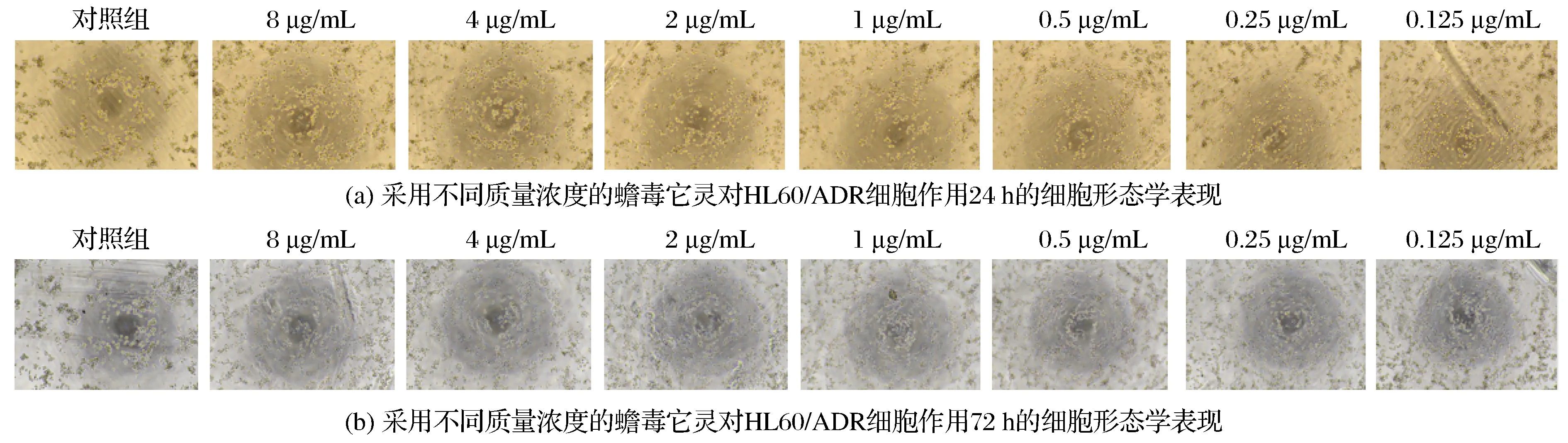
图6 蟾毒它灵影响HL60/ADR细胞生长的形态学表现Fig.6 Morphological manifestations of the effects of bufotalin on HL60/ADR cell growth
进一步通过CCK8法检测,当采用0.01 μg/mL的蟾毒它灵刺激HL60/ADR细胞时,其存活率大于99%。选用0.01 μg/mL的蟾毒它灵预处理HL60/ADR细胞24 h,采用CCK8法检测HL60/ADR细胞对阿霉素的敏感性,CCK8法检测结果显示,24 h HL60/ADR细胞对阿霉素的IC50=1.572,72 h HL60/ADR细胞对阿霉素的IC50=0.264 9,经计算,HL60/ADR细胞经过0.01 μg/mL的蟾毒它灵刺激24 h,对HL60/ADR细胞24 h的逆转倍数是9.508/1.572=6.04倍,72 h的逆转倍数是1.039/0.264 9=3.92倍。以上结果表明,蟾毒它灵对HL60/ADR细胞24 h的逆转倍数高于72 h的逆转倍数,因此后续逆转HL60/ADR细胞耐药机制研究采用0.01 μg/mL的蟾毒它灵刺激HL60/ADR细胞24 h。
3.3 蟾毒它灵对HL60/ADR细胞耐药蛋白的影响
经0.01 μg/mL蟾毒它灵对HL60/ADR细胞处理24 h后,采用Western blot法检测MDR1、MRP1、BCRP蛋白的表达水平。蟾毒它灵对HL60/ADR细胞MDR1、MRP1、BCRP蛋白表达水平的影响如图7所示。由图7(a)可知,与未经蟾毒它灵处理的HL60/ADR细胞相比,采用0.01 μg/mL蟾毒它灵刺激HL60/ADR 细胞后,HL60/ADR 细胞中MDR1蛋白的表达水平明显降低。由图7(b)可知,经过0.01 μg/mL蟾毒它灵刺激后,HL60/ADR中MRP1蛋白的表达水平也呈下降趋势。由图7(c)可知,0.01 μg/mL蟾毒它灵刺激HL60/ADR细胞24 h后,HL60/ADR细胞中BCRP蛋白的表达水平显著下降。以上结果表明,经0.01 μg/mL蟾毒它灵对HL60/ADR细胞处理24 h后,能够显著降低3种耐药蛋白MDR1、MRP1和BCRP的表达水平,证明蟾毒它灵能够通过降低耐药细胞3种耐药蛋白来逆转HL60/ADR细胞的耐药性,增加HL60/ADR细胞对阿霉素的敏感性,从而初步揭示了蟾毒它灵逆转白血病细胞耐药的分子机制。该研究结果可为深入探讨蟾毒它灵逆转肿瘤细胞耐药的作用及分子机制提供实验依据。
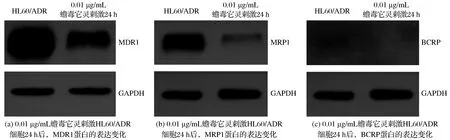
图7 蟾毒它灵对HL60/ADR细胞MDR1、MRP1、BCRP蛋白表达水平的影响Fig.7 Effects of bufotalin on expression levels of MDR1,MRP1 and BCRP in HL60/ADR cells
4 讨论
随着各种化疗药物的使用,癌细胞对药物的敏感性降低,白血病逐渐演化成难治性白血病,这也对临床研制逆转剂和发现新药产生了新的需求,研究各种难治性白血病耐药机制也成为一个热点话题。ABC转运蛋白是最经典的癌细胞耐药机制之一。目前研究发现,ABC转运蛋白家族中有48个成员,MDR1又称P-gp蛋白,属于ABC转运蛋白中的ABCB1,在人类多种组织中表达,能够主动运输有害物质来保护细胞的生长[10],它在人类肿瘤耐药过程中是最常见的一种蛋白,经过化疗药物的刺激,癌细胞通过MDR1的过表达来主动排出细胞内的药物,导致血液中的化疗药物很难进入到细胞内致使化疗敏感株细胞逐渐演变成耐药株,进而演化为难治性肿瘤。MRP1属于ABCC1家族的转运蛋白,表达于大多数组织中,还存在于内质网和内吞小泡中,在需要的时候可以迅速表达于细胞表面。研究表明,MRP1大量表达于急性髓系白血病细胞中,MRP1蛋白表达阴性的癌症患者生存率增加[11]。BCRP为乳腺癌耐药蛋白,因为它首先发现于乳腺癌细胞中,属于ABCG2转运蛋白家族成员。在人类中,ABCG2广泛表达于多种组织中,BCRP能够识别多种带正电荷和负电荷的物质,如阿霉素这一类药物[12-13],在多种肿瘤中高表达,能够介导多种肿瘤细胞发生多药耐药现象,增加了化疗的难度。
蟾酥来源于蟾蜍,《本草纲目》中有记载:“蟾酥即蟾蜍,眉间内有白汁者是也,味辛气温,有毒”。 蟾酥对于疳积、口疮、破伤风、痔疾等多种疾病均有效。蟾毒它灵是蟾酥中提取的一种单体成分,分子式为C26H36O6。研究发现,蟾毒它灵能够诱导多药耐药的肝癌细胞凋亡[4],通过调节Bax/Bcl-2、caspase-3/-9的水平来诱导A375细胞的凋亡[15],通过激活内质网,诱导CHOP、IRE1、PERK显著抑制成骨细胞瘤的增殖并诱导细胞凋亡[6]。实验的主要目的是阐明蟾毒它灵逆转HL60/ADR细胞的作用及机制。采用阿霉素低质量浓度梯度逐步诱导HL60细胞的方法,建立HL60/ADR耐药模型,结果发现MDR1、MRP1和BCRP 3种耐药相关蛋白的表达水平均明显增高。采用蟾毒它灵对耐药细胞进行处理,结果显示,蟾毒它灵对耐药细胞有很强的抑制作用,0.01 μg/mL的蟾毒它灵预处理HL60/ADR细胞24 h后,发现HL60/ADR细胞对阿霉素的耐受性明显降低,且24 h的逆转耐药倍数最高、效果最明显,MDR1、MRP1和BCRP 3种耐药相关蛋白的表达水平均明显下降。实验结果表明,蟾毒它灵不仅能够抑制HL60/ADR细胞的生长,也能够逆转HL60/ADR细胞的耐药,可为蟾毒它灵逆转白血病细胞耐药,尤其是难治性白血病细胞耐药方面的相关研究提供理论依据。

