富含丝氨酸和精氨酸的剪接因子1、转录因子7类似物2在胃癌组织中的表达及与化疗药物耐药性的关系△
梁倩萍,褚菲菲
郑州大学附属郑州中心医院消化内科,郑州 450000
胃癌是临床常见的恶性肿瘤,其发病率和病死率均较高,由于胃癌早期无明显特异性症状,部分患者就诊时已处于胃癌晚期,错过了最佳的手术时间,因此对于晚期胃癌患者多采用化疗,但目前仍缺乏特异性的生物标志物和靶向治疗药物,使得胃癌患者治疗预后较差,患者生存期较短[1-3]。化疗药物是胃癌新辅助化疗和进展期胃癌姑息治疗的常见药物,但肿瘤细胞存在耐药性,特别是肿瘤多药耐药,会严重影响化疗效果[4-5]。因此,改善胃癌化疗药物敏感性,提高化疗治疗效果成为胃癌临床治疗的研究热点。富含丝氨酸和精氨酸的剪接因子1(serine and arginine rich splicing factor 1,SRSF1)作为一种原癌蛋白,在白血病、乳腺癌等恶性肿瘤中均呈高表达[6]。有研究显示,转录因子7类似物2(transcription factor 7 like 2,TCF7L2)是参与WNT通路的关键下游靶基因,而WNT通路在胚胎发育和成体干细胞中具有关键作用,其在乳腺癌、结肠癌等多种肿瘤细胞中呈现活化状态[7-8]。但有关SRSF1和TCF7L2在胃癌中表达情况的研究较少。基于此,本研究以胃癌患者作为研究对象,探讨SRSF1、TCF7L2在胃癌组织中的表达及与化疗药物耐药性的关系,现报道如下。
1 资料与方法
1.1 一般资料
收集2019年4月至2021年5月于郑州大学附属郑州中心医院就诊的胃癌患者的病历资料。纳入标准:①术前未进行放疗、化疗或免疫治疗;②术前经血液学及影像学检查排除其他恶性肿瘤疾病;③经病理检查诊断为胃癌且可耐受手术。排除标准:①有严重的肝肾损伤或凝血功能异常;②有严重认知功能障碍。根据纳入、排除标准,共纳入120例胃癌患者,年龄40~85岁,平均(69.26±7.32)岁;男性63例,女性57例;TNM分期:Ⅰ~Ⅱ期69例,Ⅲ~Ⅳ期51例;淋巴结转移47例,淋巴结未转移73例。本研究经医院伦理委员会审批通过,所有患者均知情同意并签署知情同意书。
1.2 检测方法
对所有患者行胃癌切除术,在无菌环境下取患者肿瘤标本并在距离肿瘤边缘50 mm外的位置留取癌旁组织标本,应用生理盐水清洗组织后剔除标本周围的脂肪组织。选取边缘生长良好无坏死的肿瘤组织小块,剪碎后过滤制成细胞悬液。调整细胞密度并进行培养后应用台盼蓝进行计数,将细胞悬液加至每孔190 μl的96孔培养板上进行培养,分别设置只加入培养液的空白组、只加入细胞悬液的对照组和实验组。实验组分别加入10 μl化疗药物,分别为顺铂、卡铂、紫杉醇、多西他赛、多柔比星、环磷酰胺。每组均设置4个复孔。在5% CO2、37℃培养箱中培养24 h,在培养过程中进行稀释,最终浓度应为人体血浆浓度1 μg/ml。再继续培养48 h后加入20 μl四甲基偶氮唑蓝(methyl thiazolyl terazolium,MTT)试剂,继续培养4 h后再加入150 μl二甲基亚砜(dimethyl sulfoxide,DMSO),充分振荡使结晶物充分溶解,再应用酶标仪读取各孔490 nm处的吸光度值。采用Western blot法检测患者胃癌组织中SRSF1和TCF7L2蛋白表达量。参照试剂盒说明书提取组织总蛋白并测定蛋白浓度,以β-action作为内参计算蛋白相对表达量。对标本进行切片后应用抗兔二抗进行染色,用磷酸盐缓冲液(phosphate buffered solution,PBS)洗后显色后用苏木精复染,在光镜下观察染色强度。染色强度:黄色、棕黄色、棕褐色分别计1、2、3分。在高倍视野下观察阳性细胞所占比例,阳性细胞所占比例<5%计0分,5%~25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分。将染色强度评分和阳性细胞所占比例评分相乘:0分(-),1~4分(+),5~8分(++),9~12分(+++)。
1.3 观察指标
①比较胃癌组织和癌旁组织中SRSF1、TCF7L2相对表达量。②比较不同临床特征患者SRSF1和TCF7L2表达情况。③分析胃癌组织中SRSF1、TCF7L2表达强度与化疗药物敏感性的关系。药物抑制率=(对照组吸光度值-实验组吸光度值)(/对照组吸光度值-空白组吸光度值)×100%。药物抑制率<30%为耐药,30%~50%为低敏,51%~70%为中敏,>70%为高敏。
1.4 统计学方法
采用SPSS 22.0软件进行数据统计。符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数及率(%)表示,组间比较采用χ2检验。等级资料的比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织及癌旁组织中SRSF 1、TCF 7 L2相对表达量的比较
胃癌组织中SRSF1、TCF7L2相对表达量均明显高于癌旁组织,差异均有统计学意义(P<0.01)。(表1)
表1 胃癌组织及癌旁组织中SRSF 1、TCF 7 L2相对表达量的比较(±s)
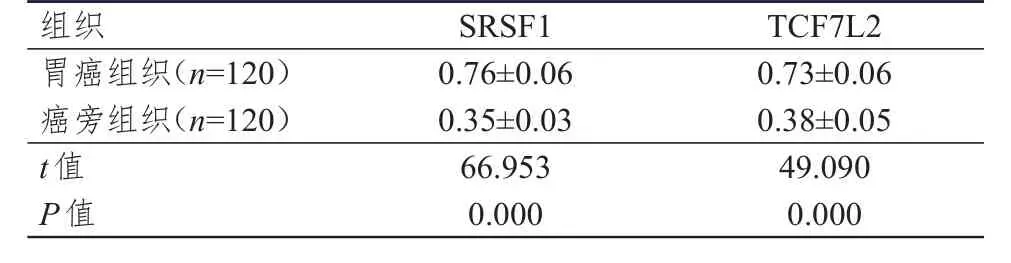
表1 胃癌组织及癌旁组织中SRSF 1、TCF 7 L2相对表达量的比较(±s)
组织胃癌组织(n=120)癌旁组织(n=120)t值P值0.76±0.06 0.35±0.03 66.953 0.000 0.73±0.06 0.38±0.05 49.090 0.000 SRSF1TCF7L2
2.2 不同临床特征胃癌患者胃癌组织中SRSF 1、TCF 7L2表达情况的比较
不同性别、年龄和肿瘤直径胃癌患者的胃癌组织中SRSF1、TCF7L2表达情况比较,差异均无统计学意义(P>0.05);不同分化程度、TNM分期及淋巴结转移情况胃癌患者的胃癌组织中SRSF1、TCF7L2表达情况比较,差异均有统计学意义(P<0.05)。(表2)

表2 不同临床特征胃癌患者胃癌组织中SRSF 1、TCF 7 L 2表达情况的比较( n=120)
2.3 胃癌组织中SRSF 1、TCF7L2表达情况与化疗药物敏感性的关系
不同顺铂、紫杉醇、多西他赛和环磷酰胺耐药情况的胃癌患者胃癌组织中SRSF1、TCF7L2表达情况比较,差异均有统计学意义(P<0.05)。(表3)

表3 胃癌组织中SRSF 1、TCF7 L2表达情况与化疗药物敏感性的关系
3 讨论
胃癌作为临床常见疾病,由于缺乏特异性临床症状,多数患者在早期阶段难以有效诊断,胃癌的常规治疗手段多为手术、化疗和放疗[9-10]。由于多数患者在就诊时已表现为转移性胃癌或局部晚期,手术治疗后复发可能性高达60%,患者预后较差,术后生存期较短[11-12]。因此,化疗仍是胃癌患者临床治疗的重要手段。化疗药物在胃癌化疗方案中具有重要地位,该类药物可将肿瘤细胞的DNA作为靶分子,通过与肿瘤细胞DNA结合来破坏肿瘤细胞DNA的复制从而起到抗肿瘤的作用[13-14]。但随着化疗药物的广泛应用,肿瘤细胞的耐药现象使肿瘤的化疗效果受到严重影响,甚至导致化疗失败[15-16]。因此,为有效改善胃癌患者化疗效果,寻找与化疗耐药性相关的分子标志物具有重要意义。
本研究结果显示,胃癌患者胃癌组织中SRSF1、TCF7L2相对表达量均明显高于癌旁组织,差异均有统计学意义。表明在胃癌患者胃癌组织中SRSF1、TCF7L2呈异常高表达,这与既往研究结果基本一致[17]。既往研究表明,SRSF1过表达可能是引起肿瘤发生发展的重要原因[18]。已有研究表明,SRSF1可参与多种复杂的化学生物通路,通过对前体mRNA进行选择性剪接加工,从而控制下游蛋白表达和功能发挥[19]。因此,SRSF1可调节细胞的凋亡程序,而细胞的凋亡抑制则与肿瘤迅速的发生、发展具有重要联系。已有研究表明,TCF7L2在肠癌和胰腺癌等肿瘤中具有重要作用,TCF7L2是WNT信号通路的重要转录复合物,而WNT信号通路在胃肠道肿瘤的发生发展中具有重要作用[20]。因此。TCF7L2的表达与胃癌患者肿瘤发展具有相关性。本研究进一步表明,不同性别、年龄和肿瘤直径胃癌患者的胃癌组织中SRSF1、TCF7L2表达情况比较,差异均无统计学意义;不同分化程度、TNM分期及淋巴结转移情况胃癌患者的胃癌组织中SRSF1、TCF7L2表达情况比较,差异均有统计学意义。表明胃癌组织中SRSF1、TCF7L2高表达可能对胃癌发生、发展产生促进作用。药敏实验结果显示,不同顺铂、紫杉醇、多西他赛和环磷酰胺耐药情况的胃癌患者胃癌组织中SRSF1、TCF7L2表达情况比较,差异均有统计学意义。表明胃癌组织中SRSF1、TCF7L2的表达情况可能与患者对化疗药物产生的耐药性有关。这可能与SRSF1异常高表达可促进下游细胞凋亡抑制基因表达,从而引起肿瘤细胞增殖,而TCF7L2异常高表达引起下游肿瘤细胞干性标志物基因过表达,从而引起肿瘤细胞对化疗药物的耐受作用有关,但其确切机制目前尚未明确,仍需进行下一步深入研究。
综上所述,胃癌患者胃癌组织中SRSF1和TCF7L2呈异常高表达,SRSF1和TCF7L2高表达可能是胃癌患者对化疗药物产生耐药性的重要原因。

