宁夏银川地区番茄斑萎病毒和南方番茄病毒复合侵染分子鉴定
康华军 李建设 高艳明 史 娟 石延霞 谢学文 李 磊 范腾飞 李宝聚* 柴阿丽*
(1 中国农业科学院蔬菜花卉研究所,北京 100081;2 宁夏大学,宁夏银川 750021;3 甘肃农业大学,甘肃兰州 730070)
宁夏地处我国西北地区东部,黄河上中游,地势南高北低,呈阶梯状下降,平均海拔1 000 m 以上。区内日照时间长,光能资源丰富,昼夜温差大,灌溉便利,适宜发展设施蔬菜。番茄()原产于南美洲,为茄科一年生或多年生草本植物。番茄果实富含胡萝卜素、维生素、番茄红素、钾等营养物质,能减少心脏病发作,可抗癌防癌,降低血压,延缓衰老,防治动脉硬化等。因其营养丰富,而且具有保健功能,已成为世界上最重要的蔬菜作物之一(夏冬,2014)。目前,宁夏已经成为我国重要的设施番茄生产基地,其栽培面积约占宁夏设施蔬菜总面积的26.5%(沙龙 等,2013)。随着番茄栽培面积的不断扩大,病害的发生范围也越来越广,严重阻碍了番茄的正常生产。
番茄病毒病是影响番茄安全生产的重要限制因素,已发现可以侵染番茄的病毒至少有136 种(Xu et al.,2017)。目前,已报道的侵染我国番茄的常见病毒有20 多种,如番茄褪绿病毒(tomato chlorosis virus,ToCV)、番茄斑驳花叶病毒(tomato mottle mosaic virus,ToMMV)、番茄花叶病毒(tomato mosaic virus,ToMV)等(刘勇 等,2019)。2011年,宁夏银川市园艺产业园首次发现番茄黄化曲叶病毒(tomato yellow leaf curl virus,TYLCV)(沙龙等,2013),2016 年石嘴山市发生了番茄斑萎病毒病(tomato spotted wilt virus,TSWV)(曹金强 等,2016)。许多病毒在侵染番茄后表现出类似的症状,且田间也经常发生多种病毒复合侵染的现象,因此难以通过肉眼观察判断病毒的种类。近些年分子生物学方法以其快速、灵敏、准确的优点,已经被广泛地用于植物病毒的鉴定和诊断。
本试验对在宁夏银川地区采集到的番茄病毒病样本进行分子生物学鉴定,以明确引起宁夏番茄病毒病的病毒种类,为有针对性地防控该病害的发生提供科学依据。
1 材料与方法
1.1 试验材料
2021 年8 月,在宁夏银川地区设施番茄生产基地调查了番茄病毒病发生情况,采集10 份番茄植株茎秆、叶柄和未成熟果实带有褐色病斑等症状的植物样本,分别装在干净的采集袋中,置于冰上运回实验室,保存于-80 ℃冰箱。
植物总RNA 提取试剂:Trizol、氯仿∶异戊醇(24∶1)、异丙醇、75%乙醇、反转录试剂盒PrimeScript ™ Ⅱ 1st Strand cDNA Synthesis Kit〔购自宝日医生物技术(北京)有限公司〕、2×Master Mix(Dye Plus)(购自南京诺唯赞生物科技股份有限公司)。
1.2 供试引物
本试验所使用番茄病毒病分子检测特异性引物共23 对,引物信息见表1。
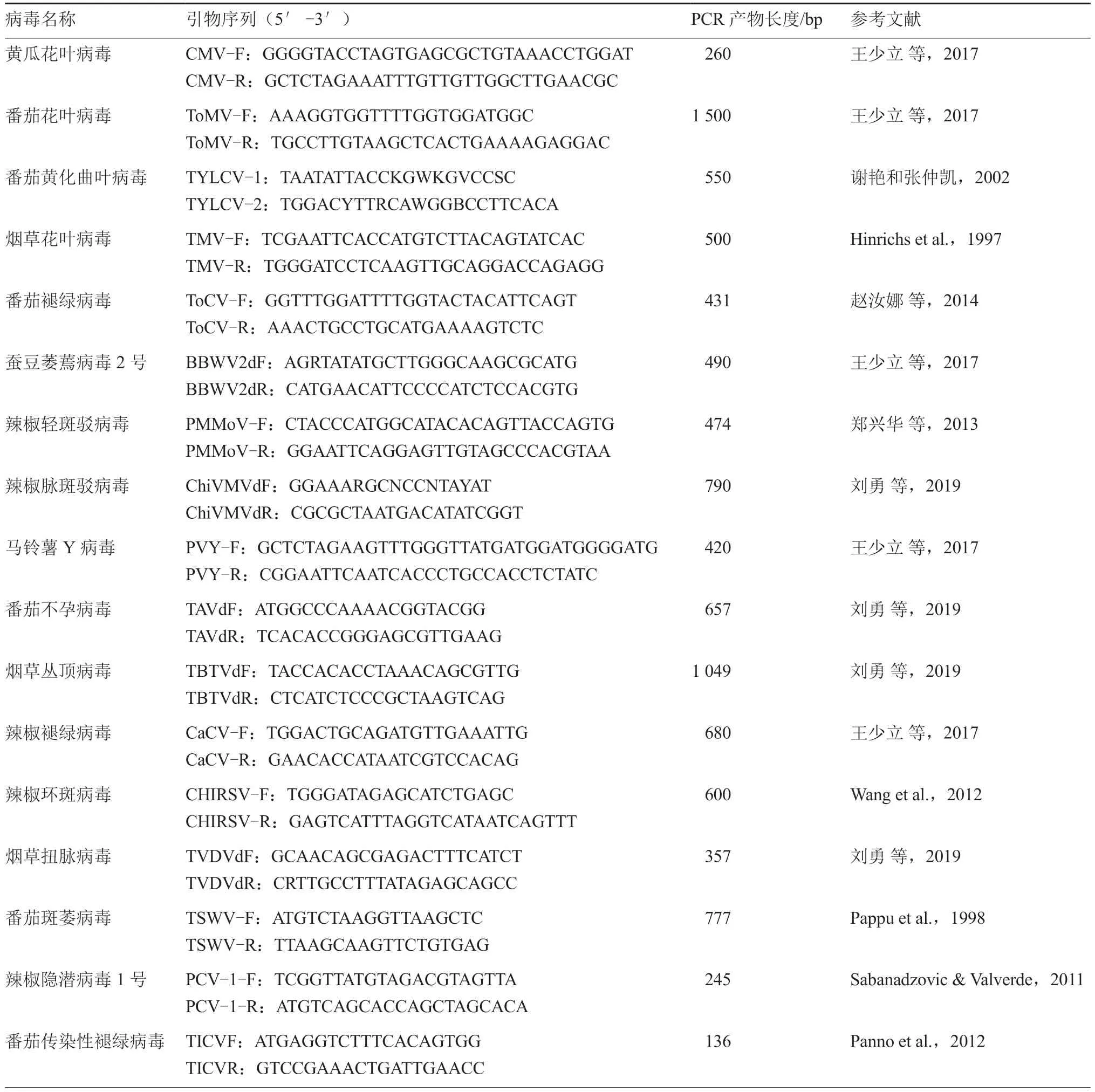
表1 番茄病毒病分子检测的引物信息
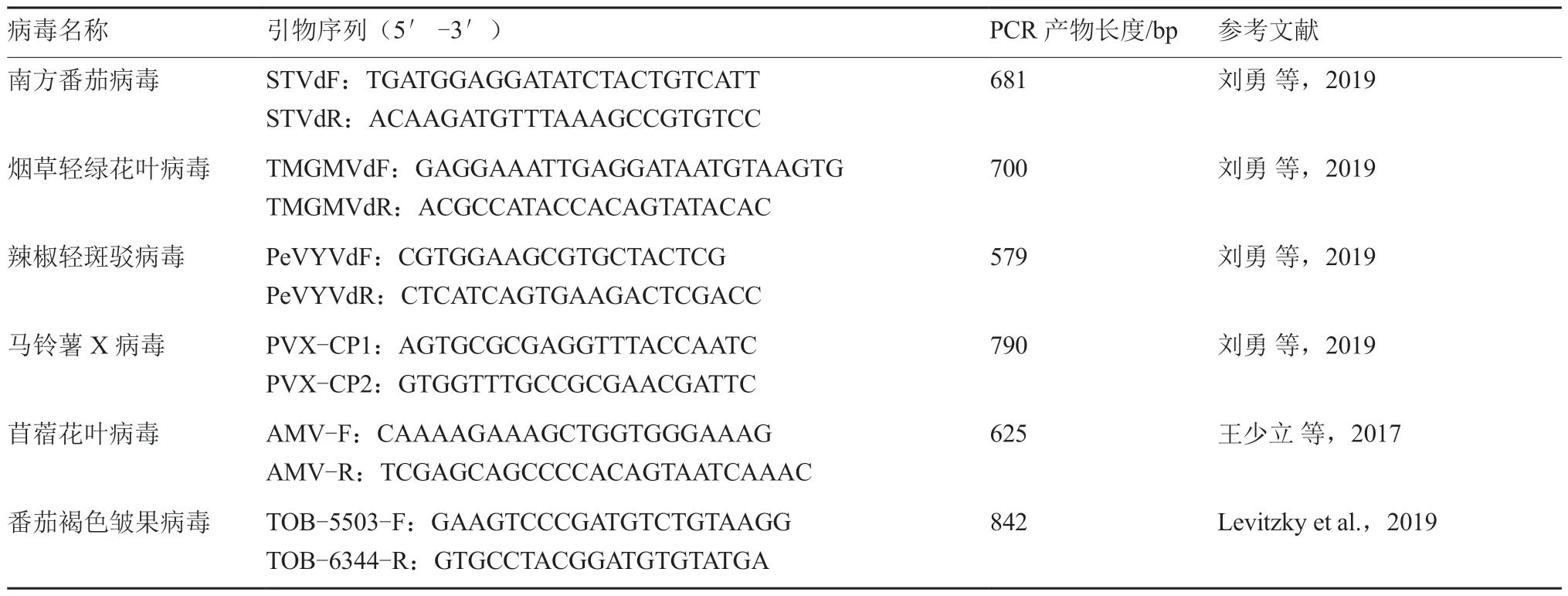
续表
1.3 植物总RNA 提取及反转录
取发病的叶柄、茎秆和果实样本,加液氮研磨成粉末状,转移至1.5 mL 离心管中,加入1 mL Trizol,充分混匀;4 ℃、12 000 r·min离心5 min,取上清液移入另一个1.5 mL 离心管中;加入1/5 体积氯仿∶异戊醇(24∶1),充分混匀;4℃、12 000 r·min离心10 min,取上清液移入另一个1.5 mL 离心管中;加入等体积异丙醇,充分混匀;4 ℃、12 000 r·min离心10 min,倒掉上清液保留沉淀;用1 mL 75%乙醇漂洗,4 ℃、8 000 r·min离心10 min,倒掉上清液保留沉淀;晾干后,加入ddHO 50 μL。RNA 经定量后放入-80 ℃冰箱保存,备用。
以番茄感病样本总RNA 为模板,使用PrimeScriptⅡ 1st Strand cDNA Synthesis Kit 试剂盒进行反转录。
1.4 RT-PCR 检测
将反转录得到的cDNA 分别利用番茄常见病毒病特异性引物(表1)进行检测。PCR 反应体系(20 μL):各0.5 μL 上、下游引物,1 μL模板cDNA,10 μL 2×Master Mix(Dye Plus),ddHO 补足20 μL。反应条件:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35 个循环;72 ℃延伸5 min。1.5%琼脂糖凝胶电泳检测PCR 产物。将PCR 产物送至博迈德基因技术有限公司(北京)进行测序。利用NCBI 核酸数据库进行BLAST(http://blast.ncbi.nlm.nih.gov/)序列比对,根据同源性确定病毒种类。
1.5 系统发育分析
保存BLAST 序列比对结果中相应分离物的序列。利用MEGA 6.0 软件,对保存的序列进行分析。多序列比较分析采用ClustalW,采用邻接法构建系统进化树,重复1 000 次。
2 结果与分析
2.1 番茄病株的田间症状
2021 年宁夏地区温室内番茄病毒病严重发生,主要症状包括:植株的叶柄和茎秆出现褐色、不规则形病斑,病斑大小不等,发病严重时病斑可绕茎一周(图1-A、B);未成熟果实表面出现褐色、不规则形病斑,随着病情发展发病部位逐渐坏死、变硬,略微凸起,部分果实出现条纹或同心环纹(图1-C、D)。

图1 番茄病毒病植株田间症状
2.2 番茄病株样品的RT-PCR 检测
提取10 份番茄病株样品的总RNA,以其为模板,利用不同番茄病毒的特异性引物进行RTPCR 扩增。结果表明:只有引物STVdF/STVdR和TSWV-F/TSWV-R 分别扩增出大小约为681 bp 和777 bp 的特异片段(图2),其他引物均未扩增出特异片段。测序后经BLAST 比对,大小约为681 bp 特异片段的分离物与GenBank 上的南方番茄病毒(southern tomato virus,STV)的相似性达到100%,大小约为777 bp 特异片段的分离物与GenBank 上的TSWV 的相似性达到99%以上。表明宁夏银川地区番茄被STV 与TSWV 复合侵染。

图2 不同引物对番茄病毒病样本RT-PCR 检测结果
2.3 TSWV 和STV 聚类分析结果
将所得的TSWV 和STV 分离物的扩增子序列与GenBank 中TSWV 和STV 相应分离物序列进行比对,并选择其他地区与本试验中的序列最为接近的TSWV 和STV 分离物,构建系统进化树(图3)。结果显示,宁夏银川地区番茄上的TSWV 与西班牙辣椒上TSWV 分离物聚在同一分支上,表明进化关系最近,而与其他地区的亲缘关系较远;STV分离物与法国、巴基斯坦、哥伦比亚番茄上的STV分离物的进化关系最近,与其他地区的STV 分离物关系较远。
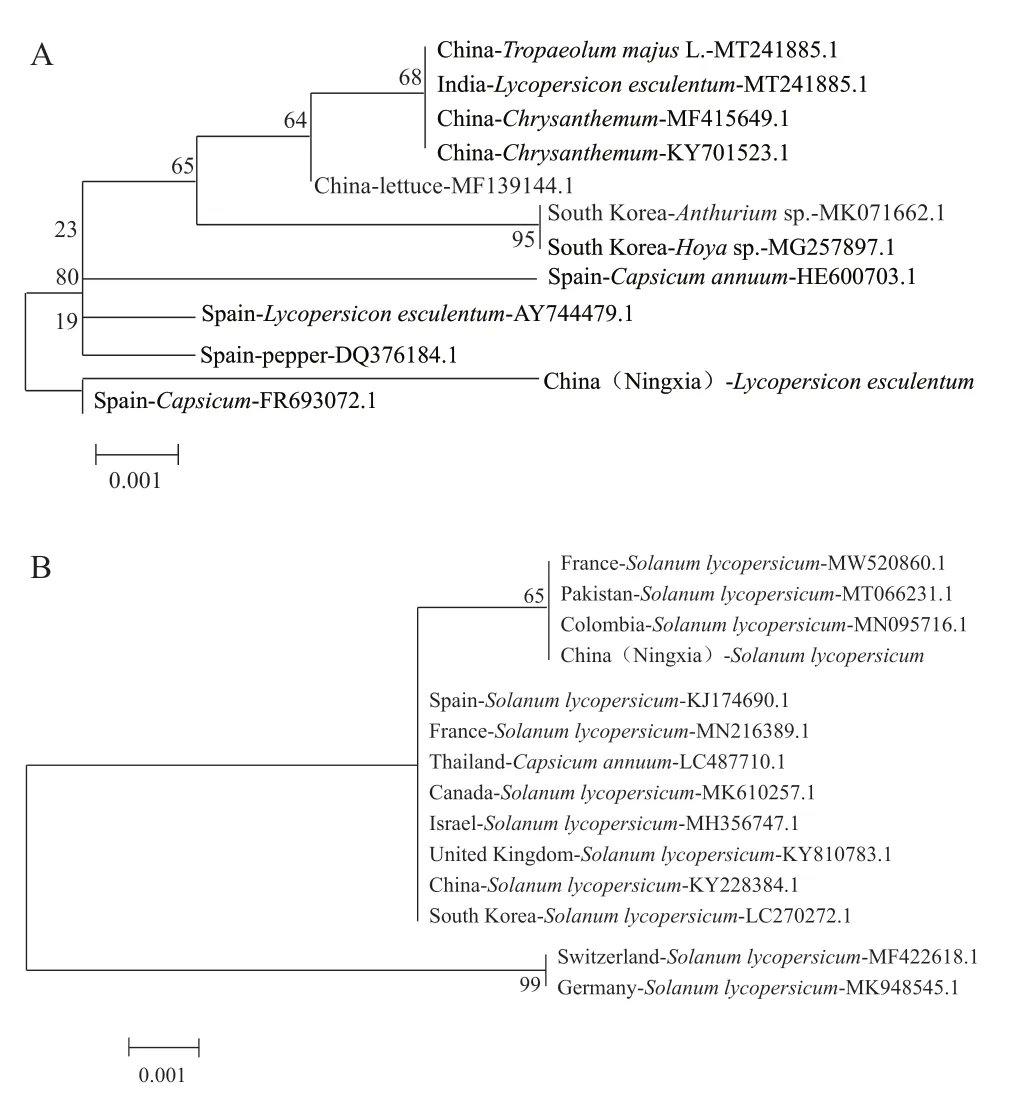
图3 基于TSWV(A)和STV(B)基因组部分核酸序列的系统进化树
3 结论与讨论
采用RT-PCR 方法对采集自宁夏银川地区的疑似番茄病毒病的植株样品进行了鉴定,并构建了系统发育树,结果表明这些番茄被TSWV 和STV复合侵染。宁夏银川地区番茄上的TSWV 分离物的进化关系与西班牙辣椒上的TSWV 分离物进化关系最近,STV 与法国、巴基斯坦和哥伦比亚番茄上的STV 分离物关系最近。
TSWV 属于,可以侵染900 多种植物(包括农作物与杂草),如花生、辣椒、马铃薯、烟草、番茄、芹菜、南瓜和桔梗等(李云洲 等,2018),在我国许多地区均有TSWV 的为害(李洁等,2017),并且该病毒已经被列入中华人民共和国进境植物检疫性有害生物名录。TSWV 侵染苗期番茄引起生长点和叶片变成铜色并上卷,随后出现黑斑点,叶片背面叶脉呈紫色,后期引起生长点和叶片坏死,整株萎蔫,果面有环状病斑,尤其是果实完全成熟时病斑表型非常明显(Chiemsombat &Adkins,2006;李洁 等,2017;王凯娜 等,2019;李婷婷 等,2020;石岩 等,2020)。据报道,TSWV 只能通过机械传播和昆虫传播,不能通过种子传播(李云洲 等,2018)。
STV病毒是近些年新发现和命名的一种病毒,属于Amalgaviridae 科属。目前已在美国、墨西哥、法国、西班牙、德国和中国等地区发现了STV,主要症状包括植株生长矮小,黄化,生长点坏死,果实较小,出现环形斑点等(Turina et al.,2007;Candresse et al.,2013;Gaafar et al.,2019)。除侵染番茄外,STV 还可以侵染蓝莓、紫荆花以及杜鹃花等植物(苏海娣,2013)。与TSWV 不同的是,STV 是严格的种传病毒,不能通过汁液摩擦和嫁接传播,也没有发现通过昆虫传播(董云浩 等,2019)。
绝大多数病毒都是系统侵染植物,并且许多病毒侵染植株后出现了类似的发病症状,导致人们难以准确识别病毒的种类。在田间,多种病毒同时侵染植株的情况时有发生,更是增加了诊断难度。基于分子生物学的方法对病毒的种类进行鉴定,可以有效避免以上问题。目前,对田间植物病毒的鉴定越来越依赖于分子诊断。刘微等(2018)通过RTPCR 方法对云南元谋地区的疑似番茄病毒病进行了检测,发现该地的番茄被番茄褪绿病毒和番茄黄化曲叶病毒复合侵染。Xu 等(2017)对我国的170个番茄样品进行了小RNA 测序分析,共检测到了22 种病毒,其中大多数样品是被多种病毒共同侵染,同时认为STV 已经成为我国番茄上第四大流行病毒。鉴于两种病毒传播方式有所不同,在生产中应注意采取综合措施进行防治,既要加强种子检疫和种子消毒,同时也要注意防治昆虫。

