茶树挥发物的生态功能与茶树害虫食诱剂研发策略
摘要:植物挥发物对调节植物—害虫间关系、害虫种群消长起着重要作用。基于害虫偏好食源挥发物研制的食诱剂(也称“植物源引诱剂”),是一类重要的害虫绿色防控产品。文章总结了虫害诱导茶树挥发物的释放特征、生态功能,分析了茶树害虫食诱剂研发与应用过程中的经验,并对今后茶树害虫食诱剂研究进行了分析和展望,以期促进茶园害虫绿色防控技术的创新发展。
关键词:茶树挥发物;食诱剂;生态功能;茶树害虫;研发策略
Ecological Function of Tea Plant Volatiles and
Research Strategy about Food-based
Attractants of Tea Plant Pests
CAI Xiaoming
Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China
Abstract: Volatile compounds can be used by plants to interact with the surrounding environment, and mediate the population dynamics of pests. The food-based attractants (i.e., botanical attractants), based on volatiles from the preferred plants, can function as an important technique for green pest control. This paper overviewed the releasing characteristic and the ecological functions of the tea plant volatiles induced by herbivores, summarized the development experience of food-based attractants against tea pests, and put forward some suggestions on the future development of food-based attractants, which would promote the innovative development of the green control for tea pests.
Keywords: tea plant volatiles, food-based attractants, ecological functions, tea pests, research strategy
茶樹挥发物是茶园生态系中的一种化学信息,对调节茶树、害虫、天敌三个营养级之间的关系,以及害虫种群消长都起着重要作用。利用茶树挥发物进行害虫防治一直是茶树害虫绿色防控的研究热点,并在茶树害虫食诱剂方面开展了大量研究,但目前成功的实例还较少。结合前期的研究经验,本文提出了今后茶树害虫食诱剂的研究建议,以期促进茶园害虫绿色防控技术的创新发展。
1 茶树挥发物
植物挥发物是多种挥发性植物次生物质的混合物,具有丰富的多样性。目前已从90多种植物的挥发物组分中鉴定出1 700余种挥发性物质。这些物质主要包括:脂肪酸衍生物、萜烯类化合物、苯类化合物等。植物挥发物的定性、定量组成与植物的种类、品种、生理阶段、器官、生长环境等密切相关,并且受昆虫取食、病菌侵染、干旱、水涝等各种胁迫因素的影响[1]。植物可通过挥发物向周围生物传达关于自身的各种信息。周围生物感知植物释放的挥发物后,通过改变其生理代谢或行为,作出相应响应。这样,植物挥发物就可调控植物-害虫-天敌三营养级间的关系,影响生态系统中的种群、群落结构[1]。例如:植食性昆虫通过植物挥发物寻找适合、喜好的食物;传粉昆虫借助花香定位花朵,它们在获取食物的同时,也间接帮助植物完成传粉、繁殖;虫害植物释放的挥发物不仅是寄生性、捕食性天敌昆虫寻找害虫的关键信息,也是虫害植株向临近未受害植株发出的预警信息[2]。
1.1 茶树挥发物的释放
近30年来,我们已对茶树释放的挥发物有了较为详尽的了解[3-11]。尽管由于试验方法、试验材料等的不同,研究结果间有所差异,但茶树挥发物的主要组成、变化规律是一致的。下面通过茶丽纹象甲(Myllocerinus aurolineatus)、茶尺蠖(Ectropis obliqua)、茶小绿叶蝉(Empoasca onukii)为害诱导的茶树挥发物,解析茶树挥发物的释放特征。
1.1.1 高度清晰性
通常未受害茶树仅能释放微量的少数几种物质。但遭受虫害后,茶树挥发物就会发生巨大变化,释放量可提升上百倍,组分数也可增加近10倍,并且信号的清晰程度还与虫害的发生程度有关。即虫害发生越严重,虫害诱导茶树挥发物的组成越复杂、释放量也越大,进而对天敌的招引能力也越强。
1.1.2 特异性
不同害虫诱导的茶树挥发物截然不同。尽管茶尺蠖、茶小绿叶蝉、茶丽纹象甲诱导的茶树挥发物中含有某些相同的物质,但由于相对含量的差异和存在特异性物质,不同害虫诱导的茶树挥发物具有一定的特异性。茶小绿叶蝉为害后,(E)-β-罗勒烯、(E)-4,8-二甲基-1,3,7-壬三烯(DMNT)、(E,E)-α-法呢烯等3种萜类物质的释放量可占挥发物总释放量的90%;茶丽纹象甲为害后,茶树挥发物中的萜类物质、苯类化合物分别占挥发物总释放量的64%、23%,释放量最大的物质是(E)-β-罗勒烯;茶尺蠖为害后,萜类物质、苯类化合物分别占总释放量的24%、53%,释放量最大的是苯乙腈。除上述差异外,β-红没药烯、(E,E)-4,8,12-三甲基-1,3,7,11-十三碳四烯(TMTT)、γ-萜品烯等特异性物质分别仅出现于茶尺蠖、茶小绿叶蝉、茶丽纹象甲为害诱导的茶树挥发物中。
1.1.3 稳定性
尽管虫口密度越高,虫害茶树挥发物组成越丰富、释放量越大。但由于其主要成分相似,虫害诱导茶树挥发物又具有一定的稳定性。例如:茶丽纹象甲的虫口密度从40头/株提升到100头/株后,受害茶树的挥发物释放量可提升4倍,挥发物组分数也从37种增加到了51种。但低、高密度的茶丽纹象甲为害后,茶树挥发物中的主要成分(相对含量≥5%)是相同的,并且其相对比例几乎没有差异。
1.1.4 与害虫发生、天敌活动的同步性
害虫为害后,茶树立刻就可释放绿叶挥发物,而虫害诱导茶树挥发物中的其他组分也可在24 h内陆续、大量释放;当害虫停止为害后,虫害诱导茶树挥发物可在15 h内大量减少。这样就避免了对天敌“呼救”的不及时和误导。虫害诱导茶树挥发物还具有昼高夜低的释放动态,而绝大多数天敌都在白天捕食或寄生害虫。这样虫害诱导茶树挥发物的释放规律与天敌的活动规律具有同步性。
综上,正是因为虫害诱导茶树挥发物具备上述特性,才保证了天敌等其他生物对虫害诱导茶树挥发物的利用。
1.2 茶树挥发物的生态功能
茶树挥发物释放后,可被茶园中的害虫、天敌,甚至临近茶树感知并加以利用,从而调控茶树-害虫-天敌三营养级间的关系。下面以茶尺蠖、茶小绿叶蝉、害螨为例,介绍茶树挥发物对茶树-害虫-天敌三营养级间关系的调控功能。
茶尺蠖幼虫为害诱导的茶树挥发物对茶尺蠖雌、雄虫有明显的吸引作用,雌虫在被害茶苗上的产卵量是未受害茶苗上的5倍[12]。诱导挥发物中的(Z)-3-己烯醛、(Z)-3-己烯醋酸酯、(Z)-3-己烯醋己酯、苯甲醇等物质对茶尺蠖成虫有显著的吸引作用。这种吸引可使茶尺蠖更容易找到交配对像或合适的产卵场所,还可降低天敌对其后代个体的攻击概率。相对未受害茶苗、机械损伤茶苗,寄生蜂单白绵副绒茧蜂(Parapanteles hyposidrae )对茶尺蠖为害诱导的茶树挥发物具有明显的偏好性。诱导挥发物中的(Z)-3-己烯醇、(Z) -3-己烯醇醋酸酯、芳樟醇、(E)-β-罗勒烯等9种物质对绒茧蜂具显著的引诱活性。但只有当绿叶挥发物与芳樟醇、(E)-β-罗勒烯等萜类化合物混合后,引诱活性才会与虫害诱导茶树挥发物相当[12]。由于绿叶挥发物在机械损伤后就可立即、大量释放,而芳樟醇、(E)-β-罗勒烯等萜类化合物只在虫害后可产生,因此,利用不同类型的虫害诱导挥发物进行寄主定位,可使寄生蜂更加及时、精准地搜寻到茶尺蠖幼虫。
茶小绿叶蝉趋嫩性强,可通过挥发物辨别茶梢老嫩度。挥发物中单组分的引诱活性不如全组分茶梢挥发物,但(Z)-3-己烯醇、(Z)-3-己烯醇醋酸酯、芳樟醇混合物的引诱活性与茶树嫩梢相当。这表明天然挥发物中少数物质的配比是茶小叶蝉定位嫩梢的关键嗅觉信息[13]。被茶小绿叶蝉为害后,茶梢释放的2,6-二甲基-3,7-辛二烯-2,6-二醇对叶蝉捕食性天敌白斑猎蛛(Evarcha albaria)具极强的引诱活性,在10-8 g/mL和10-9 g/mL的低质量浓度下,该物质仍对白斑猎蛛展现出极强的引诱活性[10]。此外,茶小绿叶蝉为害过的嫩茎、叶片释放的挥发物,对其卵寄生蜂三棒缨小蜂(Stethynium empoascae )有明显的引诱作用[14]。
相对未受害叶片,捕食螨(Neoseiulus longispinosus、Neoseiulus womersleyi )更喜欢神泽氏叶螨(Tetranychus kanzawai )、咖啡小爪螨(Oligonychus coffeae )为害过的茶树叶片[15-17]。并且害螨数量越多、为害时间越长,被害叶片挥发物对捕食螨的引诱活性越强。被神泽氏叶螨为害后,仅DMNT、(E)-β-罗勒烯和(E,E)-α-法呢烯等3种物质的释放量是显著增加的。这3种物质的混合物对捕食螨(N. womersleyi )的引诱活性与被害叶片相当,且缺少任一物质混合物对捕食螨就会失去引诱作用[16]。这说明DMNT、(E)-β-罗勒烯和(E,E)-α-法呢烯混合物是被害茶树叶片向捕食螨发出的求救信息。
此外,虫害诱导茶树挥发物还可被临近未受害茶树感知,进而激活其茉莉酸、水杨酸等信号途径,提高其抗虫水平。这方面的报道最早见于2011年。虽然该研究仅限于同株茶树不同位置叶片间的挥发物信息交流,但也证实了茶树叶片可感知虫害叶片释放的挥发物,进而改变其代物组成[9]。最近3年,有关虫害茶树与临近茶树间的挥发物通讯研究呈井喷之势。例如,经茶尺蠖为害诱导的茶树挥发物或其组分(Z)-3-己烯醇、芳樟醇、法呢烯和DMNT等处理后,茶树挥发物的释放量显著提升、组分数明显增加[18]。其中,大量释放的β-罗勒烯对茶尺蠖成虫具驱避活性。茶树经β-罗勒烯、(Z)-3-己烯醇、吲哚、DMNT、α-法呢烯等虫害诱导挥发物熏蒸处理后,其上的茶尺蠖取食量显著减少、生长发育受到抑制[19-23]。相对(E)-橙花叔醇熏蒸处理过的茶梢,茶小绿叶蝉更喜欢在对照茶梢上取食、产卵[24]。(Z)-3-己烯醇可激发茶树对茶尺蠖的抗性也在田间得到了证实[25]。茶园中缓释(Z)-3-己烯醇后,茶尺蠖幼虫数量明显减少,其幼虫的寄生蜂寄生率显著提高。
2 茶树害虫食诱剂
植物挥发物对调节植物、害虫、天敌间的关系,以及害虫种群消长都起着重要作用。人们很早就开始利用这些化学信息进行害虫防治,迄今已发展形成了诱集植物、诱集枝把、食诱剂(也称“植物源引诱剂”)、“推-拉”防治技术等一系列的害虫防控技术[26]。其中,害虫食诱剂高效、操作簡单,避免了诱集植物、诱集枝把所需的大量人工操作,是在害虫防治中应用最广、发挥作用最大的一类利用植物挥发物的防控技术[27]。
2.1 害虫食诱剂在害虫防治中的应用
为了生存繁衍,害虫要取食植物的茎、叶、果实、花蜜等多种食物;同时为了方便幼虫取食,害虫会选择适合的寄主产卵。害虫主要依靠嗅觉进行食物选择,并且越喜好食物的气味对害虫的引诱作用越强。因此我们可利用这一现象进行害虫防治。食诱剂是人工模拟害虫喜好食物气味的一种生物诱捕剂,是一类重要的害虫绿色防控产品[27]。目前应用的食诱剂主要分为2类,即传统食诱剂和新型食诱剂。甲壳类、蛾类成虫喜食腐烂果实、植物蜜露、植物伤口分泌液。这些食物的气味可通过发酵糖水、糖醋酒液等模仿。20世纪初人们就开始利用发酵糖水、糖醋酒液等传统食诱剂进行害虫诱集防治。随着科学技术的发展和人们认知的不断深入,通过人工组配、模拟害虫食物气味中关键引诱物质,先后研制出实蝇、夜蛾、蓟马、甲虫等多类害虫的新型食诱剂。这些食诱剂对雌、雄害虫均有效,已在橘小实蝇(Bactrocera dorsalis )、地中海实蝇(Ceratitis capitata )、棉铃虫(Helicoverpa armigera )、苹果蠹蛾(Cydia pomonella )、西花蓟马(Frankliniella occidentalis )、西方玉米根萤叶甲(Diabrotica virgifera virgifera )、纵坑切梢小蠹(Tomicus piniperda )等世界性重要害虫的监测和防治中发挥了重要作用。其中,本世纪初期实蝇新型食诱剂在地中海盆地的应用防治面积就超过10万hm2,其防治效果与化学农药相当。
2.2 茶树害虫食诱剂的研发与应用
目前国内外茶树植保科研工作者已针对茶小绿叶蝉、茶尺蠖、茶丽纹象甲、茶天牛(Aeolesthes induta )、茶小卷叶蛾(Adoxophyes orana )、茶卷叶蛾(Homona coffearia )等害虫开展了食诱剂研究,并在茶天牛、茶小卷叶蛾、茶卷叶蛾食诱剂研究中取得了成功。
在传统食诱剂方面,上世纪80年代,日本利用清酒酒粕诱捕茶小卷叶蛾、茶卷叶蛾获得成功[28]。诱捕到的茶小卷叶蛾、茶卷叶蛾中,雌蛾均占60%以上且95%已完成交配。我国利用糖醋酒液、蜂蜜水、白糖水等研制出茶天牛食诱剂。成虫虫口高峰期诱虫量可达90头/周,且雌虫数量是雄虫的2倍[29]。糖醋酒液、蜂蜜水对茶天牛的诱捕效果相仿,白糖水略差。但相对于糖醋酒液,蜂蜜水、白糖水放置后第一天茶天牛的诱捕数量很低。这是由于只有发酵后,糖溶液释放的气味才会吸引茶天牛。在田间微生物的作用下,这一过程很快即可完成。该技术已在浙江绍兴推广应用300 hm2,诱杀天牛55万头,极大缓解了当地茶天牛的为害。
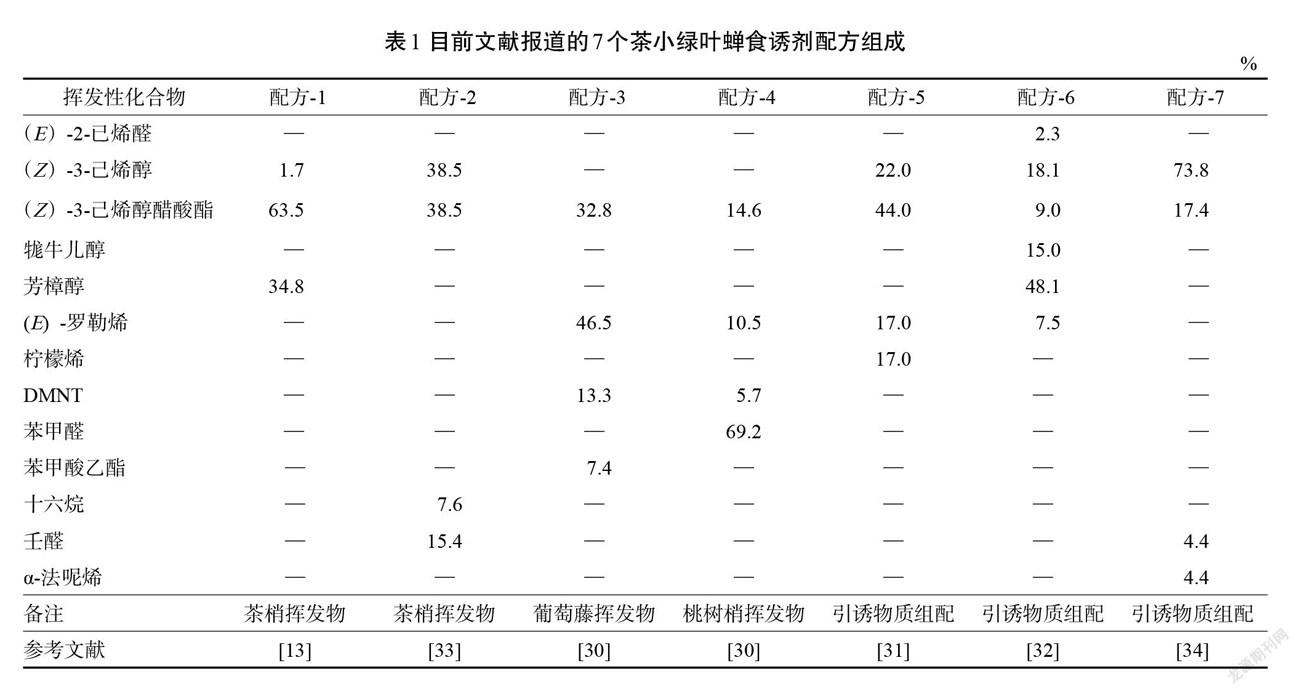
虽然在新型食诱剂方面开展了大量研究,并初步提出了茶尺蠖、茶丽纹象甲、茶小绿叶蝉、茶小卷叶蛾等害虫的食诱剂配方[13,30-37]。但大部分研究的田间诱捕效果尚不理想,还未达到实际应用的需求。其中,茶小绿叶蝉食诱剂开展的研究工作最多,先后共提出7个配方(表1)[13,30-34]。它们的提出主要通过2种途径,即模拟天然植物挥发物和筛选、组配引诱物质。这7个配方的组分有较大差别,共包含13种物质。但田间它们对叶蝉的引诱效果并不理想,最高也仅为对照的1倍。下面以配方-3、配方-4为例进行介绍。研究显示茶树嫩梢、桃树嫩梢、葡萄藤新梢的挥发物吸引茶小绿叶蝉,且桃树、葡萄的引诱活性强于茶树[30]。这为我们研制高效叶蝉食诱剂提供了便利。经一系列叶蝉嗅觉行为反应测定,提出了基于桃树、葡萄挥发物的茶小绿叶蝉食诱剂配方。这两个配方的组成与茶梢挥發物相似,但均存在特异性组分,分别为苯甲醛、苯甲酸乙酯。室内无论在Y型嗅觉仪还是风洞中,这2个配方均对茶小绿叶蝉展现出强烈的引诱活性,且强于茶梢挥发物。多次田间验证试验显示,配方-3对茶小绿叶蝉具有良好的引诱效果,可使粘虫色板诱虫量提高80%;但配方-4几乎无引诱效果[30]。之后的研究证实,是茶园背景气味干扰配方-4对叶蝉的吸引。
2.3 茶园背景气味对食诱剂的干扰
昆虫嗅觉定向过程中,除目标气味外,遇到的其他气味可称之为背景气味[38]。田间背景气味包括杂草释放的挥发物,昆虫、动物及其排泄物释放的气味,以及施肥、喷药等各种人为活动产生的气味。田间背景气味浓度低,在1×10-9~1×10-6 g/L级别,且组成丰富[1]。已有的大量事例证明,田间背景气味可降低食诱剂的诱虫效率[38]。例如:当田间施用粪肥后,蛋白质诱饵对地中海实蝇的引诱效果明显下降[39]。这是由于动物粪便、蛋白质诱饵均可大量释放对实蝇具有引诱活性的氨。梨成熟期大量释放对苹果蠹蛾具有引诱活性的梨酯,而此时含梨酯的食诱剂对苹果蠹蛾的诱集效果并不理想[40]。
已有研究表明茶园背景气味可干扰食诱剂对茶小绿叶蝉的引诱。利用热解析气质联用仪测定发现,茶园背景气味中含有10余种植物挥发物,其中苯甲醛的检出率、检出质量浓度均为最高,分别100%、3 ng/L[30]。其质量浓度是其余检出植物挥发物的上百倍。而苯甲醛也是叶蝉食诱剂配方-4的特异性关键组分。进一步的行为测定显示,苯甲醛在3 ng/L(茶园背景气味中的浓度)质量浓度时,即可吸引茶小绿叶蝉;当苯甲醛气味浓度大于配方-4中苯甲醛质量浓度的5%时,苯甲醛即可显著干扰配方-4对叶蝉的吸引[30]。另一项研究也显示了相似的结果。多次田间试验表明,配方-5的引诱效果受季节影响大,秋季的引诱效果普遍好于夏季[31]。田间诱集试验同步的茶园背景气味测定显示,茶园背景气味中含有配方-5的所有组分物质,且夏季的浓度高于秋季。进一步在田间采集茶园空气进行的嗅觉行为反应测定显示,茶园背景气味对茶小绿叶蝉具有引诱活性,并且茶小绿叶蝉在茶园空气与配方-5间无明显的趋向性;但当配方-5气味浓度提高10倍后,茶小绿叶蝉更愿意选择配方-5。这一试验表明,提高食诱剂的释放量可在一定程度上克服茶园背景气味的干扰。
3 未来茶树害虫食诱剂的研发策略
新型食诱剂,高效、操作简单,可标准化、规模化生产,极大克服了传统食诱剂由于原料多样性而导致的引诱活性不稳定,并已在许多世界性的害虫防治中发挥了重要作用,是当前食物诱杀技术发展的重要趋势。虽然对茶树害虫食诱剂已经开展了大量的研究,但是绝大多数研究距离实际生产应用还有一定的距离。同样,近20年其他作物上的害虫新型食诱剂研发也进展缓慢,大量的室内行为试验结果未在田间诱集试验得到验证[41]。结合前期的研究经验,今后茶树害虫食诱剂的研究应在以下几方面加以重视。
3.1 重视茶园背景气味对食诱剂造成的干扰
大量证据显示,田间背景气味可干扰食诱剂的效果。如果我们从以下3方面对田间背景气味加以重视,可加快研发过程。
3.1.1 在复杂背景气味中进行食诱剂的配方组配
通常室内洁净气味中得到的“最优配方”往往丢失了某些看似不重要的物质。但是它们有可能在抵抗田间背景气味干扰中发挥着重要作用。因此在复杂气味环境中,进行食诱剂配方研制是十分必要的。例如:斑翅果蝇(Drosophila suzukii)食诱剂研发成功后,Cha等[42]建立了1套可同时测定至少10个味源的多项选择测定装置。该装置内的气味环境远比二项行为选择系统复杂,作者估计,若利用该装置,斑翅果蝇食诱剂的研发时间可由2年缩短至1周。
3.1.2 對田间背景气味的分析
由于田间背景气味来源复杂,主栽作物挥发物并不能代表田间背景气味。例如,前文所述的茶小绿叶蝉食诱剂配方-4的关键组分苯甲醛,仅能被茶树少量释放,但茶园背景气味中却检测出了高浓度的苯甲醛。因此在食诱剂研制过程中,分析田间背景气味十分必要。
3.1.3 利用多种植物挥发物研发食诱剂
研发中一个巨大的挑战就是食诱剂对目标害虫的引诱活性要强于主栽作物。为此,我们可利用多种植物挥发物进行研发,使最终得到的配方含有不同植物的挥发物。这方面最典型的例子就是棉铃虫食诱剂。研究起始,测试了38种植物挥发物对棉铃虫的引诱活性。在此基础上,选择了34种物质进行配方组配,最终得到了含有6个组分的配方,形成了一个自然界中不存在的超级混合物[43]。在棉田使用该食诱剂后,棉铃虫成虫虫口数量减少95%,落卵量减少90%以上。同时该食诱剂也在玉米、大豆等作物上展现出优良的引诱效果和防治效果,做到了“来源自然,强于自然”。
3.2 深入研究害虫寄主定位行为和挥发物缓释特征
害虫的寄主定位行为常分为寄主定向(远距离)、降落(近距离)和接触3个阶段。这一过程中,除嗅觉外,昆虫还依靠视觉、触觉和味觉等感觉器官不断收集来自植物的各种信息,然后对正、负作用因素进行综合评价,最后作出对植物的取舍决定[26]。目前为了快速筛查出具有引诱活性的挥发性物质,大多数研究只进行了昆虫短距离的嗅觉反应测试,仅得到了昆虫对某种气味的反应结果。这样的研究方法过于简单,不能详细解析昆虫寄主定位过程中所依赖的各种信息和昆虫嗅觉反应的行为特征。为此,将来的研究应加强风洞、半田间、田间等较大范围内的行为测定,同时结合视频追踪、雷达、无线电遥测等技术记录、分析害虫定位过程的行为路径[44-49]。这些试验结果可为我们提供害虫长距离移动的行为特点和定位过程中可能依赖的各种感官信息,并有助于研发配合食诱剂使用的高效捕杀装置。已有研究显示诱杀装置的形状、颜色、高度、大小等都可极大影响食诱剂对目标害虫的吸引。而这些参数的最优化与昆虫行为学研究密不可分。通过嗅觉与视觉协同效应,将食诱剂与物理诱杀装置有机结合,可开发出更为高效的诱杀技术。最为典型的就是涂有丁酸己酯的红色诱蝇球。该技术已是苹果绕实蝇(Rhagoletis pomonella)综合防治策略中的一项重要措施[50]。此外,为保证较长一段时间内发挥作用,食诱剂需配合缓释载体使用。食诱剂各组分理化性质上的差异,会导致其在缓释载体上的释放有所不同。同时,食诱剂气味中各组分的浓度、相对比例极大影响引诱活性。这就需要我们选择适合的缓释载体、优化缓释载体上各组分的加载量,从而让缓释出的气味与我们所期望的一致[51-52]。
3.3 要充分了解害虫、植物的生物信息和生态学信息
充分掌握害虫、植物的生物信息和生态学信息,对食诱剂研发有很大帮助。这些信息包括:目标植物对靶标害虫的田间引诱效果、靶标害虫的活跃周期、目标植物的物候学信息等。同时,要选用可代表田间实际情况的植物、害虫材料进行试验。采用田间收集的虫子进行室内行为测定,可使试虫在种内多样性、表型可塑性、田间环境适应性等方面更接近田间[41]。同样,植物挥发物释放受各种生物、非生物胁迫影响,室内供试植物的挥发物释放往往与田间生长的植物不一致。为此,要明确两者间的差异。
参考文献
[1] BEYAERT I, HILKER M. Plant odour plumes as mediators of plant-insect interactions[J]. Biological Reviews, 2014, 89(1): 68-81.
[2] NINKOVIC V, MARKOVIC D, RENSING M. Plant volatiles as cues and signals in plant communication[J]. Plant Cell Environment, 2021, 44(4): 1030-1043.
[3] MU D, PAN C Y, QI Z H, et al. Multivariate analysis of volatile profiles in tea plant infested by tea green leafhopper Empoasca onukii Matsuda[J]. Plant Growth Regulation, 2021, 95(4): 111-120.
[4] 孙廷哲, 岂泽华, 梁可欣, 等. 蚜害茶树挥发物组分变化的聚类分析[J]. 植物学报, 2021, 56(4): 422-432.
[5] 焦龙, 边磊, 罗宗秀, 等. 茉莉酸、水杨酸类激发子外源诱导的茶树挥发物比较[J]. 园艺学报, 2020, 47(5): 927-938.
[6] WANG L, XU R J, HU B, et al. Analysis of free amino acids in Chinese teas and flower of tea plant by high performance liquid chromatography combined with solid-phase extraction[J]. Food Chemistry, 2011, 123(4): 1259-1266.
[7] 曾亮, 傅丽亚, 罗理勇, 等. 不同品种和花期茶树花挥发性物质的主成分和聚类分析[J]. 食品科学, 2015, 36(16): 88-93.
[8] 蔡晓明. 三种茶树害虫诱导茶树挥发物的释放规律[D]. 北京: 中国农业科学院, 2009.
[9] DONG F, YANG Z Y, BALDERMANN S, et al. Herbivore-induced volatiles from tea (Camellia sinensis) plants and their involvement in intraplant communication and changes in endogenous nonvolatile metabolites[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 13131-13135.
[10] 陳宗懋. 茶树害虫化学生态学[M]. 上海: 上海科学技术出版社, 2013.
[11] 宛晓春, 夏涛. 茶树次生代谢[M]. 北京: 科学出版社, 2015.
[12] 王国昌. 三种害虫诱导茶树挥发物的生态功能[D]. 北京: 中国农业科学院, 2010.
[13] 边磊. 基于远程寄主定位机理的假眼小绿叶蝉化学生态和物理调控[D]. 北京: 中国农业科学院, 2014.
[14] 潘铖, 林金丽, 韩宝瑜. 茶梢信息物引诱叶蝉三棒缨小蜂效应的检测[J]. 生态学报, 2016, 36(12): 3785-3795.
[15] MAEDA T, LIU Y N, ISHIWARI H, et al. Conditioned olfactory responses of a predatory mite, Neoseiulus womersleyi, to volatiles from prey-infested plants[J]. Entomologia Experimentalis et Applicata, 2006, 121(2): 167-175.
[16] ISHIWARI H, SUZUKI T, MAEDA T. Essential compounds in herbivore-induced plant volatiles that attract the predatory mite Neoseiulus womersleyi [J]. Journal of Chemical Ecology, 2007, 33(9): 1670-1681.
[17] RAHMAN V J, BABU A. Herbivore-induced plant volatiles from red spider mite, Oligonychus coffeae infested tea plants as attractant cues for the predatory mite, Neoseiulus longispinosus[J]. Materials Today: Proceedings, 2021, 41: 613-617.
[18] JING TT, QIAN X N, DU W K, et al. Herbivore-induced volatiles influence moth preference by increasing the β-Ocimene emission of neighbouring tea plants[J]. Plant Cell Environment, 2021, 44(11): 3667-3680.
[19] WANG X W, ZENG L T, LIAO Y Y, et al. Formation of α-farnesene in tea (Camellia sinensis) leaves induced by herbivore-derived wounding and its effect on neighboring tea plants[J]. International Journal of Molecular Sciences, 2019, 20(17): 4151. https://doi.org/10.3390/ijms20174151.
[20] ZENG L T, LIAO Y Y, LI J L, et al. α-Farnesene and ocimene induce metabolite changes by volatile signaling in neighboring tea (Camellia sinensis) plants[J]. Plant Science, 2017, 264: 29-36.
[21] LIAO Y Y, TAN H B, JIAN G T, et al. Herbivore-induced (Z) 3-hexen-1-ol is an airborne signal that promotes direct and indirect defenses in tea (Camellia sinensis) under light[J]. Journal of Agricultural and Food Chemistry, 2021, 69(43): 12608-12620.
[22] YE M, LIU M M, ERB M, et al. Indole primes defence signalling and increases herbivore resistance in tea plants[J]. Plant Cell Environment, 2021, 44(4): 1165-1177.
[23] JING T T, DU W K, GAO T, et al. Herbivore-induced DMNT catalyzed by CYP82D47 plays an important role in the induction of JA-dependent herbivore resistance of neighboring tea plants[J]. Plant Cell Environment, 2021, 44: 1178-1191.
[24] CHEN S L, ZHANG L P, CAI X M, et al. (E)-Nerolidol is a volatile signal that induces defenses against insects and pathogens in tea plants[J]. Horticulture Research, 2020, 7: 52. https://doi.org/10.1038/s41438-020-0275-7.
[25] CHEN S L, ZHANG L P, CAI X M, et al. (Z )-3-Hexenol induces tea defense against Ectropis grisescens in the field[J]. Russian Journal of Plant Physiology, 2020, 67: 572-580.
[26] 陸宴辉, 张永军, 吴孔明. 植食性昆虫的寄主选择机理及行为调控策略[J]. 生态学报, 2008, 28(10): 5113-5122.
[27] 蔡晓明, 李兆群, 潘洪生, 等. 植食性害虫食诱剂的研究与应用[J]. 中国生物防治学报, 2018, 34(1): 8-35.
[28] HORIKAWA T, SHIRATORI C, SUZUKI T, et al. Evaluation of sake-lees bait as an attractant for the smaller tea tortrix moth (Adoxophyes sp.) and tea tortrix moth (Homona magnanima Diakonoff)[J]. Japanese Journal of Applied Entomologist Zoology, 1986, 30(1): 27-34.
[29] 边磊, 吕闰强, 邵胜荣, 等. 茶天牛食物源引诱剂的筛选与应用技术研究[J]. 茶叶科学, 2018, 38(1): 94-101.
[30] 蔡晓明. 茶小绿叶蝉与植物间化学通讯物质的鉴定与田间功能验证[D]. 北京: 中国农业科学院, 2016.
[31] XU X X, CAI X M, BIAN L, et al. Does background odor in tea gardens mask attractants? Screening and application of attractants for Empoasca onukii Matsuda[J]. Journal of Economic Entomology, 2017, 110(6): 2357-2363.
[32] CHEN K, HUANG M X, SHI Q C, et al. Screening of a potential leafhopper attractants and their applications in tea plantations[J]. Journal of Environmental Science and Health, Part B, 2019, 54(10): 858-865.
[33] HAN S J, WANG M X, WANG Y S, et al. Exploiting push-pull strategy to combat the tea green leafhopper based on volatiles of Lavandula angustifolia and Flemingia macrophylla[J]. Journal of Integrative Agriculture, 2020, 19(1): 193-203.
[34] NIU Y Q, HAN S J, WU Z H, et al. A push-pull strategy for controlling the tea green leafhopper (Empoasca flavescens F.) using semiochemicals from Tagetes erecta and Flemingia macrophylla[J/OL]. Pest Management Science, 2022. https://doi.org/10.1002/ps.6840.
[35] SUN X L, WANG G C, GAO Y, et al. Screening and field evaluation of synthetic volatile blends attractive to adults of the tea weevil, Myllocerinus aurolineatus[J]. Chemoecology, 2012, 22(4): 229-237.
[36] SUN X L, LI X W, XIN Z J, et al. Development of synthetic volatile attractant for male Ectropis obliqua moths[J]. Journal of Integrative Agriculture, 2016, 15(7): 1532-1539.
[37] TAMAKI Y, SUGIE H, HIRANO C. Acrylic acid: An attractant for the female smaller tea tortrix moth (Lepidoptera: Tortricidae)[J]. Japanese Journal of Applied Entomologist Zoology, 1984, 28(3): 161-166.
[38] 蔡晓明, 边磊, 李兆群, 等. 田间背景气味对植物源引诱剂的干扰及相应研发策略[J]. 中国生物防治学报, 2020, 36(5): 646-655.
[39] Michal M. Competitiveness of fertilizers with proteinaceous baits applied in Mediterranean fruit fly, Ceratitis capitata Wied (Diptera: Tephritidae) control[J]. Crop Protection, 2009, 28(4): 314-318.
[40] CASADO D, GEMENO C, AVILLA J, et al. Diurnal variation of walnut tree volatiles and electrophysiological responses in Cydia pomonella (Lepidoptera: Tortricidae)[J]. Pest Management Science, 2008, 64(7): 736-747.
[41] TH?MING G. Behavior matters-Future need for insect studies on odor-mediated host plant recognition with the aim of making use of allelochemicals for plant protection[J]. Journal of Agricultural and Food Chemistry, 2021, 69(36): 10469-10479.
[42] CHA D H, LOEB G M, LINN C E, et al. A multiple-choice bioassay approach for rapid screening of key attractant volatiles[J]. Environmental Entomology, 2018, 47(4): 946-950.
[43] GREGG P C, DEL SOCORRO A P, HAWES A J, et al. Developing bisexual attract-and-kill for polyphagous insects: Ecological rationale versus pragmatics[J]. Journal of Chemical Ecology, 2016, 42(7): 666-675.
[44] KNUDSEN G K, TASIN M, AAK A, et al. A wind tunnel for odor mediated insect behavioural assays[J]. Jove-Journal of Visualized Experiments, 2018, 141: e58385. https://doi.org/10.3791/58385.
[45] AAK A, RUKKE B, SOLENG A, et al. Questing activity in bed bug populations: Male and female responses to host signals[J]. Physiological Entomology, 2014, 39(3): 199-207.
[46] COOK SM, RASMUSSEN HB, BIRKETT MA, et al. Behavioural and chemical ecology underlying the success of turnip rape (Brassica rapa) trap crops in protecting oilseed rape (Brassica napus) from the pollen beetle (Meligethes aeneus)[J]. Arthropod-Plant Interactions, 2007, 1: 57?67.
[47] HAGEN M, WIKELSKI M, KISSLING W D. Space use of bumblebees (Bombus spp.) revealed by radio-tracking[J]. PLoS One, 2011, 6(5): e19997. https://doi.org/10.1371/journal.pone.0019997.
[48] LIHOREAU M, RAINE N E, REYNOLDS A M, et al. Radar tracking and motionsensitive cameras on flowers reveal the development of pollinator multidestination routes over large spatial scales[J]. PLos Biology, 2012, 10(9): e1001392. https://10.1371/journal.pbio.1001392.
[49] STEEN R, NORLI H R, TH?MING G. Volatile composition and timing of emissions in a moth-pollonated orchid in relation to hawkmoth (Lepidoptera: Sphingidae) activity[J]. Arthropod-Plant Interactions, 2019, 13: 581-592.
[50] RULL J, PROKOPY R J. Interaction between natural and synthetic fruit odor influences response of apple maggot flies to visual traps[J]. Entomologia Experimentalis et Applicata, 2005, 114: 79-86.
[51] KNIGHT A L, LIGHT D M, TRIMBLE R M. Identifying (E)-4,8-dimethyl-1,3,7-nonatriene plus acetic acid as a new lure for male and female codling moth (Lepidoptera: Tortricidae)[J]. Environmental Entomology, 2011, 40(2): 420-430.
[52] JANG E B, HOLLER T C, MOSES A L, et al. Evaluation of a single-matrix food attractant tephritid fruit fly bait dispenser for use in federal trap detection programs[J]. Proceedings of the Hawaiian Entomological Society, 2007, 39: 1-8.

