桃蛀螟细胞色素P450基因CYP4G113时空表达及功能研究
袁星星,董少奇,王鑫辉,郭线茹,王高平,李为争,张利娟,赵 曼
(河南农业大学植物保护学院,郑州 450002)
桃蛀螟Conogethespunctiferalis是一种多食性钻蛀性害虫,除为害桃、板栗等果树外,还可为害玉米、棉花等农作物[1],其对果树果实的为害严重程度曾有“十果九蛀”之称,但以往对农作物的为害一般相对较轻。近年来,随着果树果实套袋技术的推广和作物种植结构的调整,桃蛀螟在果园的为害逐渐减轻,但对农作物尤其是夏玉米的为害逐年加重,已成为黄淮海等地区夏玉米田穗期害虫的优势种[2,3]。果园果实套袋技术推广后,桃蛀螟为何能迅速从果树蔓延至玉米上为害,其幼虫是通过何种机制来适应玉米的?目前尚不清楚。在昆虫与寄主植物的长期进化过程中,植食性昆虫体内进化出了一些与其寄主适应性相关的重要因子[4],这些因子能使多食性昆虫具有强大的适应能力,从而使其快速适应变化的农田生态环境,明确这些寄主适应性相关因子的作用也可作为未来发展新型抗虫植物的潜在作用靶标[5-7],也可为揭示桃蛀螟的寄主转移及进化提供重要理论依据。
幼虫是鳞翅目昆虫生长发育的重要阶段,其通过取食寄主植物来获取能量和营养,但由于鳞翅目幼虫活动能力有限,因此从卵中孵化后的幼虫主要通过调节生理生化活动来适应其亲代成虫所选择的寄主植物,从而完成其自身的生长发育[8]。研究表明,昆虫中肠内的重要解毒酶如细胞色素 P450单加氧酶(Cytochrome P450 monooxygenases,CYP450s)在昆虫对寄主植物的适应性进化中发挥重要作用[9]。细胞色素P450单加氧酶系是多功能氧化酶系的末端氧化酶,催化NADPH相关的氧化还原裂解,产生功能化的产物和水[10],最早发现于哺乳动物肝微粒体内[11],后来发现其在昆虫中也广泛存在[12]。目前已在昆虫中鉴定出300多种细胞色素P450,它们分布于48个细胞色素P450家族中,包括CYP4、CYP6和CYP9等,某些昆虫基因组可以包含多达100个P450基因,这些基因对昆虫降解萜类、生物碱和棉酚等植物次生物质及杀虫剂具有重要作用[13]。RNAi(RNA interference)技术能抑制供试生物体内靶标基因的表达,是通过基因沉默研究基因功能的有效工具,也是能够应用于害虫防治的最有前景的生物工程技术[14],至今已有许多报道[15,16],如在棉花中表达棉铃虫Helicoverpaarmigera细胞色素P450基因CYP6AE14的dsRNA,可以显著降低棉花对棉铃虫的寄主适合度;表达烟粉虱BemisiatabaciBtQ56基因dsRNA的烟草,能显著抑制烟粉虱存活和产卵[17,18]。
前期我们获得了取食不同适合度寄主的桃蛀螟的中肠转录组数据库,并从中筛选到了一条差异表达的P450基因CYP4G113,当桃蛀螟取食适合度较高的寄主植物时,该基因表达量显著降低,而取食适合度较低的寄主植物时,该基因表达量显著升高(未发表数据),因此我们推测该基因应该与幼虫的寄主适应性相关。但有关该基因的表达特征及其在桃蛀螟寄主适应性中的作用,目前尚未见研究报道。本研究利用分子克隆、qRT-PCR和RNAi技术,研究了桃蛀螟中肠解毒酶基因CYP4G113的序列特征、表达规律及在桃蛀螟取食、适应寄主植物过程中所发挥的作用,研究结果不仅可为阐明多食性昆虫的寄主适应机理提供依据,也可为基于RNAi的害虫控制提供新的靶标基因。
1 材料与方法
1.1 供试昆虫
试验所用桃蛀螟为室内连续饲养多代的敏感品系(不接触任何杀虫药剂),其幼虫用新鲜玉米进行喂养,成虫饲料为8%蔗糖水。饲养环境条件为:温度(27±1)℃、相对湿度(75±5)%、光周期14L:10D[19]。
1.2 桃蛀螟CYP4G113克隆与序列分析
利用 TRIZOL法(Invitrogen)提取桃蛀螟4龄幼虫总RNA,1.5%琼脂糖凝胶电泳和 NanoDrop1000分光光度计(赛默飞世尔科技(中国)有限公司)检测RNA质量和浓度合格后,采用Fastking RT Kit(with gDNase)(天根生化科技(北京)有限公司)反转录试剂盒合成cDNA。由于转录组测序所获得CYP4G113的开放阅读框是一条非完整的 ORF,因此根据 NCBI上提交的稻纵卷叶螟Cnaphalocrocismedinalis CYP4G113基因序列(GenBank登录号:KP001144.1)和转录组数据比对后,再利用Primer 5.0软件,设计桃蛀螟CYP4G113ORF的特异性扩增引物CYP4G113-F和CYP4G113-R(表1)。以合成的cDNA为模板进行PCR扩增,PCR反应体系为:PrimeSTAR® Max DNA Polymerase 12.5 μL(TaKaRa),上下游引物(10 μmol/L)各1 μL,cDNA模板1 μL,ddH2O 9.5 μL。反应程序条件为:98 ℃预变性5 min;98 ℃变性10 s,51 ℃退火10 s,72 ℃延伸30 s,40个循环;最后72 ℃延伸7 min。利用1.5 %琼脂糖凝胶电泳检测目的条带后,切胶回收,将胶回收产物与pClone 007载体(北京擎科新业生物技术有限公司)连接后,转化入大肠杆菌感受态细胞Top10(生工生物工程上海股份有限公司),涂布到含有氨苄青霉素(Amp)的LB固体培养基,37 ℃培育过夜,经蓝白斑筛选,将筛选得到的阳性克隆在含有Amp的LB液体培养基中37 ℃,180 r/min培养12 h后,提取质粒送往生工生物工程(上海)股份有限公司进行测序,将得到的测序结果与之前获得的转录组序列进行比对。
通过NCBI网站上的Blast程序对获得的桃蛀螟CYP4G113cDNA序列进行比对;利用在线网站ExPASy(http://web.expasy.org/compute_pi/)预测该基因所编码蛋白的等电点和分子量;利用MEGA 7.0软件中的邻位相连Neighbor-Joining(NJ)法分析该基因与其他已报道昆虫CYP4G亚家族的氨基酸序列的系统进化关系。
1.3 桃蛀螟CYP4G113在不同发育阶段和不同组织的表达
分别收集桃蛀螟卵(400粒)、1龄(80头)、2龄(40头)、3龄(20头)、4龄(10头)、5龄(6头)第一天幼虫、蛹(化蛹后第一天,6头)以及成虫(羽化后第一天,6头),用于分析CYP4G113在桃蛀螟不同发育阶段的表达量;同时收集桃蛀螟4龄幼虫的头、唾液腺、中肠、脂肪体、表皮和血淋巴等组织,用于分析CYP4G113在桃蛀螟幼虫不同组织中的表达量。每种样品设置3个生物学重复,提取上述样品的RNA后,反转录合成cDNA备用,方法同1.2。
根据克隆获得的桃蛀螟CYP4G113序列,运用Primer 5.0软件设计荧光定量PCR所用目的基因引物CYP4G113-q-F和CYP4G113-q-R,同时以桃蛀螟甘油醛-3-磷酸脱氢酶(Glyceraldehyde 3-phosphate dehydrogenase,GAPDH)基因(GenBank登录号:KX668532.1)作为内参基因,设计内参基因引物GAPDH-F和GAPDH-R(表1),目的基因引物和内参基因引物的扩增效率分别为99.3 %和102.6 %,线性相关系数r分别为0.9971和0.9912。以各样品反转录cDNA为模板,利用SuperReal PreMix Plus (SYBR Green) 试剂盒(天根生化科技北京有限公司)进行qRT-PCR,反应体系:2×SuperReal PreMix Plus 10 μL,上下游引物(10 μM)各 0.6 μL,50×ROX Reference Dye 0.4 μL,cDNA 模板 1 μL,RNase-Free ddH2O 7.4 μL。扩增参数:95 ℃ 预变性15 min;95 ℃ 10 s,60 ℃ 32 s,共40个循环,每个生物学重复进行3次技术重复,即在荧光定量PCR加样时每个生物学重复平行加3孔,进行检测3次。
1.4 CYP4G113被干扰后对桃蛀螟生长发育的影响
利用 Primer 5.0软件,在基因功能区设计目的基因特异性引物 dsCYP4G113-F、dsCYP4G113-R、T7-dsCYP4G113-F和 T7-dsCYP4G113-R以及增强型绿色荧光蛋白(Enhanced green fluorescent protein,EGFP)基因的特异性引物dsEGFP-F、dsEGFP-R、T7-dsEGFP-F和T7-dsEGFP-R(表1)。以测序验证正确的CYP4G113质粒和实验室已有的EGFP质粒为模板,引物组合dsCYP4G113-F与T7-dsCYP4G113-R、T7-dsCYP4G113-F与dsCYP4G113-R以及dsEGFP-F和T7-dsEGFP-R、T7-dsEGFP-F和dsEGFP-R,按照1.2方法分别进行两个基因正义链和反义链的PCR扩增,琼脂糖凝胶电泳检测目的条带后,利用SanPrep柱式PCR产物纯化试剂盒(生工生物工程上海股份有限公司)纯化PCR产物。之后按照T7 Ribo MAXTMExpress RNAi System试剂盒说明书(Promega)合成CYP4G113双链RNA(dsCYP4G113)和EGFP双链RNA(dsEGFP)。最后用无RNA酶将合成双链RNA浓度稀释为3 μg/μL,分装后放入-80 ℃冰箱备用。

表1 本研究所用引物Table 1 Primers used in this study
选取发育一致的4龄第1 d的桃蛀螟健康幼虫,使用注射器在幼虫腹部第二节节间膜处分别注射2 μL的dsCYP4G113和dsEGFP(浓度3 μg/μL),12、24、48 h后分别收集不同处理幼虫各5头,按照1.2所述方法提取RNA,反转录后,利用qRT-PCR检测注射不同时间后CYP4G113的被干涉效率,每个处理包含3个生物学重复,每个生物学重复包括5头试虫,每个生物学重复设置3次技术重复。取另一批4龄桃蛀螟的健康幼虫,采用上述同样方法注射dsCYP4G113和dsEGFP,每个处理设置3个生物学重复,15头试虫为1个生物学重复,每个处理共计观察45头试虫。之后将经过不同处理的幼虫单头饲养在新鲜玉米穗上,每天观察并记录幼虫存活及生长发育情况,直至成虫死亡。
1.5 数据统计与分析
对荧光定量PCR基因相对表达量采用2-ΔΔCT法[20]进行分析。应用Excel软件整理数据,并使用SPSS 20.0软件进行统计分析,单因素方差分析法进行差异显著性检验(P<0.05为差异显著,用*表示;P<0.01为差异极显著,用**表示),数据表示为平均值±标准误。处理后的数据采用GraphPad Prism 7.0作图。
2 结果与分析
2.1 桃蛀螟CYP4G113基因的序列分析
以桃蛀螟幼虫 cDNA为模板,克隆获得了CYP4G113ORF片段,经琼脂糖凝胶电泳检测,发现在1700 bp左右有一条亮带(图1),大小与预测片段大小(1707 bp)相符。
图1 桃蛀螟CYP4G113 PCR扩增产物的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis image of PCR amplification product of CYP4G113 in C.punctiferalis
测序获得的桃蛀螟CYP4G113ORF全长1707 bp,其在GenBank中的登录号为MT721971。该基因共编码 568个氨基酸,预测分子量和等电点分别为64.59 kDa和8.54,其编码的氨基酸含有昆虫细胞色素P450蛋白的典型保守结构区域:第140~144位氨基酸(C螺旋区域)、第359~369位氨基酸(I螺旋区域)、第423~429位氨基酸(K螺旋区域)、第479~486位氨基酸(Meander区域)和第498~507位氨基酸(血红素结合区)(图2)。

图2 桃蛀螟CYP4G113核苷酸和氨基酸序列Fig.2 The nucleotide and amino acid sequence of CYP4G113 of C.punctiferalis
2.2 桃蛀螟CYP4G113氨基酸序列系统进化树构建
以柑橘全爪螨PanonychuscitriCYP4CF1为外类群,通过MEGA 7.0软件中的邻位相连法构建了桃蛀螟CYP4G113与其他15种昆虫的细胞色素CYP4G亚家族的系统进化树(图3)。结果表明,桃蛀螟首先与稻纵卷叶螟聚为一支,说明其遗传距离最近,与黄粉虫Tenebriomolitor的遗传距离较远。
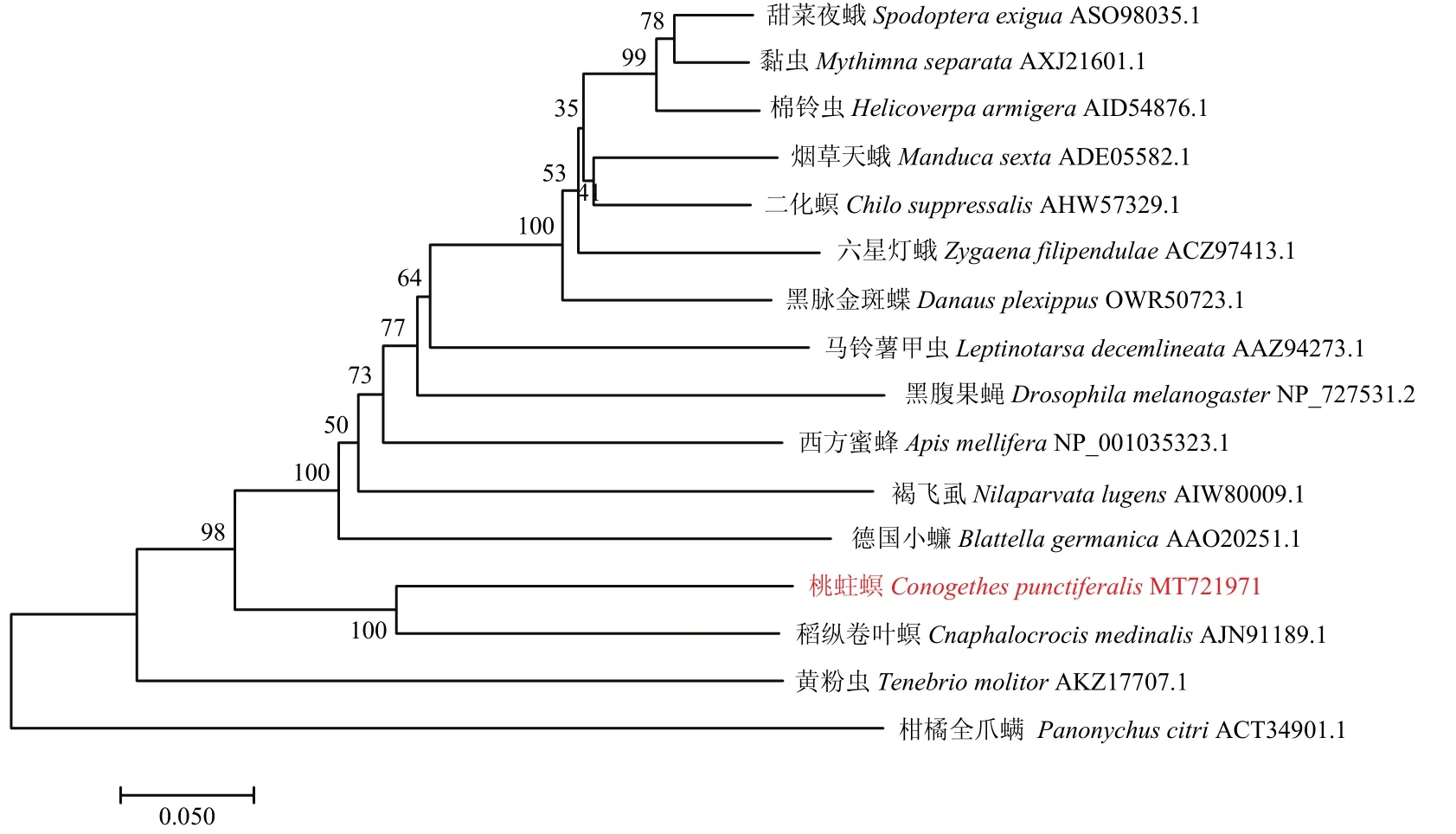
图3 昆虫CYP4G亚家族氨基酸序列系统发育树Fig.3 Phylogenetic tree of amino acid sequence of insect CYP4G subfamily
2.3 桃蛀螟CYP4G113基因的表达谱分析
由研究结果(图4)可以看出,CYP4G113在不同发育阶段的桃蛀螟中均有表达。其中在卵和5龄幼虫中相对表达量最低,在1龄幼虫中相对表达量最高,为5龄幼虫的85倍,2龄幼虫次之。在幼虫阶段,CYP4G113相对表达量随龄期增长逐渐降低,进入蛹期后表达量再度升高,其表达量与3龄和4龄幼虫的表达量相当,羽化后复又下降,蛹期表达量约为成虫期表达量的 3.8倍(图 4A)。在幼虫不同组织中,CYP4G113在唾液腺中的相对表达量最高,在头部和血淋巴中的相对表达量最低,其在唾液腺中的表达量为头部的113.3倍,在中肠和脂肪体中的表达量是头部的5.7倍(图4B)。

图4 CYP4G113在桃蛀螟不同发育阶段和不同组织中的相对表达量Fig.4 The relative expression level of CYP4G113 in different developmental stages and larval tissues of C.punctiferalis
2.4 dsCYP4G113对桃蛀螟CYP4G113表达量及生长发育的影响
幼虫体内注射dsCYP4G113能显著抑制桃蛀螟CYP4G113的表达(图5)。注射48 h后,对CYP4G113的抑制效率最高,基因表达量下降了72.08 %。同步观察幼虫发现,注射24 h后,部分虫体颜色逐渐加深,有的不能正常生长发育而死亡(图5B)。CYP4G113被干扰后24 h、48 h和72 h,幼虫的存活率显著或极显著降低(P<0.05或P<0.01)。同时发现,注射dsCYP4G113的幼虫的化蛹率也显著下降(P<0.01)。但4龄幼虫发育至蛹的历期、蛹重、蛹历期、羽化率和成虫寿命等生长发育参数在dsCYP4G113处理后与对照无显著差异(P>0.05)(表2)

表2 注射dsRNA后桃蛀螟生长发育情况Table 2 The development of C.punctiferalis after injected dsRNA
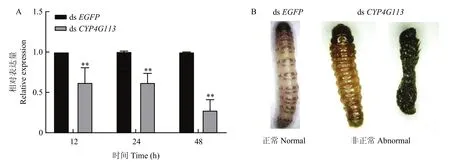
图5 dsRNA处理后桃蛀螟CYP4G113的表达水平及桃蛀螟幼虫表型变化Fig.5 The relative expression level of CYP4G113 in C.punctiferalis and phenotypic changes of C.punctiferalis larvae after dsRNA injection
3 讨论
细胞色素P450介导的多功能氧化酶是昆虫主要的解毒酶之一[21],参与昆虫对异源物质的代谢和生物活性分子的生物合成[22,23],在昆虫寄主适应性和抗药性方面发挥着重要作用。如取食含有2-十三烷酮和槲皮素两种植物次生物质的人工饲料的棉铃虫,其细胞色素P450CYP6B6过量表达,表明该基因在棉铃虫对植物次生物质代谢中起着重要作用[24];用特定浓度的毒死蜱和高效氯氟氰菊酯处理苹果蠹蛾Cydia pomonella3龄幼虫,可诱导CYP9A61表达量显著升高[25]。本研究克隆获得的桃蛀螟CYP4G113基因,含有细胞色素P450的典型保守结构区域以及CYP4家族的特征序列VDTIMFEGHDT[26],其与稻纵卷叶螟的亲缘关系最近,表明这两个基因可能有共同的祖先。
细胞色素 P450基因在昆虫体内具有分布多样性,有的基因只在昆虫的特定生长发育阶段和特定组织内表达,有的基因可在昆虫的整个发育阶段和不同组织内表达[27]。如CYP4M51和CYP6AB56在甘蓝夜蛾Mamestrabrassicae的不同发育阶段和不同组织内均有所表达,而CYP4S4仅在甘蓝夜蛾的触角内表达[28,29]。本研究通过分析CYP4G113在mRNA水平上的相对表达量发现,该基因在桃蛀螟不同时期的表达量存在明显差异,其中在1~5龄幼虫时期,表达量随幼虫龄期增长逐渐降低,1龄幼虫中CYP4G113相对表达量是5龄幼虫的85倍,可能是由于1龄幼虫首先接触到寄主植物中的次生代谢物质,因此需要CYP4G113的高度表达来使其快速适应寄主植物,以满足其自身的正常生长发育。随着虫龄增加,幼虫逐渐适应了这些次生代谢物质,因此该基因的表达量也随之降低,这种表达模式与褐飞虱NilaparvatalugensCYP303A1的表达模式极为相似[30]。组织表达分析发现,CYP4G113基因在唾液腺中的表达量最高,其次是中肠和脂肪体,在头部的表达量最低,这种现象与家蚕BombyxmoriCYP18A1主要在脂肪体和唾液腺中高表达相似[31]。由于鳞翅目昆虫唾液腺具有消化、排毒、免疫以及抵抗植物次生物质和外源有毒物质的作用[32],结合注射dsRNA后桃蛀螟幼虫的生长发育情况,因此推测CYP4G113基因可能参与了桃蛀螟唾液腺的相关生理过程,或许与对外源物质的解毒代谢有关。
CYP家族是昆虫体内重要的解毒酶基因,参与昆虫体内蜕皮激素、保幼激素以及碳氢化合物等的合成与代谢,调节昆虫的正常生长与发育[33]。研究表明,在家蚕化蛹前向其体内注射细胞色素P450CYP314A1的dsRNA,可以引起家蚕蛹变态发育受阻,暗示CYP314A1可能参与家蚕变态发育的遗传调控[34]。在豌豆蚜Acyrthosiphonpisum的人工饲料中加入细胞色素P450CYP4G51的dsRNA,可以引起豌豆蚜体表的碳氢化合物含量减少,虫体更易发生干燥,从而导致其死亡率增加[35]。本研究表明,CYP4G113基因被干扰后,其在桃蛀螟幼虫中的表达量显著下降,存活率、化蛹率等生命参数也显著降低,死亡个体均表现为虫体颜色逐渐加深,直至变黑死亡。这可能是由于CYP4G113基因被干扰后影响了桃蛀螟对寄主次生物质的代谢,因而造成有毒物质的逐渐积累,进而导致虫体发黑甚至死亡。基于该基因被干扰后桃蛀螟表现出较高的死亡率,今后可作为利用RNAi防控桃蛀螟的靶基因做进一步研究。
综上所述,桃蛀螟CYP4G113含有昆虫细胞色素P450的五大典型保守结构区域以及CYP4家族的特征序列VDTIMFEGHDT。CYP4G113在桃蛀螟低龄期表达量较高,且在唾液腺中高表达。沉默CYP4G113对桃蛀螟有明显的致死效应,表明该基因作为利用RNAi防控桃蛀螟的靶标基因,在桃蛀螟的防控新技术探索中具有潜在的应用价值。

