乳腺癌微环境中CD163标记M2型TAM和CD31标记MVD与临床病理特征的关系*
黄瑾瑾, 杨宇石, 孙紫君, 范梦蕾, 李翀瑶, 薄莉, 李小虎, 徐澍**
(1.贵州医科大学附属医院 病理科, 贵州 贵阳 550004; 2.贵阳市第二人民医院 病理科, 贵州 贵阳 550004)
乳腺癌(carcinoma of breast)来自乳腺终末导管小叶单元,是全世界女性最常见的肿瘤,也是导致女性癌症死亡的主要原因[1]。现阶段,乳腺癌治疗方式多样,但是对于转移性乳腺癌,已有的各种治疗手段的效果并不理想。三阴性乳腺癌,因缺乏ER、PR和HER-2表达,失去了内分泌治疗机会,只能采取手术和疗效有限且副作用大的传统放化疗等方式治疗[2]。因此,探索新的治疗方式就对乳腺癌患者尤为重要。研究表明,肿瘤微环境可影响肿瘤发生发展,改变肿瘤细胞生物学行为。肿瘤相关巨噬细胞(tumor associated macrophage,TAM)是肿瘤微环境中重要的免疫细胞,具有高可塑性,可经过经典激活途径极化为M1型,促进炎症及抗肿瘤作用,或是经过替代激活途径极化为M2型,调节肿瘤微环境免疫反应,与肿瘤转移和侵袭息息相关[3]。CD163属于半胱氨酸家族成员的血红蛋白清除剂受体,是M2型TAM特异性蛋白标记[4]。在结直肠癌[5]和胃癌[6]等肿瘤研究中,CD163标记M2型TAM表达密度越高、数量越多,肿瘤侵袭转移能力越强,患者预后越差;但是CD163在乳腺癌机制研究中存在争议。本研究采用免疫组化方法检测乳腺癌中CD163标记M2型TAM以及CD31标记的微血管密度(microvessel density,MVD),探讨CD163标记M2型TAM和CD31标记MVD与乳腺浸润性导管癌临床病理特征的关系。
1 材料与方法
1.1 临床资料
通过电话或门诊随访2012年1月—2014年12月病理科诊断的625例乳腺浸润性导管癌患者,随访时间最长94个月、中位随访时间68个月,随访期间收集患者有无复发、远处转移及死亡等资料。随访时间截止至2019年8月,有效随访患者138例(全部为女性),收集年龄、月经情况、肿瘤直径、TNM分期、Ki-67表达及淋巴结转移情况等临床病理特征;138例患者术前均未行放化疗及内分泌等治疗,年龄27~75岁,平均49岁、中位年龄48岁;收集肿瘤直径资料及TNM分期共109例,缺失29例,其余资料完整。收集存档切片,由两位乳腺病理专业主任医师根据中国抗癌协会乳腺癌诊治指南与规范(2019年版)诊断标准使用双盲法重新判读并分级[2],其中Luminal A型24例(ER/PR阳性,且PR阳性率>20%,HER-2阴性,Ki67增殖指数<20%),Luminal B样HER-2阴性型32例(ER/PR阳性,且PR阳性率<20%,Ki67增殖指数≥20%,HER-2阴性),Luminal B样HER-2阳性型26例(ER/PR阳性,HER-2阳性),HER-2阳性型22例(ER和PR均阴性,HER-2阳性),三阴性乳腺癌34例(ER、PR及HER-2均阴性)。138例纳入样本为癌组织组,35例癌旁正常乳腺组织作为对照(癌旁正常组织组)。
1.2 研究方法
1.2.1切片处理 鼠抗人单克隆抗体CD163一抗(北京中杉金桥,ZM-0428),鼠抗人单克隆抗体CD31一抗(北京中杉金桥,ZM-0044),检测滴度均为1 ∶100,免疫组化染色采用EnVision法。切片脱蜡脱水后,EDTA抗原修复液(pH 9.0)高压修复5 min,PBS冲洗3×3 min后,滴加过氧化氢孵育20 min,PBS冲洗3×3 min,山羊血清封闭20 min,一抗孵育过夜;复温50 min后,PBS冲洗3×3 min,二抗37 ℃孵育20 min(北京中杉金桥,PV-9000),PBS冲洗后DAB显色3 min,苏木素复染后封固。
1.2.2结果判读 CD163和CD31在胞膜和胞浆中出现粗颗粒状和片状的黄色或棕黄色着色为阳性,免疫组化结果由2位主任病理医师双盲法按照以下标准评分:(1)CD163在癌组织组及癌旁正常组织组的判读,随机选取10个高倍镜视野,计数1 000个间质细胞,以阳性细胞数1/1000为阳性百分率,阳性百分率评分标准定位0分(<1%)、1分(1%~10%)、2分(11%~25%)、3分(26%~50%)及4分(>50%);根据组织染色强度评分为阴性0分,点状淡黄色1分,粗颗粒状和片状黄色2分,棕黄色3分;强度和百分比的乘积作为免疫组化结果评分(IRS),CD163标记M2型TAM≤6分为低表达,CD163标记M2型TAM>6分为高表达[7];(2)CD31标记MVD免疫组化判读参照Weidner校正方法,取5个高倍镜视野,计数微血管数量,取其平均值为CD3l标记MVD值,统计所有病例的CD31标记MVD值,中位数为15,<15个为低密度,≥15个为高密度[8]。
1.3 统计学方法
使用SPSS 22.0软件对所有的数据进行统计学分析,使用χ2检验及Spearman法分析CD163标记M2型TAM和CD31标记MVD表达与临床病理特征的关系,使用Spearman法分析CD163标记M2型TAM和CD31标记MVD相关性,利用Kaplan-Meier法分析CD163标记M2型TAM表达和CD31标记MVD与预后的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 CD163标记M2型TAM及CD31标记MVD在癌组织组与癌旁正常组织组的表达
CD163标记M2型TAM和CD31标记MVD在癌组织组高表达率均明显高于癌旁正常组织组,差异均有统计学意义(P<0.05),见表1和图1。

表1 CD163标记M2型TAM及CD31标记MVD在癌组织组与癌旁正常组织组中的表达Tab.1 The expressions of CD163 labeled M2 type TAM and CD31 labeled MVD in the cancer tissue group and the control group
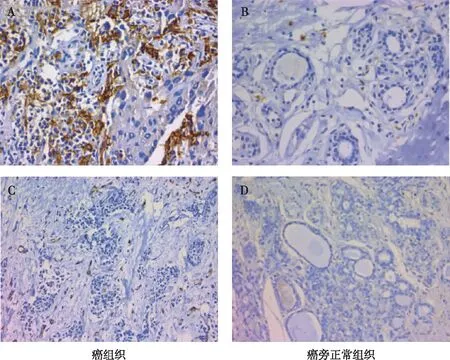
注:A为高表达(400×),B为低表达(400×),C呈高密度(200×),D呈低密度(200×)。图1 癌旁正常组织及癌组织中CD163标记M2型TAM和CD31标记MVD的表达Fig.1 CD163 labeled M2 type TAM expression and CD31 labeled MVD in adjacent normal tissues and cancer tissues
2.2 CD163标记M2型TAM与乳腺癌患者临床病理特征的关系
CD163标记M2型TAM在病理组织学分级Ⅲ级中高表达率明显高于Ⅰ级和Ⅱ级,在Ki-67增殖指数≥20%者高表达率明显高于Ki-67增殖指数<20%者,伴有淋巴结转移患者高表达率明显高于无转移者,差异均有统计学意义(P<0.05);CD163标记M2型TAM在Luminal B样HER-2阴性型、Luminal B样HER-2阳性型、HER2阳性型和三阴性型乳腺癌高表达率均明显高于Luminal A型,其中HER-2阳性型高表达率明显高于其他分子分型,差异有统计学意义(P<0.05)。CD163标记M2型TAM的表达在不同患者年龄、月经状况、TNM分期、肿瘤大小、复发远处转移及死亡等特征中比较,差异无统计学意义(P>0.05)。见表2。
2.3 CD31标记MVD与癌组织组患者临床病理特征的关系
CD31标记MVD在肿瘤直径>5 cm者高密度表达率明显高于肿瘤直2.0<~≤5 cm者和肿瘤直径≤2.0 cm者,在Ki-67增殖指数≥20%者高密度表达率明显高于Ki-67增殖指数<20%者,差异均有统计学意义(P<0.05)。CD31标记MVD在Luminal B样HER-2阴性型、Luminal B样HER-2阳性型、HER2阳性型和三阴性型乳腺癌中高密度表达率均高于Luminal A型,尤其在三阴性乳腺癌中高密度表达率更明显,差异有统计学意义(P<0.05)。CD31标记MVD的表达在不同患者年龄月经状况、TNM分期、组织学分级、淋巴结转移、复发远处转移及死亡等特征中比较,差异无统计学意义(P>0.05)。见表2。
2.4 乳腺癌患者CD163标记M2型TAM与CD31标记MVD相关性
癌组织组内CD163标记M2型TAM表达与CD31标记MVD呈正相关(r=0.180,P<0.05),见表3。
2.5 癌组织组CD163标记M2型TAM与CD31标记MVD与乳腺癌预后的关系
Kaplan-Meier法分析结果显示,CD163标记M2型TAM及CD31标记MVD与乳腺浸润性导管癌患者预后无关(P>0.05),见图2、图3。
3 讨论
体液循环中单核细胞在单核细胞集落刺激因子作用下被募集到肿瘤微环境成为TAM。巨噬细胞表面Toll样受体(TLR)、脂多糖及T辅助细胞1(Th1)细胞因子受体与病原体结合,或在干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)和粒细胞-巨噬细胞集落刺激因子(GM-CSF)等诱导下经过经典激活途径,极化为M1型TAM。M1型TAM分泌因子发挥先天免疫防御反应,杀死肿瘤细胞。在T辅助细胞2(Th2)细胞因子、细胞因子白细胞介素-4、10、13(IL-4、10、13)和转化生长因子(TGF)和前
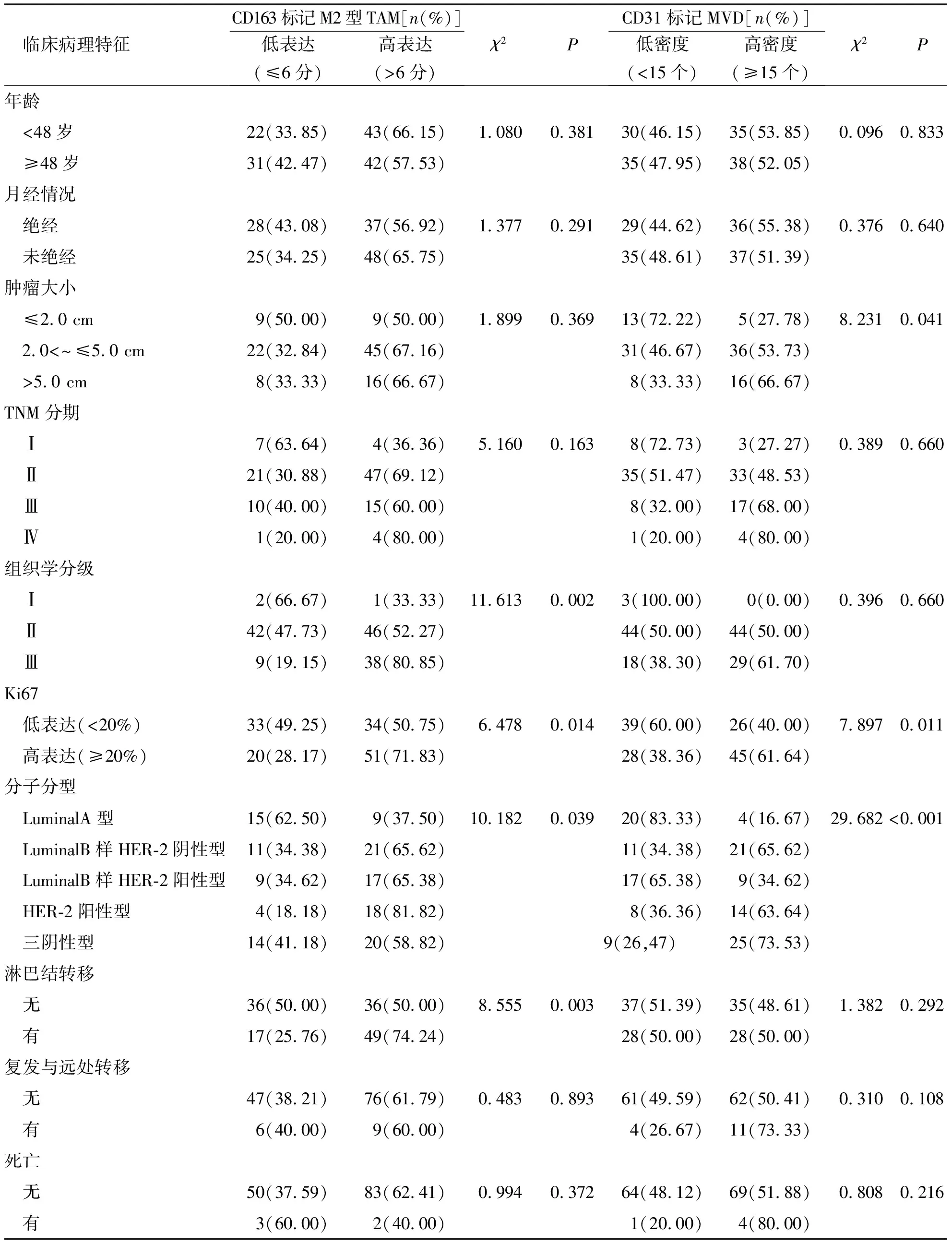
表2 CD163标记M2型TAM和CD31标记MVD与乳腺癌患者临床病理特征的关系Tab.2 The relationship between CD163 labeled M2 type TAM and CD31 labeled MVD and clinicopathological features in the cases with breast cancer

表3 138例乳腺癌患者CD163标记M2型TAM 与CD31标记MVD表达的相关性Tab.3 The correlation between CD163 labeled M2 type TAM and CD31 labeled MVD expression in the cases with breast cancer

图2 CD163标记M2型TAM表达与 乳腺浸润性导管癌预后关系Fig.2 The relation of CD163 labeled M2 type TAM and prognosis of breast cancer
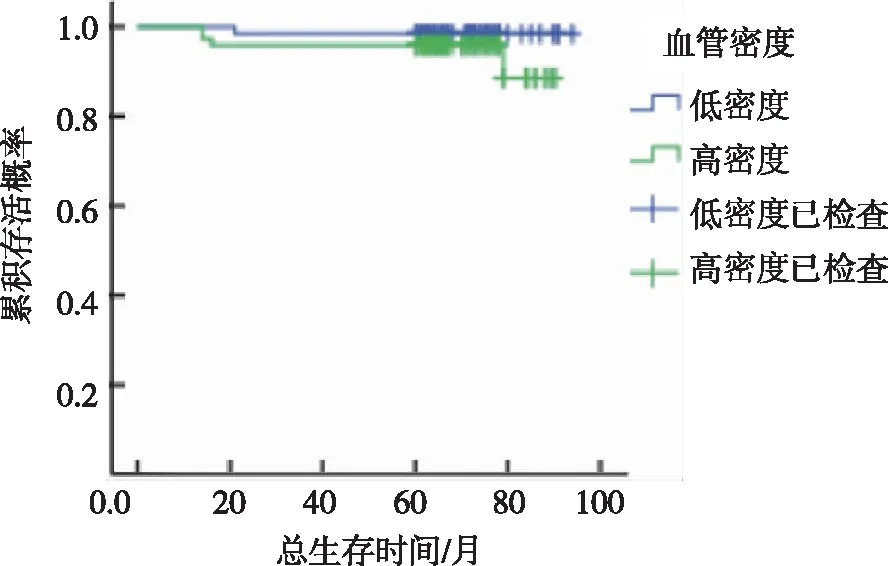
图3 CD31标记MVD与乳腺浸润性导管癌预后关系Fig.3 The relation of CD31 labeled MVD and prognosis of breast cancer
列腺素E2(PGE2)等作用下,TAM通过替代激活途径极化为M2型TAM,发挥抗炎作用、调节肿瘤微环境免疫反应、参与基质重塑、促进血管生成,与肿瘤转移和侵袭相关[3]。本实验研究发现,对比癌旁正常组织组,癌组织组微环境中CD163标记M2型TAM和CD31标记MVD明显增高(P<0.05),表明乳腺癌细胞可能通过分泌活性物质促进肿瘤微环境中巨噬细胞向M2型TAM转化。
乳腺癌相关研究已明确IL-4可介导TAM极化为M2型TAM,该实验中肿瘤细胞合成的集落刺激因子-1(CSF-1)和M2型TAM产生的表皮细胞生长因子,两者之间通过相互旁分泌作用促进肿瘤细胞侵袭能力[9]。CD163标记M2型TAM的数量与乳腺癌TNM分期、增殖能力、异质性相关[10]。已有研究表明,CD163标记M2型TAM与乳腺癌高Ki67和总体生存不良有关,与高组织学分级、淋巴结转移和HER-2表达无关,可作为非转移性乳腺癌的预后标志物[11]。而高表达的CD163标记M2型TAM与肿瘤直径以及雌孕激素受体阴性呈正相关[12];CD163标记M2型TAM还可与乳腺癌细胞协同作用,提升细胞增殖能力,促进血管生成以及肺转移[13]。本研究提示,CD163标记M2型TAM在高组织学分级、高Ki67增殖指数、有淋巴结转移、HER-2阳性型的乳腺浸润性导管癌中高表达(P<0.05)。CD163标记M2型TAM在有淋巴结转移的乳腺浸润性导管癌患者中明显高表达。提示位于血管腔侧的CD163标记M2型TAM簇可能通过促进胶原纤维形成产生蛋白酶(组织蛋白酶、金属蛋白酶等),导致肿瘤细胞溶解基底膜并沿着胶原原纤维向下迁移进入血管及脉管系统中,促进肿瘤转移[9,14]。而在乳腺导管原位癌研究中发现,CD163标记M2型TAM与HER-2阳性有关[15]。本实验发现在乳腺浸润性导管癌,CD163标记M2型TAM在HER-2阳性型乳腺癌中表达最高。可能与HER-2阳性型乳腺癌细胞产生的趋化因子2(CCL-2)诱导巨噬细胞活化而上调整合位点家族成员1(Wnt-1),下调E-钙黏蛋白(E-cadherin),导致肿瘤扩散有关,因此认为HER-2可能通过活化TAM,尤其是M2型TAM,导致肿瘤细胞增殖及转移[16]。提示CD163标记M2型TAM介导的微环境对乳腺癌恶性生物学行为演进产生重要影响。在本组研究中,虽然没有观察到CD163标记M2型TAM和肿瘤预后的关系,这可能与本组入组研究病例少有关系。
血管生成是肿瘤生长发展的先决条件,在实体肿瘤中,血管形成机制非常复杂。通常CD31、CD34和Ⅷ因子均已用来评估MVD,CD31比Ⅷ因子标记微血管更加可靠。有研究认为,CD31标记MVD与乳腺癌肿瘤大小、淋巴结转移、复发和总体生存率相关,是乳腺癌患者预后不良重要因素[17]。有研究显示,CD31标记MVD与临床病理特征无关,并不是评价乳腺癌的重要预后因素[18]。尽管乳腺癌中MVD研究结论不一致,但临床试验证实抗血管生成疗法对乳腺癌患者有一定的作用,特别是在HER-2阴性患者[17]。本研究提示,CD31标记MVD在较大肿瘤直径、高Ki67增殖指数和HER-2阳性型及三阴性乳腺浸润性导管癌中高表达,且在三阴性乳腺癌中高表达更明显。这可能是因为当肿瘤细胞快速生长时,肿瘤间质不能满足肿瘤细胞生长血液供应,肿瘤处于缺氧状态,缺氧诱导肿瘤细胞自身产生血管内皮生长因子,同时肿瘤细胞通过糖酵解的方式产能并通过堆积乳酸进一步促进内皮细胞表达血管内皮生长因子(VEGF)受体,VEGF与周围内皮细胞表达的VEGF受体结合后诱导血管生成[9]。另外,肿瘤干细胞也可能通过向内皮细胞去分化及分泌血管生成因子促进血管生成[19]。本组研究没有观察到血管和肿瘤预后的关系,可能与本组入组研究病例少,临床治疗方法提高改变了肿瘤自然病程等因素有关系。
TAM是控制肿瘤血管生成的关键细胞,M2型TAM转录谱分析表明,它们在编码血管生成分子的转录中高度富集[14]。在乳腺癌、黑色素瘤、肺腺癌及胃癌等人体恶性肿瘤中,TAM浸润与血管生成呈正相关[20]。本组研究提示,乳腺癌微环境中CD163标记M2型TAM与CD31标记MVD呈正相关(r=0.180,P<0.05)。这可能是因为肿瘤微环境使TAM主要极化为M2型TAM,从而有效促使血管生长因子表达升高,在乳腺癌缺氧区域,TAM特异性的产生VEGF-A,在非缺氧区域,TAM产生白介素-1β(IL1β)诱导肿瘤细胞VEGF-A释放,参与肿瘤血管生成。除VEGF外,TAM还可释放其他促血管生成因子,包括TNFα、碱性成纤维细胞生长因子(bFGF)、胸苷磷酸化酶(TP)、尿激酶型纤溶酶原激活剂(uPA)、肾上腺髓质素(ADM)以及信号蛋白4D(Sema4D)等因子。另外,TAM可诱导肿瘤细胞启动血管生成程序,肿瘤细胞和TAM在肿瘤微环境中协同作用促进血管生成因子的产生,从而促进血管生成[20]。提示乳腺癌微环境中,CD163标记M2型TAM可直接或是间接促进血管生成,影响乳腺癌恶性生物学行为。

