灯盏乙素对β淀粉样蛋白诱导的神经母细胞瘤细胞中NMDAR1表达的影响*
李晓宇, 于燕妮**, 郭莉莉
(1.贵州医科大学附属医院 病理科, 贵州 贵阳 550004; 2.贵阳市第一人民医院 病理科, 贵州 贵阳 550002)
根据世界卫生组织的统计,阿尔茨海默病(alzheimer's disease,AD)是痴呆症的最常见类型,占痴呆病例的60%~70%[1]。AD的临床表现随着时间的推移而恶化:从早期健忘到语言、方向和行为的逐渐遗忘,以及后期严重的记忆力减退和一些身体机能障碍,直至最终死亡[2]。在AD病理生理改变中,存在明显的氧化应激、线粒体异常和严重的突触损伤和神经元死亡。研究表明,通过N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor subtype, NMDARs)调控的兴奋性谷氨酸能神经传递通路对于神经元的突触可塑性和存活至关重要[3-4],但是过量的NMDARs激活引发兴奋性毒性级联反应促进细胞死亡,与AD发病的早期密切相关[5]。灯盏乙素(Scutellarin, Scu)是灯盏花中提取的药效成分,近年来的研究表明Scu有保护神经细胞的作用[6]。本课题组对Scu进行深入研究,观察到Scu能改善AD小鼠的痴呆症状[7],并利用同位素标记相对和绝对定量技术得到了Scu调控阿尔茨海默病双转基因小鼠(APPswe/PS1dE9)脑组织谷氨酸神经系统传递通路相关蛋白的重要线索[8]。鉴于谷氨酸神经系统关键突触元件NMDARs与AD的发病机制密切相关,本研究推测Scu可能通过调控NMDARs参与对神经细胞的保护作用,并采用Aβ1-42寡聚体作用于具有人神经元形态和特征的人源性神经母细胞瘤(SH-SY5Y)细胞,诱导AD神经元损伤的细胞模型,并通过检测NMDARs功能性亚基NMDAR1蛋白及mRNA表达情况,进一步探究Scu在Aβ寡聚体毒性背景下对NMDAR1的调控作用。
1 材料与方法
1.1 实验材料
实验用Scu(南京泽朗医药科技有限公司,纯度98%,批号为ZL20161012037),Aβ1-42寡聚体(强耀生物科技有限公司,纯度95.27%,货号为04010011526),人源性神经母细胞瘤(SH-SY5Y)细胞株(中国科学院昆明细胞生物研究所,编码为KCB2006107YJ),NMDAR1抗体(博士德),ROS、 T-SOD测定试剂盒(南京建成),BIO-RAD电泳设备(美国Bio-Rad),实时荧光定量PCR仪(ABI),细胞培养箱(美国Thermo Fisher)。
1.2 研究方法
1.2.1药物处理 粉末状β1-42寡聚体用预冷的六氟异丙醇(HFIP)充分溶解并分装,使终浓度为1 mmol/L,风干、-80 ℃保存,使用前加不含酚红的F12培养基充分溶解,4 ℃冰箱放置24 h后离心取上清使用[9]。 Scu精确称量分装后置4 ℃冰箱备用,使用前用高糖DMEM充分稀释并用0.22微孔注射滤器过滤。
1.2.2细胞培养、分组及处理 SH-SY5Y细胞置于完全培养液(高糖 ∶血清 ∶抗生素比例为9 ∶1 ∶0.1)培养,培养箱条件为5% CO2、37 ℃,2 d换液1次,4 d传代,取处于对数生长期细胞进行实验[10]。细胞分为对照组、Aβ寡聚体处理组、Scu处理组和Scu+Aβ寡聚体处理组[11],对照组常规培养不加任何药物处理。根据课题组前期采用细胞增值及毒性实验(CCK-8法)筛选确定本研究所用药物浓度:Scu处理组10 μmol/L Scu 作用48 h,Aβ寡聚体处理组给予1 μmol/L Aβ寡聚体作用24 h,Scu+Aβ寡聚体处理组先予10 μmol/L Scu 预处理24 h、再加入1 μmol/L Aβ作用24 h[12]。收集细胞进行检测。
1.2.3倒置相差显微镜观穿细胞 将培养的活细胞放在倒置相差显微镜载物台上,用40×放大镜观察对比各组细胞密度、轮廓胞质及分裂情况,并进行拍照记录。
1.2.4蛋白印迹(Western blot)法检测NMDAR1蛋白表达 将1.2.2步骤收集的各组细胞分别清洗3次,取适量总蛋白提取液与细胞作用,收集总蛋白,测定浓度;采用SDS-PAGE分离目标蛋白,进一步电转至甲醇预处理的聚偏二氟乙烯膜;先后与蛋白一抗(β-actin稀释比例1 ∶200、NMDAR1稀释比例1 ∶500)和二抗(二抗稀释比例1 ∶50 000)作用,显影系统观察结果 。用Bandscan分析灰度值,结果以目标蛋白条带与β-action条带的灰度比值作为目标蛋白的相对表达量。
1.2.5实时荧光定量PCR检测NMDAR1 mRNA表达水平 RNA提取: 收集细胞,Trizol试剂裂解细胞,加氯仿分层,收集水相层RNA。RNA沉淀:加异丙醇摇均沉淀RNA。RNA清洗:收集沉淀,用无RNase的75%乙醇清洗2次;RNA干燥,溶解。RNA浓度测定:取2 μL溶解后的RNA用微量分光光度计测定OD260、OD280,换算OD260/OD280比值,比值在1.8~2.0满足实验要求。RNA浓度=OD260×稀释倍数×40 mg/L,RNA于-80 ℃冰箱保存。逆转录cDNA(RNA上样质量4.884 μg)。实时荧光定量PCR检测:cDNA做6倍稀释,反应体系为稀释后cDNA 4 μL,Forward Primer (10 μmol/L) 0.4 μL,Reverse Primer (10 μmol/L) 0.4 μL,SYBR Green Master Mix 10 μL,50×ROX Reference Dye 2 0.4 μL,H2O 4.8 μL;引物序列为β-actin(Forward 5′-AGCGAG CATCCCCCAAAGTT-3′,Reverse 5′-GGGCACGAAGGCTCATCATT-3′,285 bp), NMDAR1(Forward 5′-CCGTG AGAGACAACAAGCTG-3′,Reverse 5′-ATACCGAACCCACGTCTTGT-3′,227 bp);反应条件为50 ℃ 2 min,95 ℃ 10 min,95 ℃ 30 s ,60 ℃ 30 s,40 cycles。绘制溶解曲线,最终数据以2-ΔΔCt进行分析。
1.2.6荧光探针法测定各组细胞氧自由基(ROS)水平 用PBS稀释DCFH-DA探针,调整探针浓度为10 μmol/L。收集细胞,用稀释好的DCFH-DA重悬细胞,37 ℃恒温培养箱孵育30 min,每隔5 min混匀,使探针与细胞充分接触。多功能酶标仪检测波长525 nm处荧光值,ROS荧光值与ROS的含量成正比。
1.2.7黄嘌呤氧化酶法测定各组细胞超氧化物歧化酶(T-SOD)的活力 收集各组细胞,反复冻融裂解细胞、离心,收集上清液。取96孔板,设定对照孔(蒸馏水)和测定孔(细胞上清),依次加入工作液后混匀,37 ℃孵育40 min,各管加入显色剂2 mL孵育10 min,于波长550 nm处测吸光度值并按公式换算T-SOD活力。
1.3 统计学分析
2 结果
2.1 形态学观察
如图1所示,倒置显微镜下可见对照组细胞密度较大,多数细胞呈梭形,少数细胞呈三角形,细胞轮廓清晰,树突分支较多,胞质丰富,可见分裂细胞;与对照组比较,Scu处理组细胞密度、轮廓、胞质、分裂细胞的形态变化不大,但三角形分化的细胞增加,突触缩短变粗;与对照组比较,Aβ寡聚体处理组梭形细胞及三角形细胞明显减少,部分细胞突起缩短变细,树突分支减少,胞质减少,细胞分裂少见;Scu+Aβ寡聚体处理组细胞密度及分支较Aβ寡聚体处理组增加,胞质较Aβ寡聚体处理组丰富。
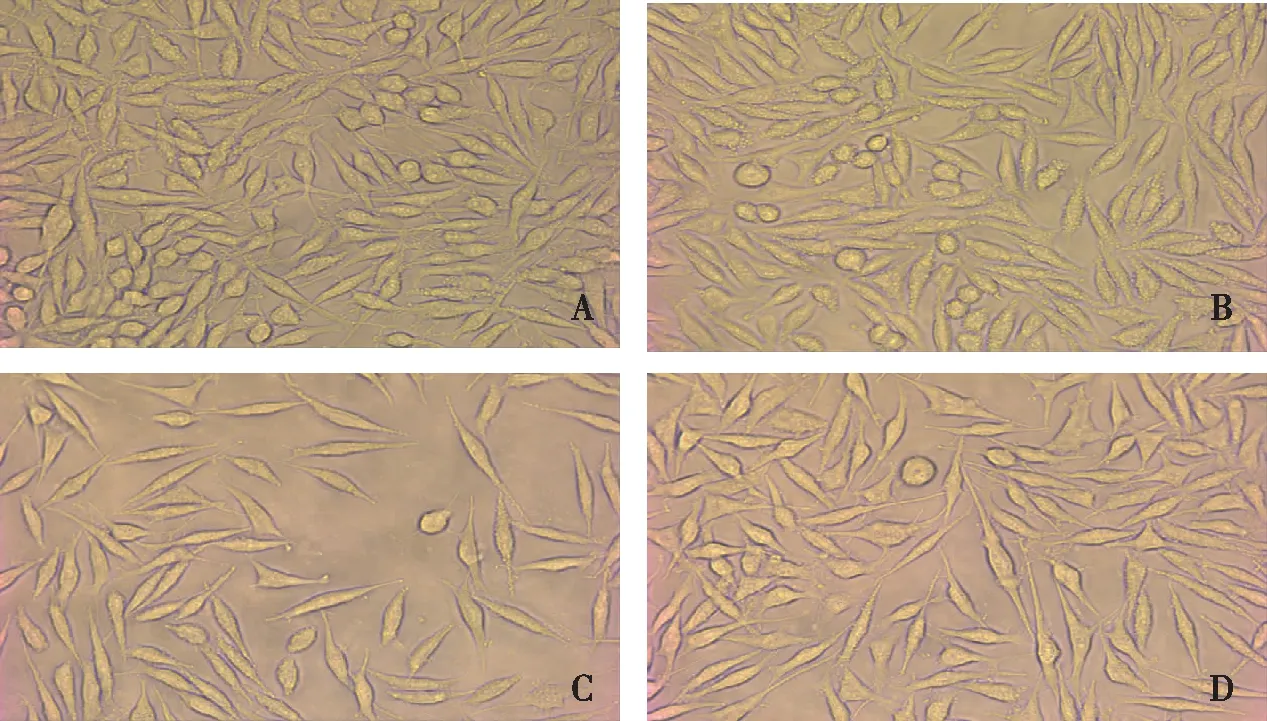
注:A为对照组,B为Scu处理组,C为Aβ寡聚体处理组,D为Scu+Aβ寡聚体处理组。图1 各组细胞培养48 h的形态学观察(倒置显微镜,×40)Fig.1 Cells of each group after 48 h of cell culture (inverted microscope,×40)
2.2 NMDAR1蛋白表达
与对照组比较,Scu处理组细胞NMDAR1蛋白表达差异无统计学意义(P>0.05),Aβ寡聚体处理组细胞NMDAR1蛋白表达升高,差异有统计学意义(P<0.05);与Aβ寡聚体处理组比较,Scu+Aβ寡聚体处理组细胞中NMDAR1蛋白表达减少,差异有统计学意义(P<0.05)。见图2和表1。

注:1-4分别为对照组,Aβ寡聚体处理组, Scu处理组,Scu+Aβ处理组。图2 NMDAR1蛋白相对表达量Fig.2 Relative expression volume of NMDAR1 protein
2.3 NMDAR1 mRNA表达
与对照组比较,Scu处理组细胞NMDAR1 mRNA表达水平差异无统计学意义(P>0.05),Aβ寡聚体处理组细胞NMDAR1 mRNA表达水平升高,差异有统计学意义(P<0.05);与Aβ寡聚体处理组比较,Scu+Aβ寡聚体处理组细胞NMDAR1 mRNA表达水平降低,差异有统计学意义(P<0.05)。见表1。
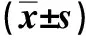
表1 各组细胞NMDAR1蛋白及mRNA表达Tab.1 NMDAR1 protein and mRNA expression
2.4 ROS含量
与对照组比较,Scu处理组细胞ROS含量差异无统计学意义(P>0.05),Aβ寡聚体处理组细胞ROS含量升高,差异有统计学意义(P<0.05);与Aβ寡聚体处理组比较,Scu+Aβ寡聚体处理组细胞ROS含量降低,差异有统计学意义(P<0.05)。见表2。
2.5 T-SOD含量
与对照组比较,Scu处理组细胞T-SOD含量差异无统计学意(P>0.05),Aβ寡聚体处理组细胞T-SOD含量降低,差异有统计学意义(P<0.05);与Aβ寡聚体处理组比较,Scu+Aβ寡聚体处理组细胞T-SOD含量升高,差异有统计学意义(P<0.05)。见表2。
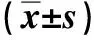
表2 各组细胞ROS和T-SOD的含量Tab.2 ROS and T-SOD content of cells
3 讨论
AD的发生机制复杂,其中基因突变学说、Aβ毒性学说、Tau蛋白异常修饰学说、氧化应激学说、线粒体障碍学说、炎症学说等已成为当前研究的焦点[13],但很少有研究关注AD的电生理特性,尤其是突触可塑性。突触可塑性是参与学习和记忆的重要机制,学习和记忆是高级神经活动的重要组成部分[14],研究表明NMDARs通过参与长时程增强和长时程减弱的形成调控突触的可塑性和神经细胞的活动[15]。NMDARs是谷氨酸兴奋信号传递的关键蛋白之一,具有3种主要亚基:NMDAR1(NR1),NMDAR2(NR2A-D)和NMDAR3(NR3)[16]。功能性NMDARs是由至少一个NR1亚基与两个或多个NR2A-D亚基组成的四聚体,有时还包括NR3亚基,NMDAR1在整个大脑和整个发育的各个阶段均表达[17]。尽管NMDARs活性是大脑生理功能所必须,但过量的NMDARs介导Ca2+超载并促进神经细胞死亡是AD发生神经退行性变的病理基础[18]。
谷氨酸是大脑主要的兴奋性神经递质,在突触传递正常的情况下,NMDARs的离子通道被Mg2+阻滞,并且仅在短时间内被谷氨酸激活,介导Ca2+适量进入细胞,参与突触可塑性和细胞存活。在病理条件下,比如突触间隙谷氨酸浓度病理性升高、NMDARs表达增加以及能改变静息膜电位的其他干扰均可能会引起NMDARs的过度激活,NMDARs的过度激活介导大量Ca2+流入神经元,从而触发各种可能导致细胞坏死或凋亡的过程[19],包括介导线粒体的Ca2+超载和半胱氨酸蛋白酶及一氧化氮合酶(nNOS)等Ca2+依赖性酶激活,导致一氧化氮(NO)产量增加[20]。线粒体Ca2+超载会破坏膜的电化学梯度,从而使ATP合成失效,呼吸链故障,导致抗氧化与氧化失衡,T-SOD减少,ROS增加,例如NO与超氧阴离子(O2·-)反应生成过氧亚硝酸盐(ONOO),后者又可以氧化脂质、蛋白质和DNA[21-22]。上述过程是NMDARs介导的兴奋性毒性级联反应,NMDARs是兴奋性毒性过程中重要的Ca2+通道,NMDARs 介导Ca2+超载损伤细胞是AD发病的重要机制之一[23-24]。
其他学者和本课题组前期研究均观察到Aβ寡聚体与神经元作用后增加Ca2+流入神经元介导细胞损伤[25-26],相同实验条件下,本研究采用Aβ寡聚体与SH-SY5Y细胞孵育后,观察到NMDAR1 mRNA及蛋白表达均增加,推测Aβ寡聚体可能调控了NMDAR1蛋白的转录程序,介导NMDAR1蛋白表达增加,Aβ寡聚体处理组还观察到细胞的氧化应激指标ROS增加和T-SOD降低,倒置显微镜下见细胞减少和突触缩短变细,提示Aβ寡聚体可能参与调控功能性亚基NMDAR1的表达介导Ca2+超载损伤神经细胞。美金刚是目前世界公认的可用于中重度AD患者改善记忆和认知缺陷的药物[27-28],其治疗作用的关键在于可与NMDARs的非竞争性结合,研究表明美金刚与NMDARs通道为低亲和力结合,抑制NMDARs通道的同时逐步解离失效以保留了部分NMDARs的生理功能,从而增强了美金刚的耐受性并且降低不良事件发生[29]。本研究用Scu预处理后,下调了Aβ寡聚体处理组NMDAR1蛋白的转录和表达,缺乏NMDAR1亚基的NMDARs不能正常介导Ca2+内流,但本研究结果提示Scu并不是完全中断NMDAR1表达,仍然保留NMDAR1的活性,有类似于“美金刚”改善神经元损伤的作用,Scu+Aβ寡聚体处理组还观察到ROS减低和T-SOD增加,提示细胞的氧化应激得到改善,其次该组细胞密度及树突分支较Aβ寡聚体处理组增加,佐证了本研究上述推测。所以本研究认为Scu可能参与下调功能性亚基NMDAR1蛋白的转录、翻译,从而对抗Aβ寡聚体的毒性作用。

