艾迪注射液对H22肝癌模型小鼠组织中阿霉素和阿霉醇分布的影响*
王艳丽, 朱晓青, 孙佳, 李勇军, 刘春花, 陆苑**
(1.贵州医科大学 贵州省药物制剂重点实验室 & 省部共建药用植物功效与利用国家重点实验室, 贵州 贵阳 550004; 2.贵州医科大学 药学院, 贵州 贵阳 550004; 3.贵州医科大学 民族药与中药开发应用教育部工程研究中心, 贵州 贵阳 550004)
肝细胞癌(hepatocellular carcinoma, HCC)是全球发病率第6、死亡率第4的恶性肿瘤疾病[1],由于其具有较强的隐匿性,多数HCC患者就诊时病情已达晚期[2]。尽管已经研究出多种针对HCC的治疗手段,但对于无法切除的中晚期HCC,可供选择的治疗方式非常有限,药物化疗依然是主要的手段[3]。阿霉素(doxorubicin, DOX)是HCC常用的化疗药物之一,但其临床应用受到以心脏毒性为主的多种毒副作用的限制[4],DOX的主要活性代谢产物阿霉素醇(doxorubicinol, DOXol)是造成心脏毒副作用的主要原因[5]。艾迪注射液(aidi injection, ADI)是癌症治疗中常用的中药制剂之一,由斑蝥、人参、黄芪、刺五加提取物组成,具有益气扶正、祛邪攻毒的功效,在《原发性肝癌诊疗规范》(2019年版)中也明确将ADI纳入辅助治疗药物之一[6],研究认为ADI联合化疗药物可降低后者的毒性,提高临床疗效,改善患者生存质量[7-8]。长期联合用药时,中药易对药物代谢动力学的体内过程产生影响,改变药物体内分布,影响治疗效果甚至造成毒副作用[9]。课题组前期研究发现ADI和DOX联用时,ADI能够显著提高二乙基亚硝胺(n-nitrosodiethylamine,DEN)诱导的HCC大鼠体内DOX和DOXol的血药浓度[10]。鉴于有关ADI对DOX和DOXol在机体内其它部位分布的研究报道较少,再加上DEN诱导的动物肝癌模型建模周期长、造模过程中死亡率较高等缺点[11-12],本研究采用H22细胞肝癌模型小鼠,进一步探究ADI与DOX联用对DOX和DOXol药物的体内分布影响,为ADI与DOX的合理临床用药方案奠定理论基础。
1 材料与方法
1.1 仪器与材料
1.1.1仪器 ACQUITY UPLC型超高效液相色谱-三重四级杆质谱串联仪(美国Waters),Forma 905-ULTS1490型医用低温冰箱(美国 Thermo Fisher),ALLEGRA X-30R型离心机(美国Beckman Coulter),IMS-20全自动雪花制冰机(常熟市雪科电器有限公司),KQ-300DE型超声波清洗器(昆山市超声仪器有限公司),ZH-2型涡旋混合器(天津药典标准仪器厂),XYN-15LP型氮吹仪氮气发生器(上海析友分析仪器有限公司)。
1.1.2材料 H22小鼠肝癌细胞株购自武汉普诺赛生命科技有限公司,艾迪注射液(批号20200303,规格10 mL/支)由贵州益佰有限责任公司提供,注射用盐酸多柔比星(批号1910E1)购自深圳万乐药业有限公司,阿奇霉素(纯度>98%,批号 J1229A)购于大连美仑生物科技有限公司,阿霉素醇对照品(纯度>98%,批号 GC43565)购于美国 GlpBio公司,色谱级甲酸购于天津市科密欧化学试剂有限公司,色谱乙腈购自德国Merck公司,其余溶剂均为分析纯。
1.1.3实验动物 SPF级雄性ICR小鼠(18~22 g),购自辽宁长生生物技术股份有限公司,许可证编号SCXK(辽)2020-0001。动物于实验前饲养在相对温度18~25 ℃,相对湿度50%~70%的环境中,所有动物养护和实验研究均严格遵守国家卫生研究院动物养护和使用指南,并经贵州医科大学动物伦理委员会批准(1801207)。
1.2 研究方法
1.2.1H22细胞培养及收集 H22细胞用含10%胎牛血清(FBS)和1%青链霉素的RPMI-1640培养基,在37 ℃、5% CO2细胞培养箱中培养传代,细胞悬浮生长,每2~3 d传代1次;将细胞收集至离心管中,于1 000 r/min离心5 min,离心后吸去上清液,管底细胞沉淀加入适量培养基重悬后置于培养箱培养;收集对数生长期细胞,通过台盼蓝进行染色,细胞存活率需大于95%,使用PBS调整细胞浓度至1×107个/mL,用于动物实验。
1.2.2动物造模及分组给药 取24只健康雄性ICR小鼠,体质量18~22 g,取1.2.1项下获得的H22细胞悬液0.2 m射于小鼠右侧腋皮下,当小鼠腋下长出米粒大小包块即造模成功。造模成功以后将小鼠随机分为DOX单次给药组(SDOX组)、DOX多次给药组(MDOX组)和ADI联合MDOX组(AMDOX组),SDOX组连续14 d每天腹腔给予20 mL/kg生理盐水、于第15天腹腔注射3 mg/kg DOX,MDOX组连续15 d隔天腹腔注射3 mg/kg的DOX,AMDOX组连续15 d每天腹腔注射20 mL/kg ADI,隔天腹腔注射3 mg/kg DOX,观察各组小鼠的一般状况。分别于末次给药2 h后眼眶取血,在室温下静置约20 min,离心(3 000 r/min,20 min)后收集上清备用,于-20 ℃冷冻保存。脱颈处死小鼠,取肿瘤、心、肝、肾等组织,清洗残血称重后,将各组织与生理盐水按1 ∶2的重量比进行匀浆,匀浆液于-20 ℃保存备用,临用前解冻。
1.2.3溶液配制及样品处理 DOX标准溶液:精密称取DOX对照品适量,加50%甲醇充分溶解,得1 g/L的 DOX储备液,-20 ℃保存备用。DOXol标准溶液:在1 mg的DOXol对照品瓶中加入50%甲醇1 mL充分溶解,转移至5 mL的容量瓶中定容至刻度,得200 mg/L的DOXol储备液,分装为1 mL/支,-80 ℃保存;取一支储备液定容至10 mL,得浓度为20 mg/L的DOXol标准溶液,-20 ℃保存备用。 内标溶液配制:精密称阿奇霉素适量至5 mL容量瓶中,用30%甲醇溶解并定容至刻度,得100 mg/L的内标溶液,-20 ℃保存备用。
1.2.4样品处理 100 μL血清和组织匀浆液室温融化后,加入20 μL的内标溶液,用5%的甲酸甲醇500 μL进行蛋白沉淀,涡混1 min,于-20 ℃冷冻30 min,超声5 min,14 000 r/min 离心10 min,上清液用氮气吹干,残渣溶于50%甲醇500 μL溶液中、14 000 r/min离心10 min,用UPLC-MS/MS分析。
1.2.5分析方法 根据课题组前期确定的分析方法进行本次实验研究[10,13],UPLC色谱条件采用Acquity UPLC BEH C18(2.1 mm×50 mm,1.7 μm),流动相为0.1%甲酸乙腈(A)-0.1%甲酸水(B),梯度洗脱条件为0~0.5 min、10%~30% A,0.5~1.5 min、30%~60% A,1.5~2.0 min、60%~90% A,2.0~3.0 min、90%~10% A,3.0~4.0 min、10%~90% A,4.0~5.0 min、90%~5% A;柱温45 ℃,流速0.35 mL/min,进样体积2 μL。质谱条件采用电喷雾电离源(ESI),选择多反应离子监测模式(MRM)正模式;去溶剂气氮气,流速10 00 L/h,温度600℃;碰撞气氩气,流速50 L/h;检测离子DOX [M+H]+为m/z 544.7,DOXol [M+H]+为m/z 546.3,阿奇霉素[M+H]+为m/z 749.6,锥孔电压分别为 25、30、30 V,碰撞电压分别为 25、25、25 eV。
1.3 统计学分析
采用GraphPad Prism 8.0.1软件对各组结果进行统计分析,P<0.05代表结果差异具有统计学意义。
2 结果
2.1 H22移植瘤小鼠体内DOX的组织分布
与SDOX组小鼠比较,MDOX组小鼠各组织中DOX的含量均显著增加,差异有统计学意义(P<0.05);与MDOX组比较,ADOX组小鼠肿瘤中DOX含量明显增加,差异有统计学意义(P<0.05),表明ADI增强DOX肿瘤治疗效果可能是通过增加DOX在靶部位药物浓度而实现;ADI与DOX联用后,DOX在其余组织中均表现出降低趋势,其中以血清和心脏中变化最为显著,说明ADI降低DOX的心脏毒性作用可能是通过降低DOX在心脏中的蓄积实现(由于血清中DOX和DOXol的含量相比其它组织较低,故图中未表现)。见表1和图1。
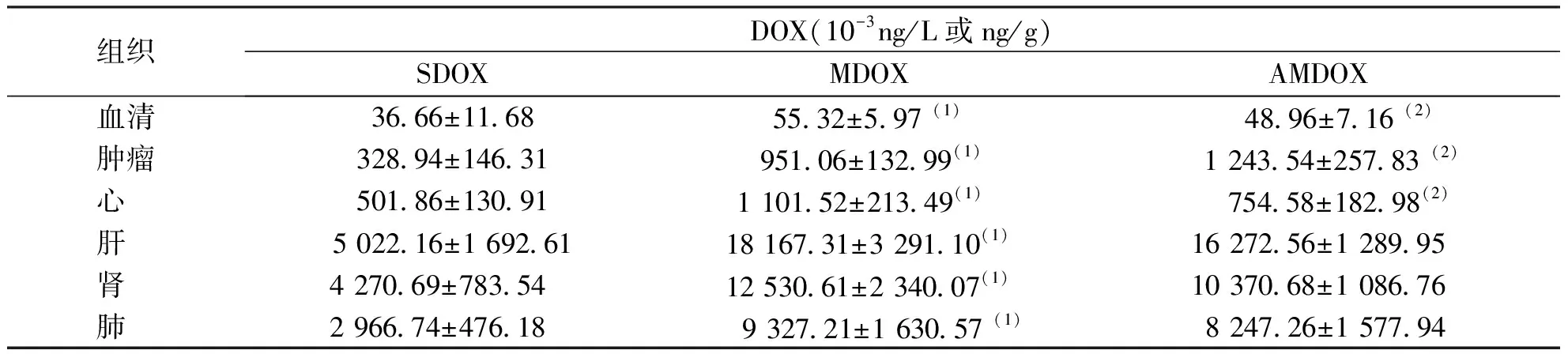
表1 3组H22移植瘤小鼠各组织中DOX的含量(n=6)Tab.1 The concentrations of DOX in H22 HCC-bearing mice in each group(n=6)
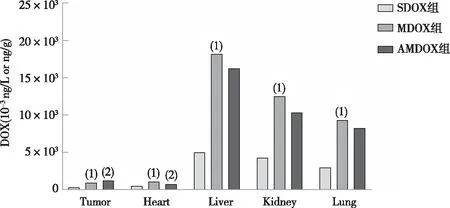
注:(1)与SDOX组比较,P<0.05;(2)与MDOX组比较,P<0.05。图1 H22移植瘤小鼠各治疗组中阿霉素的分布Fig.1 Biodistribution of DOX in H22 HCC-bearing mice in each group
2.2 H22移植瘤小鼠体内DOXol的组织分布
除DOXol在血清中的含量低于定量限外,其余组织部位均能准确检测DOXol的含量。结果表明,与SDOX组小鼠比较,MDOX组小鼠各组织中DOXol的蓄积均明显增加;联合用药后,DOXol除在肿瘤中的含量有增加趋势外,其余组织中均表现出不同程度的降低,其中以心脏和肺的累计变化最为显著,表明ADI发挥增效作用可能是通过提高DOXol在肿瘤部位的分布达到目的;此外,ADI还能在不同程度上减少DOXol在其它部位的蓄积。见表2和图2。
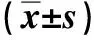
表2 3组H22移植瘤小鼠各组织中DOXol含量Tab.2 The concentrations of DOXol in H22 HCC-bearing mice in each
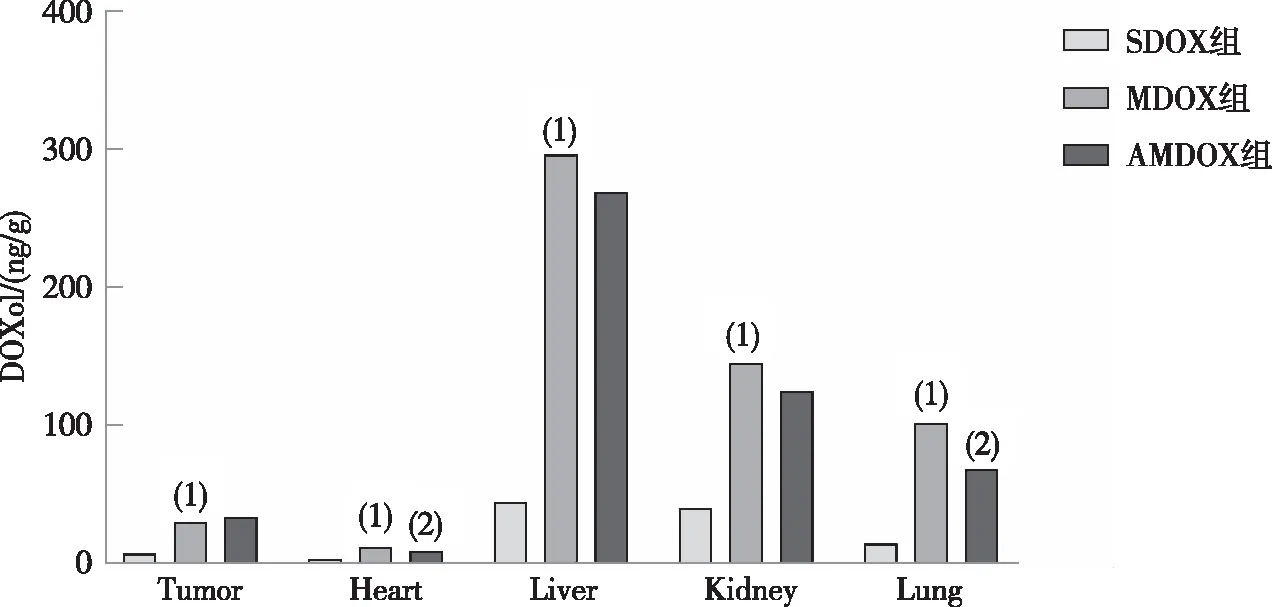
注:(1)与SDOX组比较, P<0.05;(2)与MDOX组比较,P<0.05。图2 H22移植瘤小鼠各治疗组中阿霉素醇的分布(n=6)Fig.2 Biodistribution of DOXol in H22 HCC-bearing mice in each group(n=6)
3 讨论
HCC是最常见的原发性肝癌,具有高复发率、高转移率、隐匿性强以及预后差等特点[2]。其发病机制复杂,治疗选择也趋于多样化,目前主要包括手术切除、肝脏移植、局部消融、肝动脉介入、放射治疗和全身疗法[14]。在这些选择中,尽管手术切除和肝移植是首选的治疗方法,但却只适用于15%的HCC患者[15]。多数患者就诊时病情已达晚期,此时以药物化疗为主的全身治疗最被认可[3]。然而多数化疗药物在治疗的同时也被发现有严重的毒副作用,如阿霉素的累积心脏毒性会造成不可逆心衰[16];5-氟尿嘧啶会造成神经毒性和骨髓抑制[17]。
近年来,随着对中医药研究的不断深入,许多中药制剂也被批准纳入HCC治疗方案[6]。实际应用上,中药常作为佐剂,在肝癌化疗前后的辅助治疗中,对肝癌化疗后综合征有明显的缓解作用,一定程度上起到增效减毒的效果[18-19]。ADI作为肿瘤治疗的常用中药制剂,通常与阿霉素、奥沙利铂、5-氟尿嘧啶和羟基喜树碱等化疗药物联合使用[20-21]。虽然临床疗效已被认可,但是联合用药中,ADI对于化疗药物影响的基础研究却较少。因此有必要通过动物肝癌模型研究中药对化疗药物的体内分布,为临床用药的安全性和有效性提供理论依据。
目前肝癌动物建模方法包括自发型、诱发型、移植型和转基因等[22]。化学诱导肝癌模型因为具有与人体肝癌相似的病变过程和病理学变化而被广泛应用[23]。前期研究中本研究也采用了DEN诱导大鼠HCC,但是由于造模周期较长(4个月),存在较高的死亡率和成癌失败率[24-25],因此本研究考虑选用其它模型。移植型肝癌动物模型操作简单、成本较低、造模成功率高、瘤体可见,且移植瘤可保持原有的特征和生物学特性基本不发生变化,成模较快,多用于药物研究中小鼠肝癌模型的建立[10]。其中,H22肿瘤株建立的小鼠肝癌模型被认为是中医药研究抗肿瘤作用及机制的良好肿瘤模型[26],故本研究采用H22小鼠移植瘤模型进行本实验。
实验结果表明,与SDOX组相比,多次给药后DOX及其活性代谢产物DOXol在各组织中的分布量均显著增加,证实了DOX的毒副作用与其体内的蓄积量有关[27]。这提示当DOX连续用于肿瘤治疗时,除能增强抗肿瘤效果外,还要特别注意药物在其它部位的蓄积可能引起的不良反应,尤其是DOX剂量依赖性心脏毒性和肝肾损伤等[28-29]。ADI与DOX联合用药后,DOX和DOXol在肿瘤部位的含量均有所增加;而在其它部位的分布减少,尤其以心脏中的变化最为明显,表明ADI增强DOX抗肿瘤作用,降低DOX的心脏毒性作用可能是通过改变DOX和DOXol的体内分布状态实现。
肝脏作为药物代谢的主要部位,直接影响药物在体内的药代动力学行为。研究表明DOX主要经羰基还原酶1(CBR1)、细胞色素P450(CYP450)和谷胱甘肽-S-转移酶(GSTs)代谢[30-31]。CBR1主要分布在心脏和肝脏中,是DOX代谢成DOXol的关键作用酶[32],而DOXol是DOX诱导心脏毒性的主要原因,ADI联合DOX给药后,DOXol在心脏的含量显著降低,表明ADI可能通过改变CBR1的表达降低DOX诱导的心脏毒性。同时前期实验中本研究还发现ADI可下调大鼠肝组织中CYP1A2、CYP2E1、CYP3A2、CYP2C11 mRNA和蛋白的表达[24],并且通过降低GSTs的活性抑制DOX的体内代谢[33]。此外,部分转运体的活性或表达也被认为与DOX的体内分布密切相关,DOX通过摄取性转运体SLC22A16进入细胞内;而P-gp则负责将细胞内的DOX外排[34],尤其是P-gp在肝癌细胞中存在高表达情况[35]。课题组前期研究发现HCC大鼠体内,SLC22A16的表达显著降低,而 P-gp的表达则被明显上调[13]。同时临床研究指出ADI和化疗药物联用时可以降低P-gp的表达[36],而对于SLC22A16的影响则不清楚。综上,这些都可能是ADI增加DOX抗肿瘤能力,降低DOX诱导心脏毒性的重要原因。
前期本研究课题组考察了DEN诱导的大鼠肝癌模型中,ADI可以显著提高血浆中的DOX和DOXol水平[13]。这可能是因为DEN诱导的HCC过程,肝脏经历了“肝炎—肝硬化—肝癌”的三部曲,发生HCC时,其他肝脏组织可能正处于肝炎或肝硬化阶段(也是严重病变),各药物代谢酶和转运体处于异常状态,其病变会很大程度影响药物的体内过程,从而使DOX代谢变慢。本实验中本研究采用异位移植的H22小鼠肝癌模型,这种方法的肝脏是正常状态。原发性肝癌和异位种植模型产生实验结果的差异,可能是主要代谢器官肝脏处于不同模型状态导致。这提示,肝癌动物模型各有特点,不同建模方法可以形成不同病理特点和生物特性,应依据实际需要选用合适模型。
综上所述,本研究采用UPLC-MS/MS考察了ADI和DOX联用后对DOX和DOXol在血浆、肿瘤、心、肝、肺、肾中的分布情况,从药物体内分布情况角度上解释了ADI与DOX发挥增效减毒作用的原因,为两种药物联用的合理性奠定了理论基础。

