急性期川崎病患儿血清外泌体蛋白质组学的前瞻性研究
张帆 张欠文 王娜娜 刘倩 沈洁 侯淼 孙凌 吕海涛 严文华 黄洁
(苏州大学附属儿童医院 1.心内科;2.呼吸科,江苏苏州 215003)
川崎病(Kawasaki diease,KD)是一种好发于5岁以下儿童、累及中小动脉的血管炎症疾病,至今发病原因不明;在发达国家中,KD已取代风湿性疾病成为儿童获得性心脏病的首要病因[1]。在临床工作中我们发现部分KD患儿病程早期仅以发热为主要表现,缺乏典型症状,难与细菌性感染疾病相鉴别,导致这类患儿诊断延误且不必要地使用了抗生素,最终增加了出现心血管并发症如冠状动脉损伤的风险[2-4];近些年许多研究致力于探索补充诊断KD的生物标志物,以期对疾病进行早期诊断并评估疾病预后。蛋白质组学由于可识别基于mRNA 层面未能揭示的疾病的特性被广泛应用于生物标志物和疾病发病机制的研究中。此外,在对外泌体深入研究后发现:外泌体囊泡中的蛋白质理化性质稳定不易受到内环境影响,蛋白质成分可能与疾病发病及预后相关[5-8];蛋白质组学的优势及外泌体的特质为在外泌体蛋白中寻找生物标志物奠定了基础[9-10]。本研究通过分析急性期KD患儿血清外泌体蛋白,筛选差异蛋白并进行生物信息分析,寻找补充诊断KD 的生物标志物;并在蛋白质组学分析背景下对KD与细菌性感染患儿提供了全面的血清外泌体蛋白质组图谱,为KD的诊断提供了新线索。
1 资料与方法
1.1 研究对象
前瞻性选取 2019 年 6 月至 2020 年 8 月于我院治疗的KD 患儿(n=13)纳入KD 组;同期选取因细菌感染入我院治疗的患儿(n=13)纳入感染对照组。KD组入组标准:(1)符合2017年美国心脏协会制定的KD科学申明[1];(2)病程处于急性期(<10 d);(3)病史资料完整。排除标准:病程大于10 d,入院前已接受丙种球蛋白、激素治疗的患儿。感染对照组入组标准:(1)以发热为主要表现;(2)明确细菌感染证据,实验室检查白细胞计数≥15×109/L、以中性粒细胞为主,C 反应蛋白≥20 mg/L,伴有可疑感染灶的相应症状和体征。排除标准:病毒或真菌等非细菌病原微生物引起的感染。
本研究获得患儿家属同意,并通过苏州大学附属儿童医院伦理委员会批准(2021CS023)。
1.2 仪器和试剂
胰蛋白酶(Promega,美国)、尿素(Sigma,美国)、蛋白质浓度测定试剂盒(Abcam,英国)、超速离心机(Hitachi Himac,CP80WX,日本),高效液相色谱仪(Malvern, EASY-nLC 1200 System,英国)、纳米颗粒跟踪仪(Particle Metrix,ZetaView PMX 110,德国)、质谱仪(赛默飞QExactive HF-X,美国)。
1.3 外泌体的分离及鉴定
留取入组患儿入院次日空腹全血3 mL,离心获得血清,取1~2 mL 血清样本采用差速离心法获取外泌体。提取样本15 μL置于铜网静置,随后染色。电镜观察其形态,并用纳米颗粒跟踪技术(nanoparticle tracking analysis,NTA)分析血清外泌体的大小,验证提取颗粒为外泌体。
1.4 外泌体蛋白的提取与酶解
样本加入8 mol/L尿素、1%蛋白酶抑制剂,离心后提取上清液蛋白,测定蛋白浓度,加入适量标准蛋白,裂解液调整体积,加入二硫苏糖醇,静置30 min后加入碘乙酰胺,室温孵育15 min。加入稀释尿素、胰蛋白酶酶解,离心收集上清液。
1.5 液相色谱-质谱联用分析
该技术用于特定蛋白的定量分析:将需检测的肽段进行筛选,并对于进入质量分析器的所有离子进行扫描;肽段用液相色谱流动相A 液(0.1%甲酸和2%乙腈的水溶液) 溶解后使用EASY-nLC1200 超高效液相系统进行分离。使用NSI 离子源、HF-X 质谱仪进行质谱分析。离子源电压设置为2.1 kV。一级质谱扫描范围为400~1 500 m/z,扫描分辨率120 000;二级质谱扫描固定起点为100 m/z,扫描分辨率15 000。使用数据依赖型扫描程序采集数据。自动增益控制设置为5×104,最大注入时间设置为50 ms,串联质谱扫描的动态排除时间设置为30 s。
1.6 蛋白鉴定及定量分析
平 台 Maxquant 1.5.2.8 (http://www.maxquant.org/)对质谱数据进行处理,并对蛋白质行定量分析,所得结果在Human UniProt/SwissProt 数据库中查询。本研究以P<0.05,差异倍数>1.5 或<1/1.5 倍为标准筛选差异蛋白质。
1.7 生物信息学分析
通过Uniprot 的注解信息,对差异蛋白进行基因功能(gene ontology,GO)分析(包括生物过程、细胞组成、分子功能3 类)、kyotoencyclopedia of genes and genomes(KEGG)通路分析、蛋白质功能富集聚类分析。对互作关系紧密的差异蛋白绘制图像。
1.8 统计学分析
采用SPSS 23 统计软件对数据进行统计学分析,符合正态分布计量资料用均数±标准差()表示,两组间比较采用两样本t检验;不符合正态分布计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料
除发热时间外,两组其他一般临床资料比较差异均无统计学意义(P>0.05),见表1。
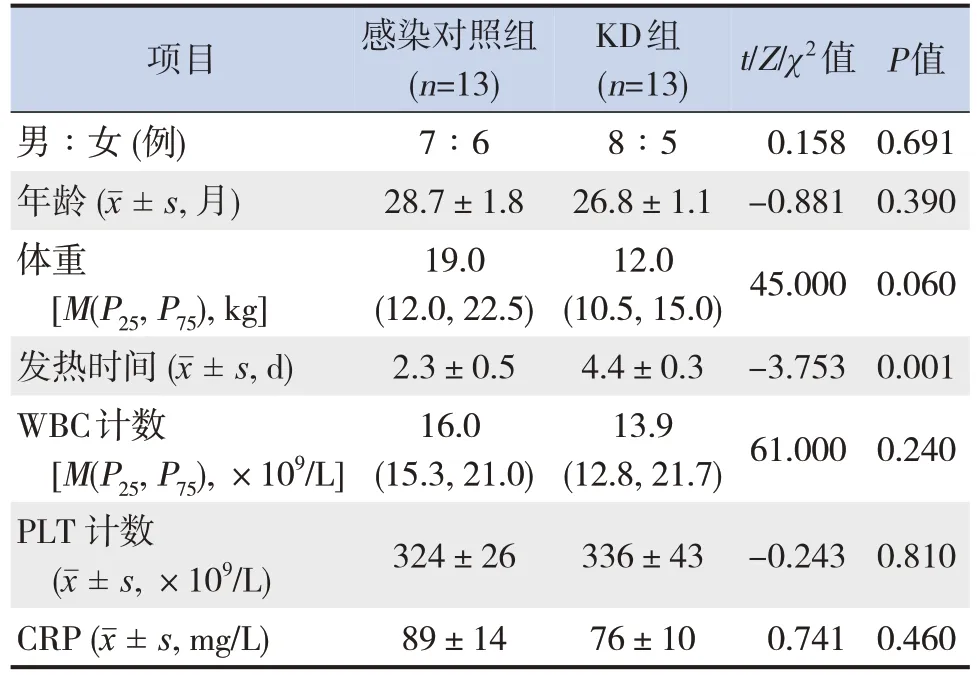
表1 两组一般资料比较
2.2 血清外泌体的分离及鉴定
电镜图像显示外泌体呈类圆形的囊泡,可见外周膜性结构(图1),NTA 技术验证外泌体直径为(140±6)nm,颗粒原始浓度为1.2×1010个颗粒/mL、密度为1.13~1.21 g/mL,NTA技术验证提取物为外泌体。
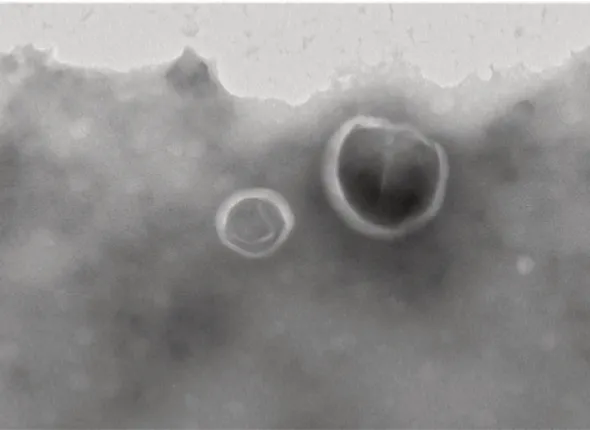
图1 外泌体囊泡在电镜下的特点(×40 000)
2.3 蛋白质鉴定及定量结果
在本研究中一共定量到296个蛋白。进一步以差异倍数>1.5、P<0.05、至少含有2 条特异性肽段为条件筛选蛋白,共筛选出131种差异蛋白,其中27种蛋白为两组共有。
48种蛋白仅在KD组中表达。以P<0.05、差异倍数>1.5 作为上调的阈值;P<0.05、差异倍数<1/1.5 作为下调的阈值进行筛选,其中上调23 种,下调25 种。通过靶向蛋白质组学技术平行反应监测(parallel reaction monitoring,PRM)技术验证了6种KD组特有差异蛋白,见表2。

表2 KD组特有外泌体蛋白列表
29 种蛋白仅在感染对照组中表达,其中上调蛋白12 种,下调蛋白17 种,通过PRM 技术验证4种特有差异蛋白,见表3。
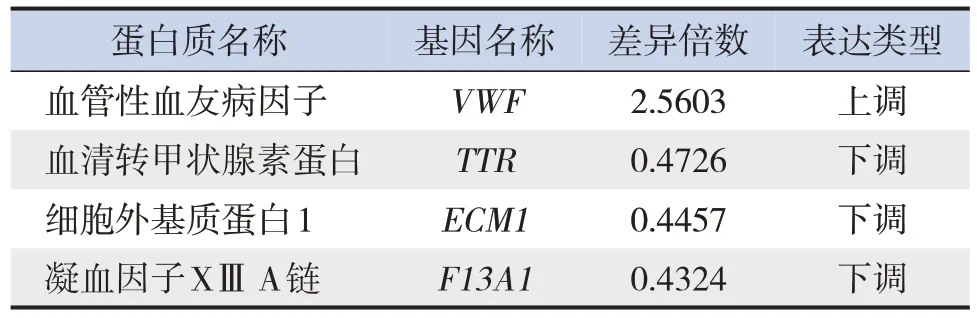
表3 感染对照组特有外泌体蛋白列表
2.4 KD组差异蛋白GO分析
KD 组差异蛋白与生物调节、细胞进程、对刺激的反应等生物进程相关;与细胞及胞外区、细胞器等细胞组成密切相关;与分子绑定、催化调节、分子功能调节等分子功能相关,见图2。

图2 KD组外泌体差异蛋白GO分析
2.5 差异蛋白互作分析
KEGG 信号通路分析:KD 组差异蛋白主要在补体和凝血级联反应、MAPK 信号途径通路富集。亦参与百日咳、朊病毒疾病、南美洲锥虫病、麻疹、沙门氏菌感染通路,查阅文献未能找到蛋白参与这些通路的相关信息,故需待后续实验进一步探究(图3)。

图3 KEGG信号通路聚类分析热图
从差异蛋白中筛选出互作关系最紧密的蛋白(按照Confidence score>0.7 提取)绘制蛋白质互作网络图像。PRM验证后KD组可定量6种特有蛋白,绘制蛋白质互作网络图像后示FGG及C1QC与其他蛋白互作关系紧密(图4)。PRM 验证后感染对照组可定量4种特有蛋白,绘制蛋白质互作网络图像后示VWF与其他蛋白互作关系紧密(图5)。

图4 KD组外泌体差异蛋白互作网络图

图5 感染对照组外泌体差异蛋白互作网络图
3 讨论
部分KD患儿缺乏典型临床表现,仅以发热为主要表现,在病程的初期这些患儿易被误诊成细菌感染性疾病,接受了不合适的抗感染治疗,且延误了诊断及使用丙种球蛋白的治疗时间,故寻找可靠生物标志物协助诊断不完全KD 极为重要。外泌体由于具备囊泡结构稳定、内含蛋白种类数量可能与机体的疾病状态相符等特质,成为当下学者研究的热点[11]。
本研究将急性期KD患儿与细菌性感染疾病的患儿血清外泌体蛋白进行对比分析,在KD组找到48 个特有差异蛋白,并对其进行GO 分析、KEGG信号通路分析及蛋白互作网络分析,以明确蛋白功能、参与的调节通路,并探索这些蛋白及参与通路在KD中的具体作用。此外,本研究亦对细菌性感染疾病患儿的血清外泌体蛋白进行了分析,以期为不明原因发热的患儿提供早期诊断思路。
KD 组特有蛋白FGG、SERPING1 显著上调。FGG 与FGA 和FGB 聚集后共同参与机体止血,显著血小板计数升高是KD患儿伴发冠状动脉损害的高危因素,血小板数量、活性增强均与KD转归有关[12]。KD亚急性期中,血小板释放进入外周血中的数量增多加速了血栓形成[13-15]。绘制KD组特有蛋白PPI图像后发现FGG与多种蛋白质间的作用紧密,处于图像的核心位置,故本研究推测FGG 蛋白参与KD血小板升高的过程,并加重了血管炎症反应,且诱发血栓形成,其有望成为补充KD诊断的生物标志物。
上调蛋白SERPING1 抑制C1 相关补体蛋白,由于其在蛋白互作网络中的位置分布相较于FGG处于稍边缘区,故推测其位于通路中的作用及功能略低于上调蛋白FGG,且与其互作蛋白种类及数量均少于FGG,故本研究认为SERPING1作为生物标志物补充诊断KD的可靠性低于FGG,这仍需要后续实验进一步明确。
下调蛋白C1QC及C1QA均为组成C1Q的亚基,C1Q、C1R参与补体经典途径。C1Q是补体经典途径的始动分子,其来源丰富:肥大细胞、巨噬细胞、未成熟树突状细胞(immature DC,imDC)均能产生C1Q,imDC产生C1Q的数量高于其他细胞,它在机体受到病原体影响时分化为成熟DC且不再分泌C1Q[16-18]。本研究检测C1QC 数量减少原因推测如下:一方面,在急性期KD患儿体内释放细胞因子作用于imDC,使其分化成熟导致外周血中C1Q 生成量锐减;另一方面,急性期KD 患儿补体经典途径激活大量消耗C1 相关蛋白,导致血液中C1Q 蛋白减少。C1QC 为C1Q 组成亚基,本研究中C1QC 的含量显著减少,且下调蛋白C1QC 处于蛋白互作网络中较为核心的位置,故本研究推测其在疾病早期诊断中存在一定的价值。
下调蛋白IGHG4 是由B 淋巴细胞分泌的糖蛋白,在体液免疫初期接触特定抗原后,启动B淋巴细胞的克隆扩张和分化浆细胞,并参与介导体液免疫的效应期[19],我们推测其参与了补体经典途径的激活。
KEGG 信号通路分析显示KD 组外泌体蛋白主要在MAPK信号途径、补体和凝血级联反应通路中显著富集。MAPK信号参与机体内细胞间应激与凋亡、炎症调控等多种病理生理过程。有文献报道MAPK 信号通路之一P38MAPK 对心肌肥大具有负向调节作用,且与急性心肌梗死后心肌缺损再灌注的过程相关[20]。在一项关于先天性心脏病发病的研究中发现,P38MAPK 通路下游效应基因MKNK2和ELK1表达抑制抵抗素通过MAPK信号通路上调MMP-9 mRNA 和蛋白分泌,致冠状动脉内皮细胞损伤[21-22],这一机制提示MAPK信号通路可能参与KD中冠状动脉损伤过程。综上所述,推测MAPK 信号通路及作用蛋白可能与KD 急性期心脏炎症性反应及冠状动脉损伤情况相关。
外泌体蛋白在“补体和凝血级联反应”中显著富集。由于FGG 参与凝血过程,而C1QC 作为C1 蛋白组成部分参与补体的经典过程,故2 条富集通路验证了候选蛋白在疾病发生过程中的关键作用。
本研究验证出4种仅在细菌性感染疾病患儿急性期血清中存在的外泌体蛋白,分别为VWF、ECM1、F13A1、TTR。其中上调蛋白VWF 通过在血管内皮下胶原基质与血小板表面受体复合物上形成分子桥梁,促进血小板与血管损伤部位的黏附,推测联合检测这些具有显著特性的蛋白有助于早期鉴别发热患儿的具体病因。
综上,本研究推测KD患儿外泌体蛋白FGG及CIQC有望成为补充诊断KD的生物标志物,联合检测蛋白FGG、C1QC及VWF有助于早期鉴别发热患儿的病因;KD 相关蛋白富集于通路MAPK 信号途径及补体和凝血级联反应,我们认为对通路及参与蛋白的分析有助于进一步了解KD的发病机制。

