儿童结肠镜检查前聚乙二醇电解质散联合饮食控制肠道准备质量的影响因素分析
矫凤飞 刘志峰 沈彦池 曹金金 高远 王惠 唐韦婷 黄艳
(南京医科大学附属儿童医院消化科,江苏南京 210008)
儿童结肠镜检查前肠道准备尚无标准方案[1],且儿童耐受力和依从性差,导致肠道准备存在较多困难,肠道准备不充分率较高(10.1%~35.2%)[2-4]。肠道准备不充分除了影响检查时间和费用外,还影响诊断和治疗效果[5-6]。因此了解肠道准备质量的影响因素,对降低肠道准备不充分的发生率及提高结肠镜检查的诊疗效果至关重要。国内外成人研究已表明末次服完泻药至开始结肠镜检查的时间间隔(以下简称等待时间)影响肠道准备质量[7-9],但儿童相关研究极少。目前儿童结肠镜检查前多数使用聚乙二醇电解质散联合饮食控制进行肠道准备。本研究旨在探讨这一肠道准备方案其肠道准备质量的影响因素,并探讨等待时间与肠道准备质量的关系,为临床减少肠道准备不充分的发生提供新思路。
1 资料与方法
1.1 研究对象
选择2020 年1~11 月入住南京医科大学附属儿童医院消化科行结肠镜检查的患儿进行回顾性分析。纳入标准:年龄≤18岁;口服或鼻饲聚乙二醇电解质散联合饮食控制进行肠道准备的患儿。排除标准:肠道准备期间未进行流质或无渣半流饮食控制的患儿(如禁食或普食患儿);同一患儿多余重复的例次(如同一患儿研究期间多次行结肠镜检查,选取第一次结肠镜检查的资料);病历资料不完整。按照Boston 肠道准备评分[10]将纳入患儿分为肠道准备充分组和肠道准备不充分组。
1.2 研究方法
1.2.1 资料收集 (1)一般资料:性别、年龄、体重、身高;(2)肠道准备质量可能的影响因素:体重指数(body mass index,BMI)、术前控制饮食方式、排便习惯、服药后至手术前大便次数、肠道准备过程中有无使用鼻饲辅助、肠道准备的依从性、结肠镜检查原因、等待时间;(3)肠道准备相关的不良反应、结肠镜检查持续时间、术后诊断。
1.2.2 肠道准备方案 (1)口服或鼻饲聚乙二醇电解质散联合饮食控制行肠道准备。(2)饮食控制:一般术前2 d 采用流质或无渣半流饮食。(3)制剂:聚乙二醇电解质散(厂家:江西恒康药业有限公司;产地:江西省上饶市;用作术前肠道清洁准备),为复方制剂,由A、B、C 3 包组成。A含氯化钾0.74 g,碳酸氢钠1.68 g;B含氯化钠1.46 g,硫酸钠5.68 g;C 含聚乙二醇-4000 60 g。将3包一并冲到1 000 mL的温水里,并将其保存在保温瓶。(4)服用总量:体重<10 kg 患儿共服500 mL;体重 10~20 kg 患儿共服 1 000 mL;体重>20 kg患儿共服2 000 mL。(5)服用方法:结肠镜检查前1日18∶00和检查当日4∶00开始服用,检查前1 日和当日各服总量一半。检查前1 日体重<10 kg 患儿首次服用100 mL,然后每隔15 min 服用40 mL,直到服完250 mL为止;体重10~20 kg患儿首次服用200 mL,然后每隔10~15 min 服用80 mL,直到服完500 mL为止;体重>20 kg患儿首次服用400 mL,然后每隔10~15 min 服用150 mL,直到服完1 000 mL 为止。检查当日服用方法同前。(6)其他事项:每次服完药尽量来回走动,对于不能行走的患儿行腹部按摩;检查当日6∶00开始禁食禁水;对于口服困难的患儿使用鼻饲辅助。
1.2.3 相关定义 (1)肠道准备质量评估:由固定的内镜医生和内镜护士采用Boston肠道准备评分量表[10]进行肠道准备质量评估。三段结肠(右侧结肠、横结肠、左侧结肠)中的每段结肠评分≥2 分为肠道准备充分;三段结肠评分总和<6 分或任意一段结肠得分<2 分为肠道准备不充分[3,9]。(2)肠道准备依从性不良:聚乙二醇电解质散服用量小于规定量的75%。规定量指肠镜检查前1日和当日的总量。(3)等待时间:末次服完泻药至开始结肠镜检查的时间间隔。(4)便秘:每周排便次数少于3 次[11]。(5)腹泻:大便性状为稀便或水样便,通常24 h内至少3次排便[12]。
1.3 统计学分析
应用SPSS 26.0 统计软件进行数据分析。使用正态QQ 图及Kolmogorov-Smirnov 检验发现计量数据均非正态分布,以中位数(四分位数间距)[P50(P25,P75)] 表示,组间比较采用 Mann-WhitneyU检验。计数资料以例数和百分率(%)表示,组间比较采用χ2检验或Fisher确切概率法,组间两两比较采用Bonferroni 法校正显著性水平。采用多因素logistic回归分析(向前逐步回归法)进行肠道准备质量影响因素的分析。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析确定等待时间的临界值。P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象的一般资料
按照纳入和排除标准,本研究共纳入结肠镜检查患儿367例。367例患儿中位年龄8岁(最小4个月,最大16岁),其中男性247例(67.3%)。肠道准备不充分组(以下简称“不充分组”)30 例(8.2%),肠道准备充分组(以下简称“充分组”)337 例(91.8%)。367 例患儿中发生不良反应共19例(5.2%),其中呕吐14例,腹痛3例,恶心1例,发热1例。结肠镜检查中位时间为35 min。术后诊断未见异常168 例(45.8%),结直肠息肉92 例(25.1%),回结直肠炎48例(13.1%),炎症性肠病47 例(12.8%),其他12 例(3.3%,包括结肠扩张7例,肛裂3例,肠白塞氏病1例,结肠占位1例)。
2.2 肠道准备质量影响因素的单因素分析
将肠道准备质量可能的影响因素进行单因素分析,发现年龄、体重、等待时间与肠道准备不充分有关(均P<0.05)。不充分组与充分组各年龄层及各体重层患儿比例的差异采用Bonferroni 法校正显著性水平进行事后比较,结果显示不充分组≥8 岁及≥40 kg 的患儿比例明显高于充分组(均P<0.05),两组间其余年龄层及体重层的患儿比例差异无统计学意义(均P>0.05)。见表1。
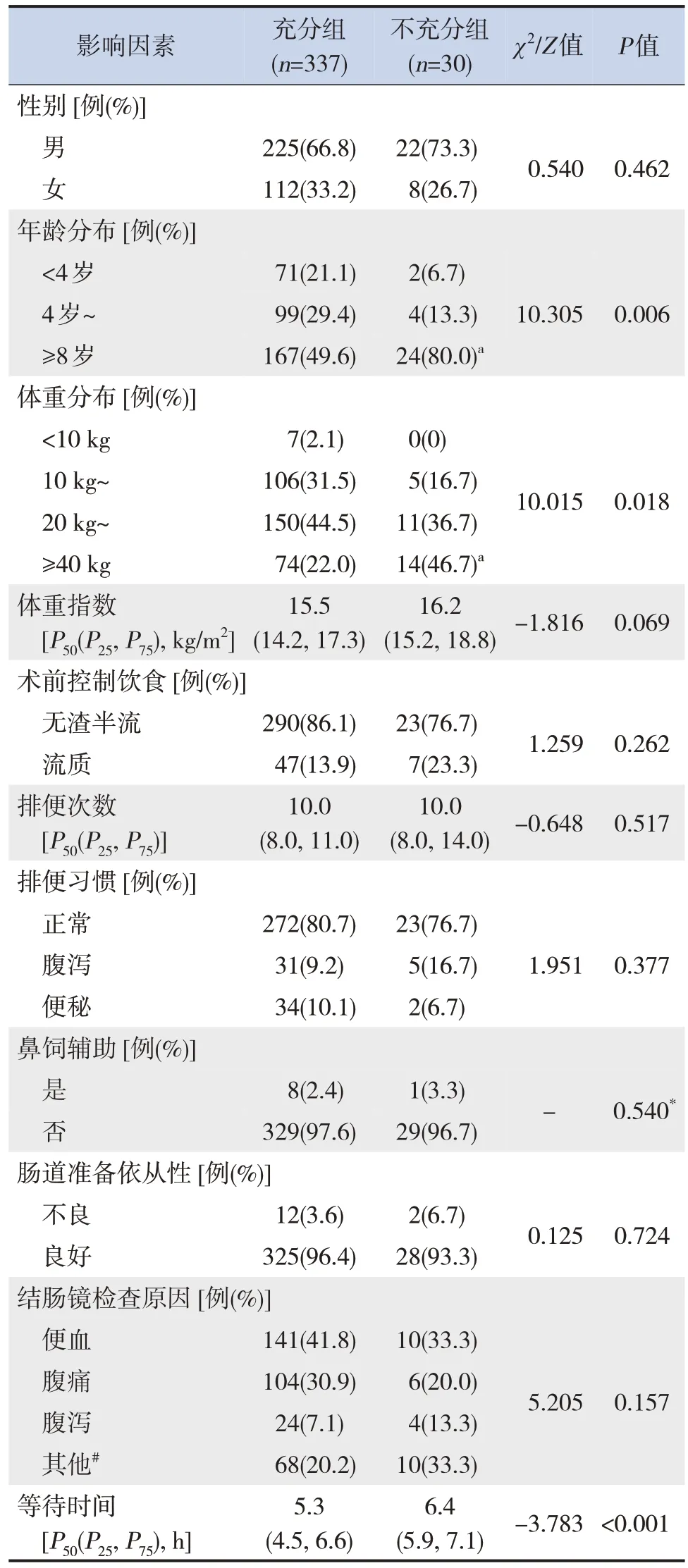
表1 两组儿童肠道准备质量可能的影响因素比较
2.3 肠道准备质量影响因素的多因素分析
将单因素分析有统计学意义的指标,即年龄及等待时间纳入多因素logistic 回归模型(尽管两组间体重差异存在统计学意义,但体重与年龄存在共线性,故体重未纳入)。由于肠道准备不充分组≥8 岁的患儿比例明显高于充分组(P<0.05),故年龄以<8 岁为0,≥8 岁为1 的二分类变量代入模型。结果显示,年龄≥8 岁及等待时间长为肠道准备不充分的独立危险因素(P<0.05)。等待时间是以连续变量代入模型的,显示等待时间每增加1 h,肠道准备不充分的风险增加55.9%。见表2。
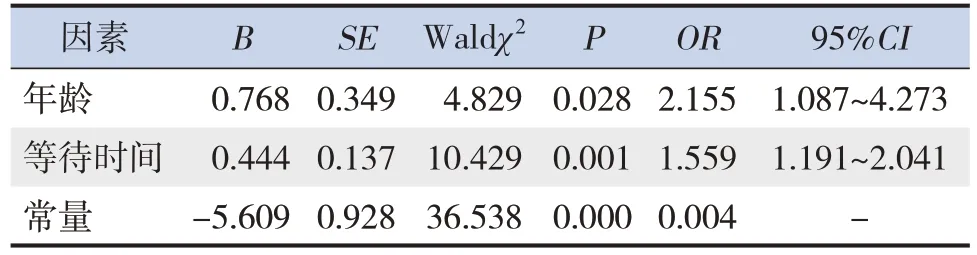
表2 肠道准备质量影响因素的多因素logistic回归分析
2.4 等待时间界值的确定
以等待时间绘制ROC 曲线,曲线下面积(area under the curve,AUC)为0.708,区分肠道准备充分与否的临界值为5.5 h,约登指数为0.407,对应的灵敏度、特异度分别为90.0%、50.7%。见图1。

图1 等待时间的受试者工作特征曲线分析
2.5 不同等待时间组肠道准备不充分发生率的比较
进一步将367例患儿按不同等待时间分组,分成≥5.5 h 组 (n=193) 和<5.5 h 组 (n=174)。≥5.5 h组肠道准备不充分的发生率明显高于<5.5 h 组[ (27/193, 14.0%) vs (3/174, 1.7%),χ2=18.340,P<0.001]。
3 讨论
本研究回顾性分析了367例住院行结肠镜检查的患儿,通过单因素及多因素分析发现年龄大及等待时间长是儿童肠道准备不充分的独立危险因素。ROC 分析发现等待时间的临界值为5.5 h。≥5.5 h 组患儿肠道准备不充分的发生率明显高于<5.5 h组。
本研究结果显示年龄≥8 岁是肠道准备不充分的 独 立 危 险 因 素 (OR=2.155,95%CI:1.087~4.273)。既往多数成人研究已表明高龄(>65 岁)与肠道准备不充分密切相关[8,13-14],但在儿童相关研究中,关于年龄与肠道准备的关系的报道较少,且结果不一致[2-3]。李丹等[2]研究发现年龄与儿童肠道准备质量无关,杨荣英等[3]则认为年龄小于10 岁与肠道准备不良有关。这些研究结果的不一致考虑与肠道准备方案不同及研究人群各年龄层比例不同有关。他们的研究[2-3]均未纳入小于3岁的患儿。Reddy 等[15]最新一项回顾性研究纳入了0~3岁患儿,结果表明低龄是肠道准备不充分的危险因素,其中0~3岁患儿肠道准备不充分的发生率是13~21岁患儿的近2倍。他们的研究在肠道准备方案方面存在异质性(包括采用聚乙二醇、比沙可啶、硫酸镁等多种方案),而本研究只纳入了使用聚乙二醇电解质散的患儿,肠道准备方案的不同会影响研究结果,这可能是本研究结果与之相反的原因之一。另外,由于我们中心结肠镜检查的数量较多,一般优先安排年龄小的患儿,年龄较大的患儿等待时间较长。而本研究已表明等待时间长是肠道准备不充分的危险因素,这可能是本研究年龄较大的患儿容易发生肠道准备不充分的另一原因。最后,本研究肠道准备不充分组体重≥40 kg 的患儿比例明显高于充分组(46.7% vs 22.0%),考虑可能与≥40 kg的患儿使用2 000 mL聚乙二醇电解质散,口服总量偏小有关。因此,年龄较大的患儿(尤其是体重≥40 kg的患儿)口服总量偏小,亦可能是其容易发生肠道准备不充分的原因。在临床日常工作中我们也发现了年龄较大的患儿(尤其是体重≥40 kg)易发生肠道准备不充分的现象。本研究的截止时间为2020 年11月,我们在此之后将体重≥40 kg 的患儿口服总量由2 000 mL改为3 000 mL,这一方案的改变是否能有效改善肠道准备质量,有待后续研究。
本研究还发现等待时间长是儿童肠道准备不充分的独立危险因素(OR=1.559,95%CI:1.191~2.041),等待时间每增加1 h,肠道准备不充分的风险增加55.9%。这与过去成人研究结果一致[7-9]。患儿在完成肠道准备后随着等待时间的延长,消化液分泌逐渐增多,胃肠排空使小肠液移至大肠,增加了肠道准备不充分的风险[9,16]。既往成人研究的等待时间范围存在不一致性[7-9,17-19],考虑与肠道准备方案、肠道准备质量的评价标准、研究人群、研究方法等不同有关。但多数成人文献表明等待时间应控制在 4 h 内[5,9,19],包括 2013 年我国消化内镜诊疗共识意见亦推荐等待时间<4 h[5]。与既往成人研究不同之处在于,过去多数研究采用人为划分时间段来寻找相关临界值,存在一定的主观性,而本研究则通过ROC 曲线分析发现等待时间的界值为5.5 h,其AUC为0.708,具有较好区分肠道准备充分与否的价值。同时通过比较不同等待时间组肠道准备不充分的发生率,进一步验证了等待时间与儿童肠道准备不充分的相关性。本研究得出的界值5.5 h比成人4 h略大,推测主要与研究人群有关,成人的肠道腺体分泌功能较儿童成熟,肠液分泌较快及胃肠排空能力强。由于服完泻药2 h 内麻醉误吸的风险[20]及有共识提出等待时间不能小于2 h[21](本研究中等待时间最小为2.8 h),故我们建议儿童结肠镜检查的等待时间控制在2~5.5 h 范围内,其发生肠道准备不充分的风险较小。等待时间在儿童人群中的研究极少,缺乏参考范围,最新发布的中国儿童消化内镜诊疗相关肠道准备快速指南(2020)[22]亦未提及此方面,我们为后续研究提供了新思路及第一手资料。值得注意的是,由于本研究系回顾性单中心研究,等待时间在何范围肠道准备质量最佳,尚需展开多中心大样本的研究。
过去的研究表明儿童肠道准备不充分的发生率较高,为10.1%~35.2%[2-4]。而本组病例的发生率较低(30/367,8.2%),与沙莎等[23]一项前瞻性研究中干预组的发生率相仿(6/97,6.2%)。沙莎等[23]研究中干预组的肠道准备方案按不同的年龄段服用不同剂量聚乙二醇电解质散(3~6 岁1 000 mL,7~13 岁 1 500 mL,14~18 岁 2 000 mL),分术前1 日和当日两次口服,同时采用较长时间(术前3 d)的术前饮食控制(相对于成人术前1 d开始饮食控制[1]),这些与我们的肠道准备方案相似。同时我们对于口服困难的患儿使用鼻饲辅助完成肠道准备。这些均可能是本研究肠道准备不充分发生率较低的原因。另外,本研究中肠道准备的不良反应发生率亦较低(19/367,5.2%)。
本研究存在一定的不足之处:(1)本研究为单中心回顾性研究;(2)有研究表明服用泻药后末次大便性状是肠道准备质量的影响因素[2],但本研究未纳入该指标。我们认为末次大便性状更可能是肠道准备的结果,作为结肠镜开始前肠道准备质量的评估指标可能更合适。
总之,本研究结果显示,使用聚乙二醇电解质散联合饮食控制进行肠道准备的患儿中,年龄较大是儿童结肠镜检查前肠道准备不充分的独立危险因素,可能与较大儿童存在聚乙二醇剂量不足有关。另外,等待时间长亦是肠道准备不充分的独立危险因素,其控制在2~5.5 h 范围内能降低肠道准备不充分的发生率。
利益冲突声明:所有作者均声明不存在利益冲突。
——国外课堂互动等待时间研究的现状与启示

