表没食子儿茶素没食子酸酯缓解高频刺激诱导的雌性小鼠慢性原发性疼痛
唐 源,金冬梅,揭英桃,林震嘉,熊 媖,彭湘格,周利君,谈 智
(1.中山大学中山医学院生理教研室//中山大学疼痛研究中心,广东广州 510080;2.中山大学孙逸仙纪念医院康复医学科,广东广州 510120)
慢性疼痛困扰着全球三分之一的人口,是威胁人类身心健康的重要原因之一,严重时会导致劳动能力的丧失[1-2]。WHO 2018 年正式将慢性疼痛认定为一种疾病,2019 年ICD-11 新划分的慢性疼痛第一大类——慢性原发性疼痛(chronic primary pain,CPP),是指排除其他类型慢性疼痛的一个或多个解剖区域、持续或反复发作超过3 个月的疼痛,伴有显著的情绪情感异常(如焦虑、愤怒、沮丧或情绪低落)和(或)功能障碍[3]。故此,已建立的多种神经损伤或炎性刺激引起的慢性疼痛模型并不适合慢性原发性疼痛的机制研究。2019 年我们采用无明显神经损伤的中强度高频刺激(high-frequency stimulation,HFS)创建了首个小鼠慢性原发性疼痛模型[4]。因此,在此模型上进行深入的机制研究将为有限的临床防治手段提供新的靶点和策略。天然化合物在药物研究中的地位和意义越来越受到人们的重视。不少文献已证实药用植物和膳食补充剂可提供有效且安全的止痛效果。表没食子儿茶素没食子酸酯[(-)-epigallocatechin gallate,EGCG]是从绿茶中提取的多酚类物质中含量最高的一类儿茶素类单体,具有抗氧化、抗炎、抗肿瘤生长及神经保护等作用,能防治多种慢性疾病,如癌症[5]、心血管疾病[6]和神经退行性疾病[7]。近年来一些临床前动物实验的研究提示EGCG 还具有良好的镇痛作用[8]。鞘内(或腹腔)注射EGCG可缓解大鼠(或小鼠)脊神经结扎(spinal nerve ligation,SNL)[9-10]、坐骨神经缩窄损伤(chronic constriction injury,CCI)[11-12]、坐骨神经钳夹损伤[13]、髓核突出压迫神经根[14]等神经病理性疼痛。但EGCG 是否可缓解非神经损伤的慢性原发性疼痛尚未有研究。因此,本研究旨在观察EGCG 能否缓解HFS 诱导的慢性原发性疼痛中的痛觉敏化并初步探讨机制。
1 材料与方法
1.1 实验动物
SPF 级雌性C57BL/6J 小鼠34 只,8~10 周龄(18~20)g,购于中山大学实验动物中心(广州)生产许可证:SCXK(粤)2016-0029;使用许可证:SYXK(粤)2017-0081。小鼠置于SPF 级动物实验室中饲养,环境温度为(20~26)℃,相对湿度为40%~70%,且所有笼具、饲料、饮水、垫料均严格消毒。动物使用协议和动物处理程序获得了中山大学实验动物管理与使用委员会(IACUC)的批准。
1.2 实验材料及主要试剂
表没食子儿茶素没食子酸酯(SE8120,索莱宝公司);异氟烷(瑞沃德公司);von-Frey(Aesthesio,Danmic公司);Rabbit anti-c-Fos(2250,CST公司);Mouse anti-NeuN(ab104224,abcam 公司);Goat anti-CGRP(NBP3-00520,Novus 公司);Goat anti-Iba1(ab5076,abcam 公司);Mouse anti-GFAP(3670,CST 公司);Donkey anti-Rabbit IgG Alexa Fluor 555(A31572,Life Technologies 公司);Donkey anti-Mouse IgG Alexa Fluor 488(A21202,Life Technologies 公司);Donkey anti-Goat Alexa Fluor 555(A31570,Life Technologies 公司);Donkey anti-Goat IgG Alexa Fluor 488(A21206,Life Technologies 公司);Donkey anti-Mouse IgG Alexa Fluor 647(A31571,Life Technologies 公司);倒置荧光显微镜(Nikon公司)。
1.3 高频电刺激的模型建立与EGCG给药
将小鼠随机分为假手术(sham)组,溶剂(生理盐水)+HFS 组,EGCG(10、20、50、200 μmol/L)+HFS 组(每组4~5 只小鼠)。HFS 模型的建立:使用吸入性麻醉剂(1~3)%异氟烷将小鼠麻醉后剃去左侧腿部毛发,在腘窝处钝性分离皮肤和肌肉暴露出坐骨神经,将双铂电极置于坐骨神经下给予HFS(10 V,100 Hz,波宽0.5 ms,4串,每串持续1 s,间隔10 s)刺激以建立慢性原发性疼痛模型,最后将小鼠伤口缝好后放回原笼位饲养。整个手术过程动作轻柔,避免过度牵拉或损伤坐骨神经。
EGCG 给药:参考文献依照参考文献中EGCG给药剂量,我们将ECGG 直接溶于生理盐水并配置成4 个浓度梯度(10、20、50 和200 μmol/L),在平行于髂后上棘处的脊柱内以10 μL 体积进行单次鞘内给药(溶剂或EGCG),待1 h 后再做上述的HFS刺激。
鞘内注射的具体操作:使用(1~3)%异氟烷吸入性麻醉剂将小鼠麻醉后,左手固定好鼠身,用右手拇指指甲在平行于髂后上棘处按压触知凸起的棘突,在下方的棘突间隙用10 μL 微量注射器与脊柱上方成20 度角斜度进针,明显的突然甩尾是成功进入硬膜内空间的标志。
1.4 机械痛阈的测试
每次测试前将小鼠提前30 min 置于测试网架上以适应测试环境,使用von-Frey(0.02~2.0 g)纤维丝进行测试。测试过程中至少由2 名实验员在不知道分组情况下盲测,且重复5 次刺激后爪中的至少有一次长达3 s 的缩爪行为则记为一次阳性结果。小鼠痛阈变化率=(ln2 -ln mechanical pain threshold)/(ln2 -ln0.02)×100,痛阈抑制率(%analgesic efficiency)=(HFS 痛阈变化率-EGCG 预处理组痛阈变化率)/HFS痛阈变化率×100。
1.5 免疫荧光实验
小鼠腹腔注射10%乌拉坦后,经左心室灌注20 ml 0.01 mol/L 的磷酸盐缓冲液快速冲净血液后再灌注40 ml 40 g/L 多聚甲醛溶液进行前固定。将取下的腰段脊髓(L4-L6)后固定(3~4)h 再转至30%蔗糖溶液脱水沉底;再用冰冻切片机(Leica 公司)将脊髓切成18 μm 薄组织片。组织片先用驴血清常温封闭1 h 后,加入CGRP、Iba1 等抗体4 ℃孵育18 h 左右;再用磷酸盐缓冲液清洗3 次后加入对应的二抗常温孵育1 h,然后再次清洗3 次后滴加抗荧光淬灭剂封片,拍摄。各组腰段脊髓每组一粒切在同一玻片上再一起进行免疫荧光染色;而且拍照时,c-Fos、CGRP、Iba1、GFAP 信号都分别在同一曝光条件拍摄;最后再使用Image J 软件在相同亮度、对比度情况下进行相对光密度(relative optical density,RelOD)分析。用Image J 细胞计数插件统计10倍荧光片中脊髓背角c-Fos+、Iba1+及GFAP+阳性细胞数。免疫荧光统计中每组3 只动物,每只以最强2~3 张片为计,其中RelOD 以Sham 组均值为100%标准化处理。
1.6 统计学方法
所有数据以均值±标准误(Mean±SEM)表示,为正态分布的计量结果。图1 行为学结果的统计采用双因素方差分析(two-way ANOVA),用最小显著差(least significance difference,LSD)比较每个时间点的各组数据。图2~4 使用单因素方差分析(One-way ANOVA)处理实验数据,数据符合正态分布且方差齐时采用one-way ANOVA,差异有统计学意义时采用Tukey HSD法进行两两比较,若数据符合正态分布但方差不齐时采用Welch′s ANOVA,最后用Tamhane′sT2进行两两比较。所有数据采用GraphPad Prism 8.0 软件分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 EGCG剂量依赖性缓解HFS诱发的痛觉过敏
为了观察EGCG 是否可以缓解HFS 诱导的痛觉过敏反应,我们采用10 μL 不同浓度的EGCG(10、20、50 和200 μmol/L)或溶剂(生理盐水)单次鞘内注射1 h后再进行假手术或HFS刺激。机械痛行为学结果显示10 V HFS 能引起显著且持续1 W以上的机械痛敏,而EGCG 可剂量依赖性缓解HFS刺激引起的痛觉过敏反应:10 μmol/L EGCG 对机械撤足阈值(mechanical withdrawal threshold,PWT)没有明显影响,20 μmol/L EGCG 能轻微增加PWT,50、200 μmol/L 剂量时达到最佳治疗效果(P<0.000 1),且维持镇痛效应至少长达7 d(图1A)。进一步分析对HFS 痛阈抑制效率的结果显示(图2B),10 μmol/L 浓度EGCG 对疼痛的抑制率仅在第3 d 达(20.47±4.58)%(P<0.05),20 μmol/L EGCG在HFS 刺激后对疼痛抑制达到(44.82±3.58)%(P<0.000 1),而50、200 μmol/L 对HFS诱导的机械痛抑制率分别可达(70.75±1.97)%、(68.63.75±2.86)%(P<0.000 1;图1B)。这两个浓度镇痛效果并无明显差异(P>0.05),表明50 μmol/L 已是镇痛最佳浓度,其最大镇痛效率为84.95%。痛行为学结果表明预先单次EGCG 鞘内注射能剂量依赖性缓解HFS诱导机械痛觉过敏。

图1 EGCG鞘内预处理对小鼠HFS诱导机械痛觉异常的影响Fig.1 Effects of intrathecal EGCG on HFS-induced mechanical allodynia
2.2 EGCG降低脊髓背角神经元的兴奋性
脊髓背角投射神经元兴奋性增加是痛觉过敏持续的重要原因,而即早基因c-Fos 表达可作为神经功能活动的标志物。因此,为进一步验证EGCG对痛行为学的影响,我们通过免疫荧光染色法观察EGCG 对脊髓背角神经元c-Fos 表达的影响。如图2 所示,与假手术组相比,HFS 模型7 d 后的小鼠脊髓背角c-Fos 表达显著上升(P<0.000 1)。免疫荧光双染结果显示c-Fos表达在神经元中(绿色NeuN标识),而50 μmol/L EGCG 处理组则明显下调(P<0.000 1)。以上结果表明EGCG 可有效抑制脊髓背角神经元兴奋性的增加;这从痛觉一级突触后神经元层面证实EGCG 对小鼠慢性原发性疼痛的镇痛效果显著。

图2 EGCG预处理对HFS刺激7天后同侧脊髓背角c-Fos表达的影响Fig.2 Effect of EGCG pretreatment on c-Fos expression in the ipsilateral spinal dorsal horn at 7 day after HFS stimulation
2.3 EGCG 降低HFS 引起的脊髓背角CGRP 增加
研究证实CGRP 介导多种慢性疼痛的发生发展;我们前期研究也证明CGRP 阳性的神经末梢在HFS 模型腰段(L4-L6)脊髓背角中显著增加。因此,我们也观察EGCG 对HFS 模型高表达CGRP 的影响。如图3 免疫荧光结果所示,与HFS 7 d 模型组CGRP 高表达相比,EGCG 预处理可显著降低脊髓背角CGRP 的荧光强度(P<0.000 1)。这一结果从突触前层面进一步证实EGCG 对慢性原发性疼痛的抑制效果。
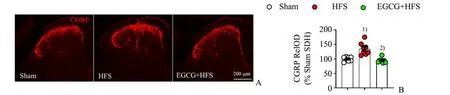
图3 EGCG预处理对HFS刺激后脊髓CGRP纤维终末的影响Fig.3 The changes of spinal CGRP fiber terminal after HFS with or without EGCG pretreatment
2.4 EGCG 减少脊髓背角中小胶质细胞和星形胶质细胞的激活
大量研究显示脊髓背角胶质细胞的激活及其炎症反应也介导慢性疼痛的发病过程,而EGCG 也有抑制神经炎症的作用。因此,我们还将观察EGCG 对HFS 模型脊髓背角胶质细胞的影响情况。如图4A、C 免疫荧光图所示,与对照组相比,HFS 7 d 模型中脊髓背角中由Iba1 标记的小胶质细胞的阳性细胞数量显著增加(P<0.000 1),而EGCG 预处理组小胶质细胞的阳性数量减少(P<0.000 1)。同时,与对照组对比,HFS 模型组脊髓背角GFAP标记的星形胶质细胞的数目增加(P<0.05),而EGCG预处理后则数目减少(P<0.05),但各组平均荧光强度无明显差异(图4B、D)。以上结果表明EGCG 可抑制HFS 引起的脊髓背角胶质细胞(尤其小胶质细胞)激活。

图4 EGCG对脊髓背角中小胶质细胞和星形胶质细胞数量的影响Fig.4 The effects of EGCG on the number of microglia and astrocytes in spinal dorsal horn
3 讨论
慢性疼痛是困扰患者的一大顽疾,其主要表现为痛觉超敏(痛阈降低)、痛觉过敏(疼痛反应增强)和自发性疼痛;发病机制除涉及疼痛处理的外周和中枢敏化外,还包括神经免疫炎症[15]。最新的慢性疼痛分类包括三个方面:伤害性疼痛(nociceptive pain 来自组织损伤)、神经性疼痛(neuropathic pain来自神经损伤)与可塑性疼痛(nociplastic pain,来自敏感神经系统)。但不同疼痛类型可能存在机制上的重叠,故此分类也并不全面;因此许多专家认为疼痛分类是一个连续统一体[1]。新增加的可塑性疼痛是指症状更为广泛或强烈的多灶性疼痛以及其他中枢神经系统疾病衍生的症状,如疲劳、睡眠、记忆、和情绪问题[16]。虽然造成这种疼痛的机制尚不完全清楚,但人们认为中枢神经系统中痛觉处理的增强以及疼痛调节的改变起着重要作用。慢性原发性疼痛是无明确诱因且不能更好地用其他继发性慢性疼痛来解释的一类常见而特殊的慢性疼痛,主要包括五种类型:慢性弥漫性疼痛、复杂性区域疼痛综合征、慢性原发性头痛或口面部疼痛(如慢性偏头痛、三叉神经自主性疼痛、慢性灼口痛)、慢性原发性内脏痛(如肠易激综合征)、慢性原发性肌肉骨骼疼痛[3]。神经损伤后传入神经的簇状自发放电水平明显增加,即异位放电(ectopic discharge),被认为是其慢性疼痛的重要原因[17]。多项研究表明,虽然偏头痛、三叉神经自主性痛没有明确诱因,但均存在持续的神经异位放电现象[18]。这为HFS 诱导慢性原发性疼痛模型提供了一定的理论依据;也提示慢性原发性疼痛当属于可塑性疼痛。此外,HFS 诱导的C 纤维诱发电位长时程增强(long term potentiation,LTP)被公认为痛觉过敏的基础以及中枢敏化的突触模型[19]。因此,我们之前研究发现中强度HFS 诱导的一种小鼠非神经损伤性慢性疼痛不仅可用作慢性原发性疼痛模型[4],也可以作为可塑性疼痛的模型。
EGCG 是1985 年首次在日本从绿茶中检测和化学鉴定出来的一类儿茶素[20],具有多种生物活性,如清除活性氧和氮抗氧化作用,抑制一氧化氮(NO)、前列腺素E2、环氧化酶、诱导型一氧化氮合酶(iNOS)和白细胞介素等多种炎症介质的合成[21]。Choi 等[9]首次报道了鞘内注射EGCG(30 μg)可减轻SNL 大鼠的机械疼痛异常,镇痛效率达69.2%,机制上认为可能与阻断神经元型一氧化氮合酶(nNOS)而非iNOS 表达来抑制NO 合成有关。此后较多的研究发现鞘内或腹腔注射EGCG 可通过抑制脊髓胶质细胞、椎间盘或关节软骨的炎症或氧化反应来缓解不同类型的大小鼠慢性继发性疼痛,如神经病理性疼痛(CCI[11]、SNL[10])、神经根性疼痛[14]、骨癌相关疼痛[22]、骨关节炎疼痛[23]。此外,2012 年Renno 等[13]报道腹腔注射EGCG(50 mg/kg)可通过减少骨骼肌凋亡基因的过表达促进大鼠坐骨神经挤压伤后肌肉功能恢复以及机械、热感觉异常的缓解,2014 年[24]又再次发现大鼠脊髓损伤急性期或慢性期静脉滴注EGCG(20 mg·kg-1·h-1,持续36 h)可调控脊髓轴突生长(GAP-43 标识)和胶质增生(GFAP 标识),恢复运动功能以及改善双后肢触觉异常反应和机械痛觉阈值。这些研究均证实在复杂的继发性疼痛情况下,EGCG 可主要通过神经外的机制来缓解慢性疼痛。
那么EGCG 是否能调控非神经损伤非炎性刺激引起慢性原发性疼痛或中枢神经系统痛觉处理增强的可塑性疼痛呢?为回答这一疑问,本研究采用HFS 诱导的慢性疼痛模型对此进行了初步的探讨。与之前慢性继发性疼痛相比,我们发现EGCG单次鞘内提前1 h注射能剂量依赖性翻转HFS引起的机械痛阈下降,镇痛作用持续1 W 以上(图1A);此外,最大镇痛效率可达到84.95%(图1B)。机制上,我们分别从脊髓背角突触后、突触前以及胶质细胞激活三个方面进行了机制探讨。我们发现EGCG 能显著抑制HFS 诱导的同侧脊髓背角神经元c-Fos 阳性细胞数及荧光强度的增加(图2),还能降低CGRP+感觉神经末梢(图3)。此外,与以往研究一致[11-12],EGCG 还能抑制脊髓背角小胶质细胞和星形胶质细胞的激活(图4),尤以抑制小胶质细胞显著。已知EGCG 具有强烈的抗氧化作用[10,21],而脊髓背角神经元[25]或胶质细胞[26]中活性氧(reactive oxygen species,ROS)是神经性疼痛的关键分子。据此,我们推测EGCG 缓解慢性原发性疼痛也可能与其抗氧化作用有关。综上所述,除抑制胶质细胞的激活外,低剂量的EGCG 在慢性原发性疼痛中发挥镇痛作用可能与直接抑制髓背角神经元兴奋性和突触前CGRP+终末数量有关。此外,我们还发现之前报道鞘内注射EGCG缓解神经病理性疼痛的剂量都非常高,如CCI模型中[11],EGCG 大鼠给药是1 mg/kg,10 μL,术前1 d至术后3 d每天一次,约等于小鼠剂量140 μg;SNL模型中[10]EGCG 大鼠给药为10 μg,约等于小鼠剂量7 μg。反而本研究中50 μmol/L 10 μL EGCG 缓解小鼠慢性原发性疼痛的剂量相当于229.19 ng,只有之前剂量的(0.16~3.27)%。以上结果不仅表明EGCG 对慢性原发性疼痛的镇痛效果更为显著,也提示低剂量的EGCG可能直接通过影响痛觉的神经传导通路来起作用。
2004 年Tachibana 等发现生理浓度的EGCG(0.1~1.0)μmol/L通过其受体67 ku层粘连蛋白受体(67 ku Laminin receptor,67LR)能抑制肿瘤细胞的增殖[27]。本研究初步证实EGCG对雌性小鼠HFS诱导慢性原发性疼痛的预防作用。那么EGCG的上述镇痛作用是否由67LR介导?对雄性小鼠是否也有相似的作用?此外,EGCG 是否还具有治疗作用以及其具体的分子机制等问题还待进一步探讨。
综上所述,本研究初步证明低剂量的EGCG 可通过局部抑制突触前、突触后以及胶质细胞三个环节来缓解HFS 诱导的慢性原发性疼痛。因此,EGCG 有望成为治疗慢性原发性疼痛的潜在药物,具有良好的临床转化前景。

