光催化-微生物耦合固碳研究进展
郭禹曼,洪学明,樊 彬,吕永琴
(北京化工大学 生命科学与技术学院 北京市生物加工过程重点实验室 国家能源生物炼制研发中心,北京 100029)
《巴黎协定》规定,将全球升温幅度控制在2 ℃内,并致力于实现1.5 ℃温控目标[1],全球承诺在21世纪中叶左右实现CO2净零排放目标的国家越来越多。针对此,2020年,我国提出了两项重要目标,即力争于2030年前实现“碳达峰”,于2060年前达到“碳中和”。然而,现有的方案基本只是依赖能源结构的调整,例如提高化石能源利用效率和增加清洁能源利用比例等,并不是控制大气中CO2含量最有效的方式,如能结合CO2的高效捕集与转化技术[2],则可进一步减缓大气中CO2浓度的增长。
人工光合作用作为最具前景的碳中和手段之一,其目标是利用光能作为原始驱动力,将CO2高效还原为气体、液体燃料[3]或进一步转化为可降解生物塑料[4]等高附加值的产品,以实现对CO2的清洁、资源化利用。相比于CO2的热催化转化,人工光合作用能在常温常压下发生反应,能量来源更加清洁。随着光伏发电等技术的迅猛发展,现今人工光合作用主要包含光化学催化和电化学催化两种方式。与电化学催化相比,光化学催化能够直接利用一级能源即太阳能,可以更有效地避免能量在多级转化过程中造成的损耗。
自1972年Fujishima等[5]在TiO2电极上发现了水裂解现象以来,光化学催化蓬勃发展,国内外研究者开发了多样的光催化剂,实现了在多种化学反应中对光能的直接利用。受自然界光合作用的启发,研究人员基于无机和有机半导体材料构建了多种光催化人工光合体系[6-8]。纯人工的光催化体系尽管具有较高的能量效率,然而产物选择性差,针对CO2的还原反应往往只能得到低碳数的还原产品[9]。自然界中的植物和一些自养微生物能够通过其固有的固碳途径吸收CO2,并将CO2高选择性和特异性地转化为长碳链的代谢产物。然而,天然固碳途径的固碳效率低,难以直接应用于工业化生产。人工化学催化与生物催化的耦合体系集成了二者的优点,在近年来得到了迅速的发展,其中,光催化-微生物耦合固碳体系通过太阳能激发人工光催化材料产生高能量电子,为微生物细胞提供能量和还原力,驱动高效固碳和产物合成。该耦合体系一方面具有较高的能量转化效率,另一方面也能专一性合成更长碳链的产品[10],有望获得全新的人工生物固碳体系,革新碳循环模式。
本文从光催化的原理出发,探讨了光催化-微生物耦合固碳体系设计的基本条件和思路,总结了近年来该领域的突破性进展,并对耦合体系未来的发展方向进行了展望。
1 光催化原理
半导体材料的光催化能力来源于晶格中原子轨道的线性重组和分裂,产生能量较高的反键轨道集合(导带,CB)和能量较低的成键轨道集合(价带,VB)[11],二者之间的能级区间通常称为禁带。一般来说,导带底端的能级位置能够衡量其受光激发产生电子的还原能力,导带底端能级越负,则光激发高能态电子的还原能力越强;相对的,价带顶端的能级位置能够衡量其受光激发遗留空穴的氧化能力,价带顶端能级越正,则光激发遗留空穴的氧化能力越强[12]。对于一个半导体光催化剂,其发生催化反应的过程如图1所示。以还原反应部分为例,半导体材料受到光的激发,位于VB顶端能级的电子吸收能量发生跃迁,跃迁至能级更负的CB,跃迁后的电子趋于向能量更低处流动。因此,可能会发生3种情况:①电子与空穴发生复合,并将多余的能量以光能和热能等形式释放到半导体外;②电子被反应体系中的电子介体(M)接收,并进一步被传递出去;③电子被半导体材料表面吸附的反应物分子利用,发生还原反应[13]。
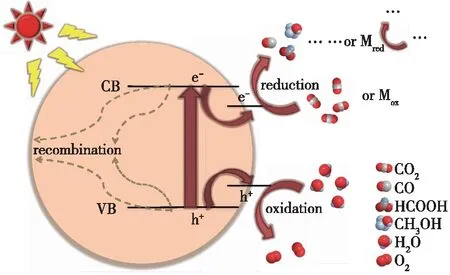
图1 光催化CO2还原的基本原理
由此可以总结出完成一次CO2还原反应的基本微观过程:①材料吸收光,产生电子-空穴对;②电子与空穴发生分离,各自迁移至催化剂的表面;③在催化剂表面,电子被CO2分子利用,发生还原反应,空穴由水或其他电子供体分子猝灭,发生氧化反应[14]。在反应的过程中,半导体材料的能级结构和电子-空穴分离能力、CO2分子和反应中间体的吸附情况及副反应等均会对CO2还原的结果产生重要影响。因此,实现CO2光催化还原要求半导体材料的禁带位置和宽度合适:即在不考虑能量损失的情况下满足CB底端位置高于CO2还原反应能够发生的还原电极电位;如VB顶端位置低于析氧反应的电极电势时,则能够发生析氧反应,否则需要添加空穴牺牲剂;整体禁带宽度以不超过3.20 eV为佳,否则将导致材料吸光波长过短,造成对可见光资源的浪费。
常见半导体的禁带位置及CO2还原标准电极电位(以标准氢电极(SHE)为基准,pH7),如图2所示。同时,材料本身应具有良好的电子-空穴分离能力和适当的CO2吸附能力。电子-空穴分离能力显示了材料的能量利用效率,对CO2的吸附能力说明与其他竞争反应相比,材料对CO2还原反应的专一性。除此以外,半导体材料对CO2还原中间体的吸附能力是衡量反应选择性的重要指标。如Sabatier原则[15]指出,催化剂对中间体CO的吸附能大小可以作为预测CO2还原产品的依据。目前的研究一般都以密度泛函理论(DFT)计算的结果作为参考,以获取催化剂对各步中间体的吸附能大小。
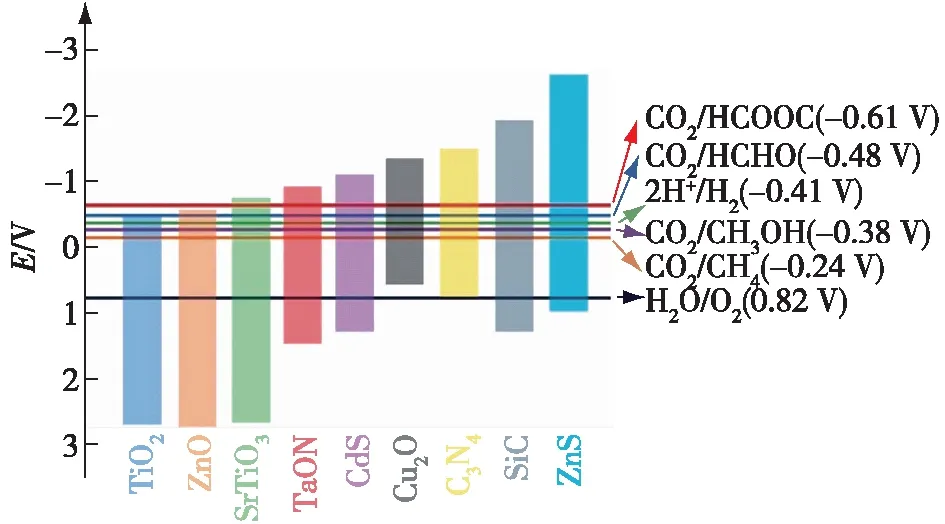
图2 常见半导体材料的带隙位置及CO2还原电极电位[16]
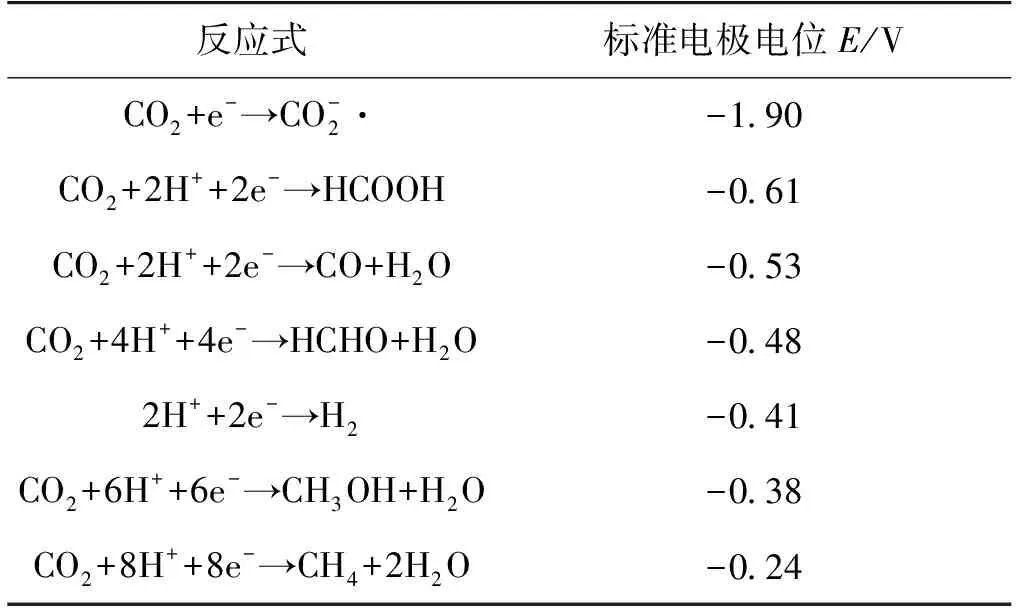
表1 CO2还原以及析氢反应的还原电极电位[18]
CO2通过2、4、6和8个电子还原过程可以生成不同的产品,现有的CO2人工催化还原产品通常为经历2电子还原的CO和HCOOH,虽然生成甲醇、甲烷等产品所需的外加电位更低,但其反应历程也更加复杂[13]。此外,由于碳碳键偶联的过程需要克服脱附产物在催化剂表面较高的再活化能垒[19],生产多碳产品仍是当今CO2人工催化还原领域面临的重要困境。相比之下,析氢反应的历程简单、所需电极电位相对较低,具有热力学和动力学上的双重优势[20]。
总之,为了有效避免CO2水溶性差、还原能垒高、催化产品单一以及选择性差等劣势,精确控制催化剂的吸附和反应位点,进一步提升电子-空穴分离效率,并提高催化剂的长期使用稳定性等是设计催化剂时必须考虑的因素。尽管一些光催化剂对单碳产品的选择性能够超过90%[21-22],但利用人工催化剂专一性生产多碳产品仍然是目前的研究难点。
2 生物固碳途径
目前已验证的天然固碳途径有6种,卡尔文循环即Calvin-Benson-Bassham 循环(CBB循环,也称还原性戊糖磷酸循环)、还原性三羧酸循环(rTCA循环)、Wood-Ljungdahl 途径(WL途径,也称还原性乙酰辅酶A途径)、3-羟基丙酸循环(3-HP循环)、3-羟基丙酸/4-羟基丁酸循环(3HP/4HB循环)和二羧酸/4-羟基丁酸循环(DC/4HB循环)。这6种生物固碳途径涉及了9种不同的关键固碳酶[23],除3-HP循环固定1分子CO2需消耗1.67分子的NAD(P)H以外,其他循环固定1分子CO2均需2分子的NAD(P)H[19]。由此可见,提升天然途径的固碳效率需要充足的还原力,但NAD(P)H等辅因子的昂贵生产成本限制了其进一步应用。针对此,研究人员利用g-C3N4、卟啉衍生物和晶态多孔有机骨架材料等光催化材料在体外实现NAD(P)H的高效光催化再生[24]。目前的研究普遍认为,在光催化-微生物耦合体系中,光催化材料通过太阳能激发产生的高能电子促进胞内NAD(P)H再生,从而驱动高效固碳。
天然的固碳途径往往存在核心酶效率低、能量损失大以及严格厌氧等问题,通过基因工程、酶工程等手段对天然固碳循环进行改造或构建人工固碳循环将有助于固碳效率的提升。例如Liao团队的Yu等[25]设计构建了苹果酰辅酶A-甘油酸(MCG)途径,在该途径中添加高活性固碳酶Ppc,将乙醇酸转化为乙酰辅酶A以降低光呼吸过程中的碳损失,在光合有机体中,MCG途径与CBB循环耦合,增强了乙酰辅酶A的合成。2016年,Erb团队的Schwander等[26]构建了一种由17种酶组成的代谢网络——CETCH循环,并通过酶工程和代谢工程优化,实现了无细胞多酶催化的CO2连续固定。2021年,天津工业生物所的马延和团队的Cai等[27]在无细胞体系中构建了由11个核心反应组成的人工合成淀粉途径ASAP,该途径以人工CO2加氢为起始耦合多种酶反应,最终每克催化剂转化CO2的速率高达22 nmol/(min·g),比玉米中淀粉的合成速率高8.5倍。
通过基因工程手段在代谢活力强和环境适应性强的异养微生物中建立固碳循环,有利于进一步推动固碳生产走向工业化应用。2016年,Milo团队的Antonovsky 等[28]结合代谢重组和实验室进化的手段改造大肠杆菌,通过非天然CBB循环,该菌株能够将CO2转化为糖和其他生物质。Steiger团队的Gassler等[29]在2019年通过添加8个异源基因和缺失3个天然基因,将毕赤酵母的甲醇同化途径改造为类似CBB循环的CO2固定途径,改造后的细胞能够利用CO2为唯一碳源进行自养生长。2021年Hu等[30]在大肠杆菌中开发了一种CO2固定系统,结合CdS纳米颗粒与CO2固定途径构建CO2固定模块,通过设计分子开关与锚定视紫质构建CO2减排模块,在光照下将由葡萄糖生产苹果酸和丁酸的产量提高到了理论值(图3)。通过将异源金属蛋白PbrR锚定在大肠杆菌的细胞膜上,半导体材料CdS在细胞表面发生自沉积,由此搭建的CdS光系统成功提高了胞内NADH的含量。
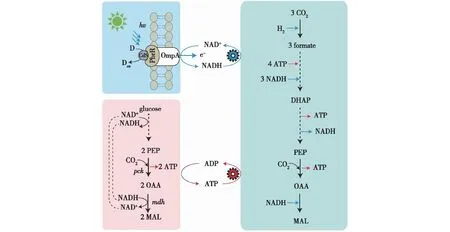
PEP—磷酸烯醇式丙酮酸;OAA—草酰乙酸;MAL—苹果酸;DHAP—磷酸二羟丙酮
与天然固碳微生物相比,在大肠杆菌、酵母等模式工程菌中构建固碳途径往往能够获得更高的CO2固定效率[30],并有望通过固碳新途径的挖掘优化进一步扩展固碳产品的多样性。
3 光催化-微生物耦合固碳系统的理性设计
尽管通过材料掺杂[31]、负载[32]和异质结[33]等方法可以有效提升光催化剂的电荷分离效率,但是单纯依靠光催化剂跨越CO2还原的能垒仍较为困难,也很难实现碳碳键(C—C)的偶联。同时,与自然界中的光合作用相比,光催化材料不具备天然催化剂的高选择性、低能耗、可自我复制及可自我修复等性能,因此在催化产品的专一性、潜在产品的多样性和长期催化的稳定性上仍有很大的差距。
自然界的光合系统中,在叶绿素分子中存在离域的π键共轭结构,其中原子轨道经过线性重组得到一组能量较低的π轨道和一组能量较高的π*轨道,电子在分子轨道中填充时会优先占据能量更低的π轨道,由此产生HOMO和LUMO能级。处在HOMO能级的电子可以吸收一定能量的光子跃迁至更高的能态,并将该能量以共振传递或激子传递的方式递送至光合作用的反应中心[34]。叶绿素与半导体材料吸收光的原理相近,受此启发,研究者利用量子产率更高的半导体材料与光合[35]或非光合微生物系统耦合,借助微生物代谢体系的自我复制、自我修复和高度选择性,合成化学催化难以获得的多碳产品,并且提升了系统整体的能量利用效率[36]。其中,半导体材料与非光合固碳微生物的耦合系统,可以将光能作为微生物固定CO2的驱动力,从而实现较高的量子产率。
例如,将半导体材料结合在含自养途径(如CBB循环、WL途径)的微生物细胞膜外,当以波长合适的光照射杂合体系时,半导体产生光激发电子,该电子可被膜上特定的酶、跨膜电子转运蛋白或细胞分泌的氧化还原介体等[37]转运到细胞内部,为细胞提供还原力,从而增强固碳代谢(图4(a))。此外,将尺寸足够小的半导体材料(如,量子点[38]、纳米金[39]等)导入细胞内部,其光激发产生的电子可以直接在胞内转化为还原力(图4(b))。这种设计策略规避了电子跨膜运输缓慢的动力学阻碍,同时减少了运输过程的能量消耗[39],并且在一定程度上可以避免细胞分裂过程中半导体材料从细胞表面脱落的情况。然而迄今为止,固碳菌从半导体中直接摄取电子的机制尚不明确。避免电子跨膜运输限制的另一种策略是采用H2作为电子穿梭载体,当光照射到半导体材料上时,光生电子不被细胞直接利用,而是参与光解水反应生成H2。H2可以通过微生物细胞膜上的氢酶向胞内输送还原力,促进CO2的固定(图4(c))[40]。微生物(如,Moorellathermoacetica和一些梭菌)可利用H2/CO2通过WL途径产生乙酸[41],一些具CBB循环的自养微生物也能够利用CO2和H2为自身生长提供能源,如Ralstoniaeutropha等[42]。
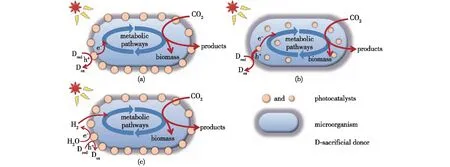
图4 光催化-微生物耦合固碳系统的设计策略
因为光照对生命系统的损伤以及人工材料固有的生物毒性的存在,所以在构建光催化-微生物耦合系统时,半导体材料的选择有较高的要求。第一,材料必须能够被可见光激发,以避免紫外光对微生物造成损害。第二,材料本身具有较高的生物亲和性和相容性。第三,半导体材料附着在微生物膜外,则要求二者紧密结合,否则会阻断电子传递。如果导入微生物内部,则半导体颗粒尺寸应足够小。第四,考虑到培养基成分的复杂性,半导体材料必须能够在此环境中保持稳定的量子产率和光催化性能。另外,体系的组装成本也是必须考虑的因素。
4 光催化-微生物耦合固碳研究进展
2015年Yang团队的Liu等[43]首次开发了一种有别于传统微生物电合系统的光电-微生物耦合体系(图5),采用光电极材料替换传统电极,实现了对光能更直接的利用:以TiO2作为光阳极捕获太阳能,通过光阳极上发生的析氧反应向光阴极提供电子和质子;利用生物相容性的硅纳米线作为光阴极,光阴极向聚集在纳米线阵列中的Sporomusaovata提供电子,S.ovata利用WL途径实现了CO2的固定。纳米线为S.ovata创造局部厌氧环境,为厌氧菌在有氧环境下的应用提供了有价值的参考。该体系具有高能量效率、法拉第效率和长期稳定性,在小于200 mV的过电位下能够实现高达90%的法拉第效率,可以持续运转200 h。而且产物乙酸可以被基因工程改造的大肠杆菌利用,生产更多高附加值的产品。
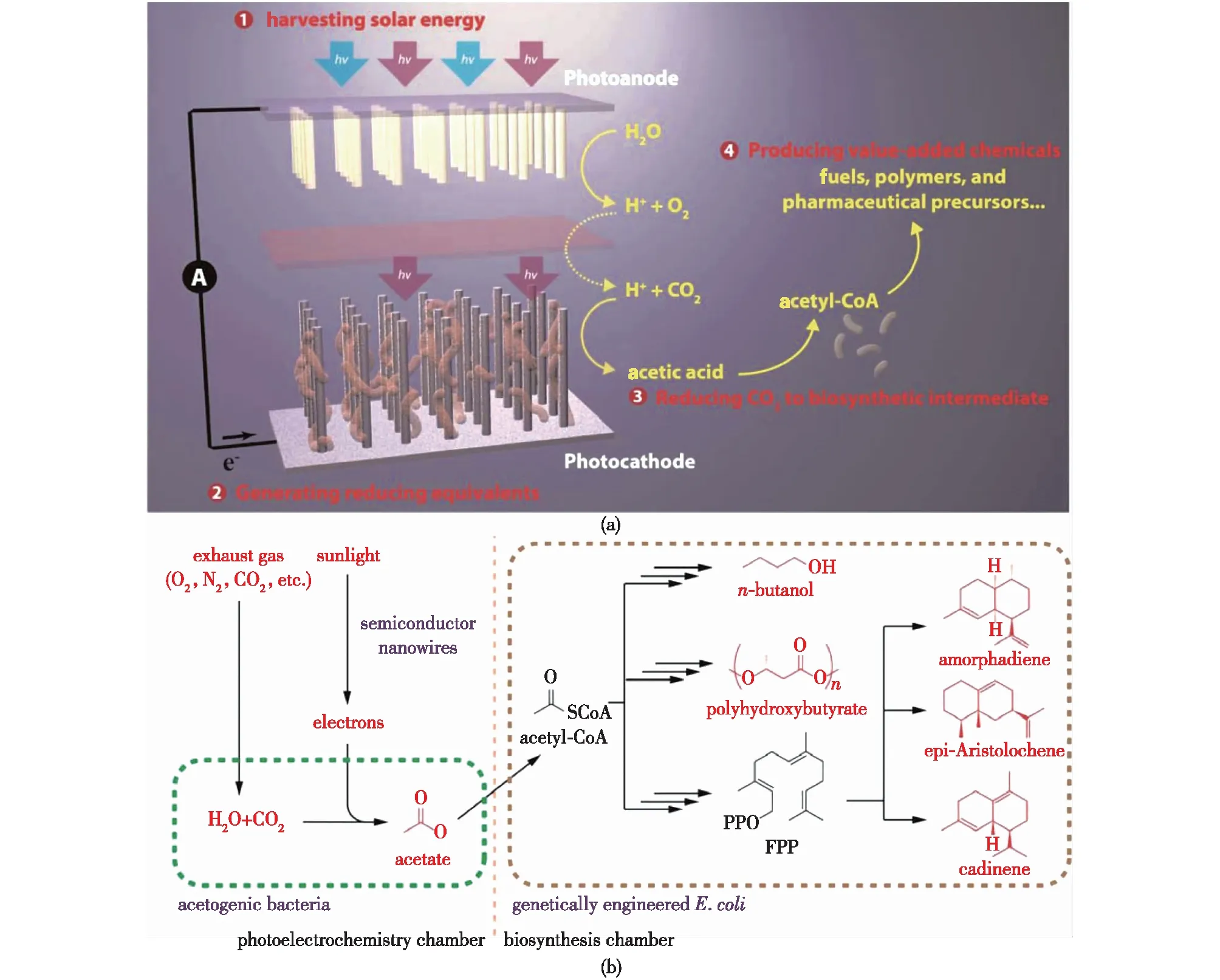
图5 光电-S. ovata系统固定CO2生产乙酸及其他下游产品[43]
CdS是一种优异的半导体材料,具有合适的能带结构,在光催化-微生物耦合固碳领域应用[44-46]十分广泛(图6)。Yang团队的Sakimoto等[44]利用一些微生物可以诱导矿物纳米颗粒沉积的特点,将CdS纳米颗粒沉积在了M.thermoacetica细胞膜上,使M.thermoacetica发生自光敏化,半胱氨酸同时作为体系的硫源和牺牲剂。在合适的光照条件下,CdS能够为M.thermoacetica提供光生电子,通过电子产生的还原力增强细菌固定CO2的WL途径,同时CdS的存在能够有效减弱细菌受到的光损伤。在低强度模拟日光照射下,总量子产率可以达到2.44%±0.62%。基于此,Wang等[45]在2019年设计开发了由Rhodopseudomonaspalustris自沉积CdS固定CO2生产PHB的系统,增强了细菌自有的光合作用。Xu等[46]开发了CdS-Cupriavidusnecator光催化-微生物耦合系统,通过CdS自沉积和人工合成CdS纳米棒2种方式增强了PHB的生产。另外,Ye等[47-48]构建了CdS-Methanosarcinabarkerit体系,利用光生电子为微生物提供还原力,实现了甲烷的高效生产。
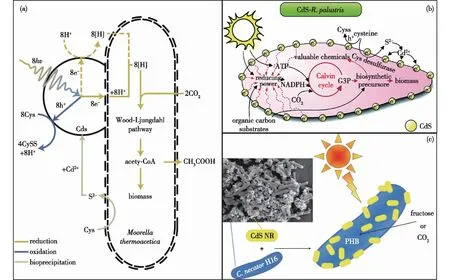
(a)CdS-M. thermoacetica耦合体系[44];(b)CdS-R. palustris耦合体系[45];(c)CdS-C. necator耦合体系[46]
2016年,Sakimoto等[49]对CdS-M.thermoacetica体系进行了改进,通过TiO2-MnPc与CdS-M.thermoacetica体系的耦合,实现了胱氨酸到半胱氨酸的循环再生,有效提升了循环稳定性。
异质结作为一种常见的复合材料设计,有利于改善材料吸光性能,促进电荷分离。除无机半导体异质结外,有机半导体异质结的生物相容性更好,可以通过静电相互作用与疏水相互作用等与细胞膜直接结合,极大地促进胞内外电子转移。2020年,Gai等[50]首次开发了一种PFP/PDI-M.thermoacetica耦合系统(图7),其中PFP与PDI间的HOMO或LUMO能级之差均大于0.3 eV,能够提供充足的电子-空穴分离驱动力。PFP与PDI以带正电的铵基基团与带负电的细菌表面通过静电作用发生吸附,同时PFP通过疏水作用插入细胞膜,增强了电子转运。经优化后,该体系的最终量子产率达1.6%,与植物及藻类全年光合作用的量子产率相当。
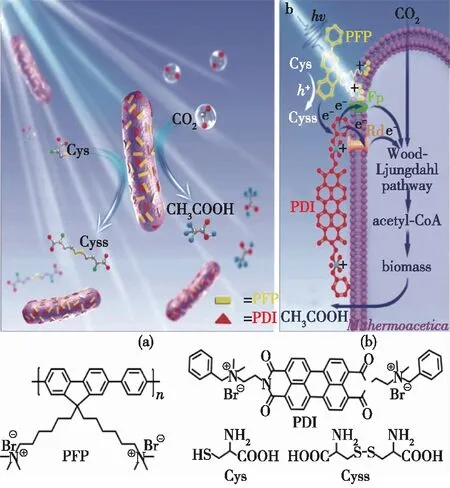
图7 PFP/PDI-M. thermoacetica耦合系统的设计(a)以及光激发电子的传递路径(b)[50]
为进一步提高光催化材料和细胞的界面结合性,Guo等[51]开发了一种人工自组装方法(图8)。首先使用酚类聚合物包封InP纳米颗粒,得到表面含有细胞亲和性基团的光催化剂,其次再利用聚丙烯酰胺盐酸盐(PAH)包封酵母细胞,在酵母细胞表面引入正电荷,最后通过光催化材料和酵母细胞的自组装构建生物杂合系统。该团队利用基因工程手段改造酵母中NADPH再生途径与中心碳代谢途径,在光照下,InP的光生电子能够跨越酵母细胞膜,促进胞内NADP+向NADPH转化,为生产莽草酸的途径提供还原力,这种设计策略有助于实现莽草酸生产途径中的碳通量最大化。在光照条件下,体系在72 h有氧生长后生产(48.5 ± 2.1)mg/L莽草酸,显著高于对照组。然而,InP与酵母之间的电子转运机制仍然尚不明确。

图8 功能化InP纳米粒子与基因工程酵母组装成模块化光催化-微生物耦合体系[51]
在上述光催化-微生物耦合体系中,光生电子都是由半导体材料在胞外产生,并通过特定的电子传递路径进入微生物细胞内,增强细胞代谢。因此,半导体材料可以被视为附着在细胞表面的微型电极,功能是向微生物输送电子,提供还原力。然而此类体系具有一定的限制:① 跨膜电子运输的动力学限制;②电子转运过程中会产生额外耗能;③材料与细胞表面结合不稳定,材料易从膜表面脱落,且在细胞分裂后难以重新形成附着体系;④微生物胞外聚合物基质的存在导致微生物直接传递电子的能力减弱[52]。目前有效的解决方案是将半导体纳米颗粒导入细胞内部,直接在细胞内提供还原力,强化细胞代谢(图9)。Zhang等[39]在M.thermoacetica细胞中成功导入了Au22(SG)18(SG,谷胱甘肽),金纳米团簇一方面捕获光能,使产生的光电子通过分布在细胞质中的氧化还原介体进入WL途径,增强CO2的固定效率,提高乙酸产率,另一方面,金纳米团簇也作为活性氧抑制剂,使细菌连续6 d以上保持高CO2固定活力。同时,利用金纳米团簇具有的高生物相容性和离散能级、尺寸可调、荧光寿命长、可功能化修饰等特点,显著增强了光催化剂与微生物细胞的亲和力。
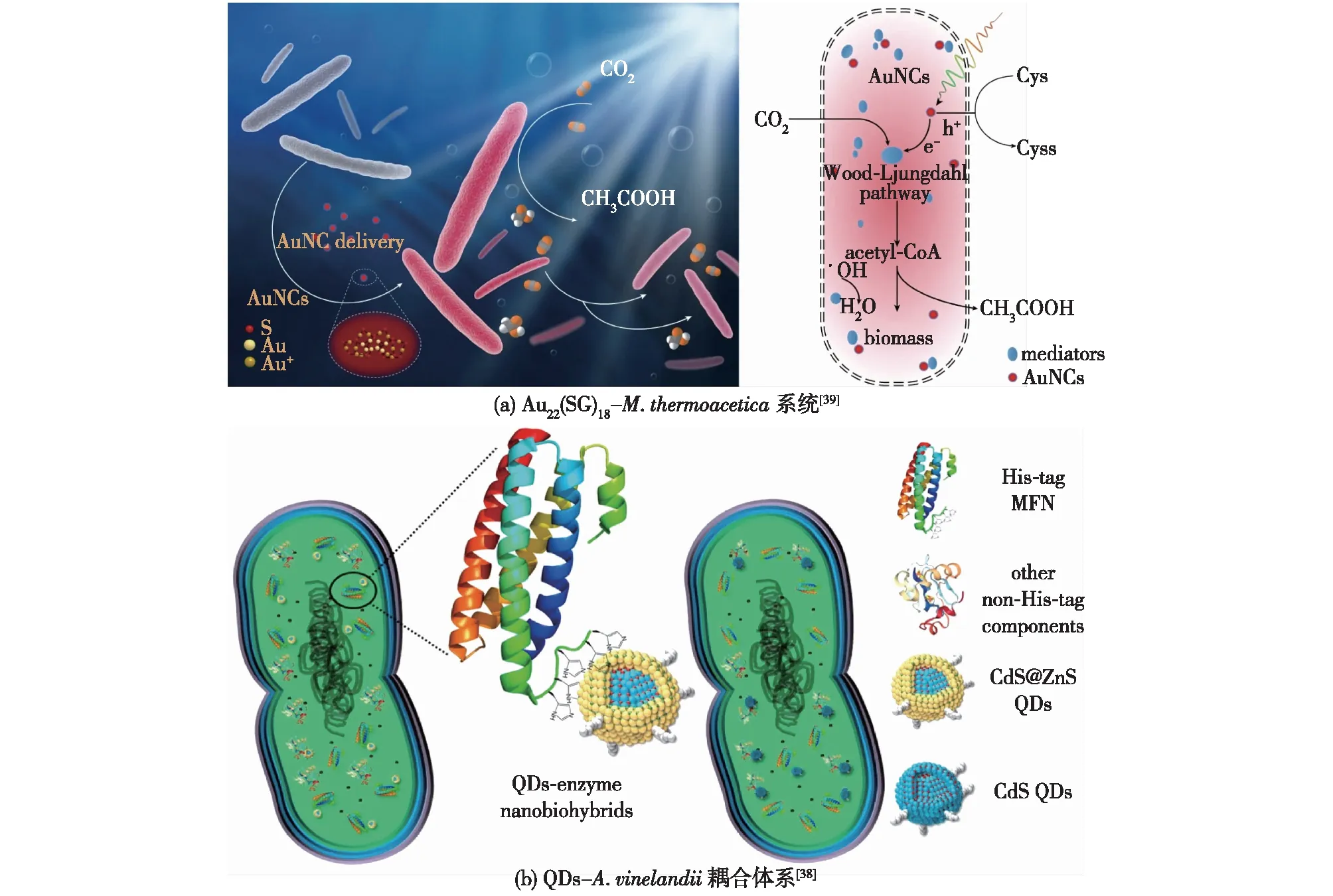
图9 细胞内耦合体系的构建
量子点是一种零维纳米材料,可以有效地将光能转化为化学能,具有尺寸小、带隙可调的性质,一般尺寸为1~10 nm,容易被细胞摄取,可以作为非光合细菌的胞内感光元件。Ding等[38]在量子点外部包裹ZnS层,利用Zn元素与组氨酸和铁硫簇的化学亲和性,将7种不同的量子点分别导入了Azotobactervinelandii和C.necator细胞内,将这两种非光合细菌转变为人工光合细菌,利用CO2、水和N2生产不同的生物燃料和化学品。通过量子点的光电子流量与酶的催化活性匹配可以增加细菌的光-化学品产率,在约为4 L的光催化反应器中利用野生型C.necator耦合量子点获得了克级的PHB产量。通过将半导体纳米颗粒导入细胞内部构建的光催化-微生物耦合系统可有效避免跨膜电子运输的动力学限制和电子转运过程中的额外耗能,但目前微生物细胞对纳米颗粒的摄取机制尚不明确。
由材料到微生物之间的电子传递通常需要二者的紧密结合,因此在设计时受到材料尺寸、界面相容性等的限制。胞外结合的体系还要求微生物自身具有由氧化还原蛋白质组成的贯穿细胞膜的完整电子传递链,这对于大部分的固碳菌株来说是无法达到的。H2作为一种易得的还原性介质,可以通过如g-C3N4、CdS等半导体材料在水中直接制得,当使用H2作为电子穿梭载体时,可以有效避免电子接收的动力学限制。这时,光催化半导体材料和细胞分别作为2个独立的模块,二者通过电子穿梭载体H2相联结,协同促进CO2的固定及转化。
RalstoniaeutrophaH16是一种异养好氧菌,同时也可在CO2、H2的条件下进行自养代谢,当碳源充足而其他营养物质受限时它可以在胞内产生和积累大量的可降解生物塑料——聚3-羟基丁酸酯(PHB)。Xu等[4]在2019年,将g-C3N4与R.eutropha相结合构建光催化体系,细菌利用g-C3N4光解水产生的H2促进了胞内NADPH的再生。以果糖为底物在电子牺牲剂TEOA的存在下,PHB的产量增加了1.4倍。随后,Tremblay等[53]对上述体系进行了优化,开发了一种无需额外添加牺牲剂的人工光合系统——g-C3N4-酶-细菌耦联系统(图10)。该系统通过引入过氧化氢酶(catalase)有效利用光解水过程中产生的H2O2,避免了H2O2对g-C3N4活性的抑制。当以果糖为底物时,PHB的产量提高为原来的1.84倍;当以CO2为碳源时,PHB产量增加了1倍。2021年,该团队采用一锅法合成了ZnSe/ZnS异质结构纳米粒子,ZnS中缺陷的存在促进了电荷分离,使该异质结构的光催化析氢能力比纯ZnSe高5.5倍。ZnSe/ZnS-RalstoniaeutrophaH16系统以果糖为底物时,PHB的产量提高了4.3倍;当以CO2为碳源时,在48 h的生长后,ZnSe/ZnS的存在将PHB的产量由裸菌的(44.32±1.00)mg/L提升至(58.09±1.60)mg/L[54]。
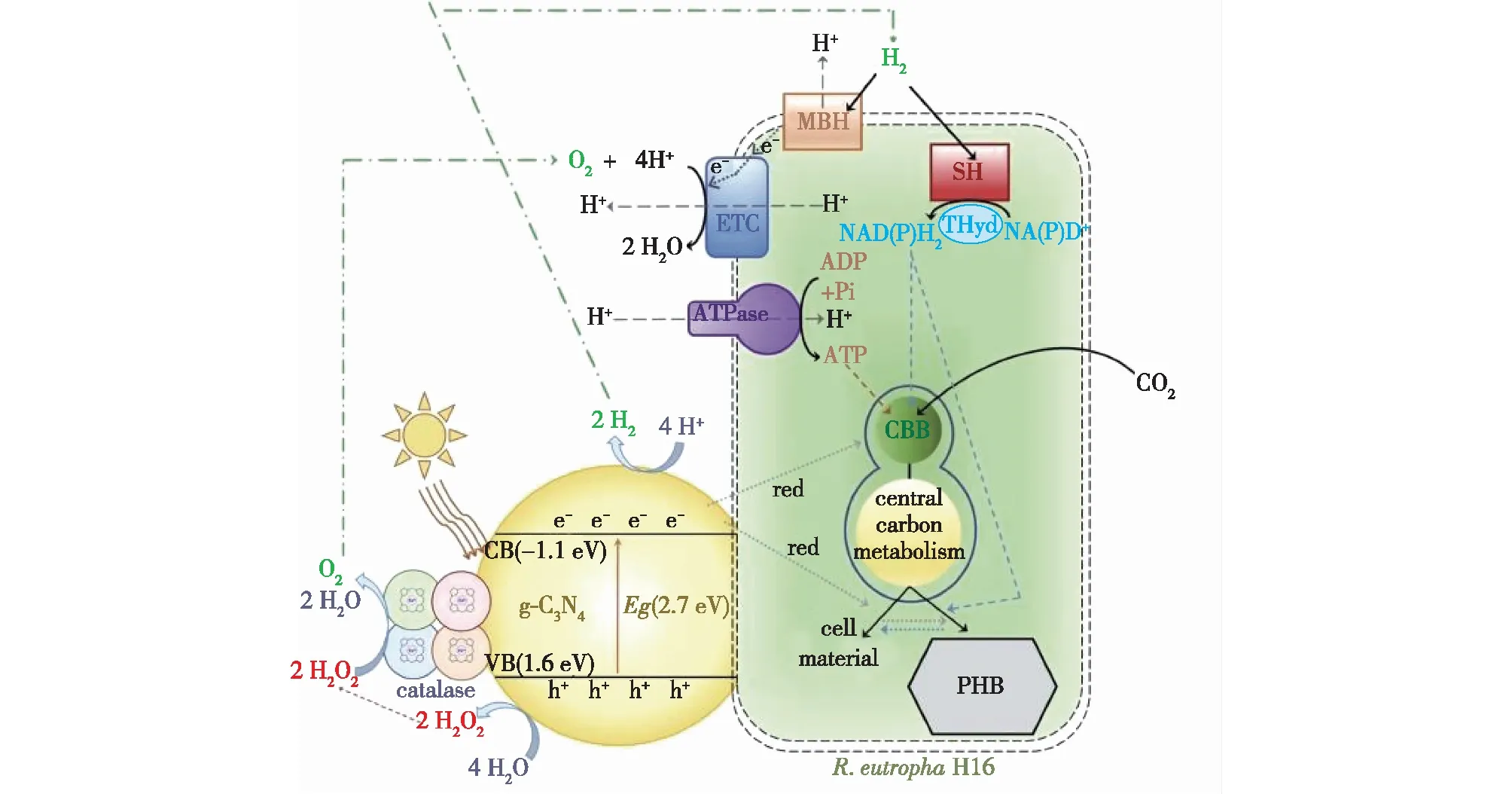
图10 g-C3N4-过氧化氢酶-R. eutropha光合自养系统促进PHB生产[51]
5 总结与展望
光催化-微生物耦合固碳系统可以实现光驱动CO2向多种产品的转化,在这类体系中,半导体材料能够通过光生电子为微生物提供还原力,实现甲烷、乙酸、PHB等产品的高效生产。但该体系的研究目前尚处在起步阶段,仍然面临着许多挑战。
1)目前的光催化-微生物耦合系统中通常采用的是CdS、AuNCs等常规光催化材料,开发一系列新型高生物相容性、高能量转化效率和稳定性的光催化材料是未来研究的重要方向之一。
2)微生物的电子摄取效率和固碳效率低,造成能量损失。通过基因工程手段在细胞膜上表达电子传递途径有利于增强电子摄取效率。同时,开发新型高效的固碳途径以获取更多高附加值产品是未来的发展趋势。
3)光催化材料和微生物细胞之间的界面相容性差。如何对光催化材料和微生物细胞进行表面功能化修饰,提高二者的界面相容性是需要解决的关键问题。
4)微生物细胞摄取光催化材料的机制有待揭示。如在Au22(SG)18-M.thermoacetica系统中,研究人员将纳米金团簇与M.thermoacetica共培养时,发现纳米金被摄取到胞内,然而摄取机制尚不明确。
5)微生物细胞的跨膜电子传递机制有待解析。如在InP-酵母系统中,酵母细胞可能通过细胞壁吸收由InP产生的光激发电子,尽管有“电子跳跃”假说,但仍缺乏完整的实验验证。
6)当以H2作为电子穿梭载体时,其在培养体系中的低溶解性不利于电子的传递,且H2的大量积累会造成安全隐患。亟待开发新型可溶性的、无毒无害的电子穿梭载体以进一步提升电子传递效率。
此外,为了实现耦合体系的工程化应用,需详细评估现有体系规模化的可能性。在处理工业废气中的CO2时,培养条件比培养基的环境更为苛刻,需要建立高适应性体系以应对不同的工业环境,如从开发细胞保护手段、采用更稳定的材料、对微生物进行基因工程改造等方面着手。
总之,光催化-微生物耦合系统能够实现CO2的清洁、高效、高选择性转化,在生物制造和生物能源方面显示了巨大的潜力。该类体系如果实现工业化应用,将有助于缓解日益严峻的环境、能源问题,为“碳达峰、碳中和”目标的实现提供一种可行的解决方案。

