错配修复蛋白联合血清肿瘤标志物与Ki-67增殖指数对结直肠癌预后的临床价值
陈 玺,曾晓颖,陈佳艳,刘 菲,唐 曦
1.复旦大学附属华东医院肿瘤科,上海 200040;2.上海市静安区统战部,上海 200041
最新数据表明,结直肠癌发病率与死亡率居全球常见恶性肿瘤第3位[1]。在中国结直肠癌发病率也居恶性肿瘤第3位,死亡率居第5位[2]。由于结直肠癌早期无明显症状,发展相对缓慢,临床表现不典型,故在早期容易被忽视。目前临床上应用较多的预后评估方式有血清肿瘤标志物、术后病理学、影像学等检查方式。
糖类抗原(carbohydrate antigen,CA)19-9、CA72-4、CA12-5、癌胚抗原(carcinoembryonic antigen,CEA)是目前在临床上比较常用的肿瘤标志物,在结直肠癌的预后评估中也具有重要的作用。因各个标志物的特异度和灵敏度均存在较大差异,虽然CEA已经被美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版分期标准作为单独的预后因素,且证据等级为Ⅰ级[3],但肿瘤细胞异质性的存在较为普遍,因此选用单项肿瘤标志物检测的方式对于结直肠癌的预后判断往往无法取得理想的效果。研究[4]结果证实,联合多项肿瘤标志物检测的特异度和灵敏度均显著高于单项检测,故联合检测对于结直肠癌患者治疗方案的选择、预后的评估均具有重要参考价值。
Ki-67增殖指数是反映细胞增殖的特异性指标,能比较有效地反映细胞的过度增殖情况,与恶性肿瘤细胞的增殖、转移密切相关[5]。DNA错配修复(mismatch repair,MMR)系统中的基因突变或甲基化,导致微卫星不稳定性(microsatellite instability,MSI),是导致结直肠癌发生的重要机制之一[6]。经流行病学调查发现MSI与10%~15%的散发性结直肠癌(sporadic colorectal carcinoma,SCC)和90%的Lynch综合征的发生、发展相关。所以MMR与SCC患者临床表型及预后的关系受到越来越多临床研究人员的关注。根据美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)2021年的相关指南,建议对所有结直肠癌患者均进行MSI/MMR检测[7]。《中国结直肠癌诊疗规范(2020年版)》推荐对所有结直肠癌患者进行错配修复蛋白表达或微卫星不稳定检测,用于遗传性非息肉病性结直肠癌筛查、预后分层及指导免疫治疗等[8]。2016年《肿瘤病理诊断规范(结直肠癌)》中也指出,有条件的单位建议对结直肠癌组织进行错配修复蛋白检测,报告错配修复蛋白表达情况(MLH1、MSH2、MSH6及PMS2),以指导临床治疗和评价预后[9]。
本研究旨在探讨免疫组织化学法检测错配修复蛋白表达联合血清检测肿瘤标志物与免疫组织化学法检测Ki-67增殖指数在结直肠癌中的相关性以及预后判断的临床价值。
1 资料和方法
1.1 一般资料
选取复旦大学附属华东医院2014年7月—2018年6月收治的234例经手术治疗的结直肠癌患者的临床资料,分析其术前血清肿瘤标志物及石蜡包埋组织标本病理学检查结果。其中男性128例,女性106例,年龄平均68.66岁(39~94岁)。通过电话访问患者或家属方式进行随访,随访起点为手术日期,随访截止日期为2020年12月31日,随访229例,失访5例,随访率为97.9%,随访时间为19~70个月,平均随访时间为40.91个月。
入组标准:①术前未接受过放化疗;② 均经术前活检及术后病理学检查确诊为结直肠癌。排除标准:①缺乏完整的临床资料;② 其他部位恶性肿瘤。
1.2 方法
1.2.1 血清肿瘤标志物检测
所有患者均通过瑞士罗氏诊断公司生产的电化学发光免疫分析系统(Cobas e602)检测CA19-9、CA72-4、CA12-5和CEA水平,试剂均从罗氏公司购买。检测方法:患者晨起空腹采肘静脉血2 mL,分离血清,根据标准操作流程检测CA19-9、CA72-4、CA12-5和CEA水平。各项指标的正常值参考范围:CA19-9为0.0~34.0 U/mL,CA72-4为0.0~8.2 U/mL,CA12-5为0.0~35.0 U/mL,CEA为0.0~5.0 ng/mL。
1.2.2 Ki-67增殖指数与错配修复蛋白检测
所有患者结直肠癌术后组织标本采用二步法Envision System法检测Ki-67增殖指数、4种错配修复蛋白(MLH1、MSH2、MSH6、PMS2)的表达情况。Ki-67增殖指数判断:Ki-67免疫涂色定位于细胞核,呈棕黄色颗粒视为阳性,Ki-67增殖指数按阳性细胞所占百分比表示。错配修复蛋白结果判断:定位于细胞核,细胞核着色视为阳性表达,未着色为缺失,其中MLH1、MSH2、MSH6、PSM2均阳性表达判定为表达正常(proficient mismatch repair,pMMR),任意一项染色缺失判定为表达缺失(deficient mismatch repair,dMMR)。
1.3 评价指标
统计患者术前血清CEA、CA19-9、CA72-4、CA12-5水平及手术标本组织中的Ki-67增殖指数与错配修复蛋白的表达,分析上述指标与结直肠癌临床病理学特征[性别、年龄、肿瘤原发病灶部位、肿瘤分化程度、TNM分期(按AJCC第8版分期标准进行分期)、淋巴结转移、淋巴管血管侵犯、神经侵犯等]及患者预后的关系。
1.4 统计学处理
采用SPSS 20.0软件对资料进行分析。计数资料比较采用χ2检验。各组数据相关性分析采用Spearman相关分析法。采用Kaplan-Meier法对各个因素的生存预后进行单因素分析,并绘制生存时间曲线。组间的差异性检验采用log-rank检验。多因素分析采用Cox比例风险模型。P<0.05为差异有统计学意义。
2 结果
2.1 错配修复蛋白表达与患者各项基本病理学参数及观察指标的关系
在234例结直肠癌患者术后标本中发生dMMR的共29例(12.4%),pMMR的有205例(87.6%),按此分为2组,进行χ2检验。
pMMR组与dMMR组在肿瘤原发部位、分化类型、分期、T分期、淋巴结转移方面的差异有统计学意义(P<0.05),主要表现为dMMR组较pMMR组更多见于右半结肠癌,在低分化腺癌及黏液腺癌中多见,T分期较晚(T3、T4比例高),但总体分期较早(以Ⅱ期为多),淋巴结转移较少见。而两组患者的性别、年龄和有无神经、淋巴管血管侵犯差异无统计学意义(P>0.05)。
而在观察指标方面,234例患者中Ki-67增殖指数采用50%为分界点,>50%分为Ki-67高阳性率组,而≤50%为Ki-67低阳性率组。术前血清肿瘤标志物水平按正常参考值分为术前正常组与术前升高组。
采用χ2检验分析后,pMMR组与dMMR组在Ki-67增殖指数、术前CEA、CA72-4的水平差异有统计学意义(P<0.05),而与术前CA19-9、CA12-5的水平相比差异无统计学意义(P>0.05,表1)。

表1 错配修复蛋白表达与患者各项基本病理学参数及观察指标的关系Tab.1 Relationship between mismatched repair protein expression and basic pathological parameters and observed indicators of patients
2.2 单因素预后分析
预后随访中,234例中5例失访,共229例患者随访成功。患者基本临床病理学因素与预后分析中,淋巴结转移组,分期较晚组生存率低,差异有统计学意义(P<0.001)。而在性别、年龄、肿瘤原发部位、分化类型、T分期各组别中差异均无统计学意义(P>0.05)。错配修复蛋白dMMR组患者的生存率为100%(29/29),pMMR组的生存率为83%,差异有统计学意义(P<0.05)。Ki-67增殖指数低阳性率组患者的生存率为91.5%,高阳性率组的生存率为82.9%,差异无统计学意义(P>0.05)。术前CEA、CA72-4正常与升高组的患者生存率差异有统计学意义(P<0.05)。其余各组差异均无统计学意义(P>0.05,表2、图1)。
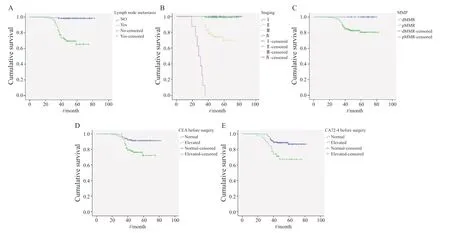
图1 不同情况下生存分析Fig.1 Survival analysis of different items

表2 单因素预后分析Tab.2 Univariate prognostic analysis
2.3 多因素预后分析
单因素分析显示,错配修复蛋白表达、淋巴结转移、分期、术前CEA、术前CA72-4水平均为影响结直肠癌患者预后的因素。多因素COX回归分析结果显示,错配修复蛋白表达、淋巴结转移、术前CEA与患者预后无显著相关,分期与术前CA72-4水平与预后显著相关(P<0.05,表3),提示较晚的分期和术前CA72-4水平升高是影响患者预后的独立危险因素。
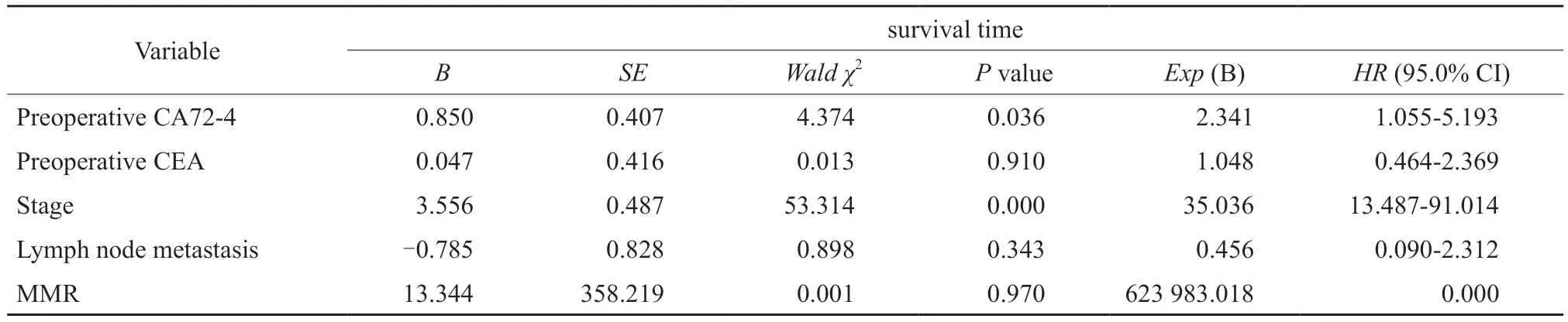
表3 预后影响因素的多因素COX回归分析Tab.3 Multivariate COX regression analysis of prognostic factors
3 讨 论
结直肠癌作为常见的消化系统恶性肿瘤之一,一般认为是由饮食习惯、生活方式、生活环境以及遗传因素等多因素共同作用下导致的结果,但是具体的发病机制仍未明确。
由于在世界范围内结直肠癌的发病率及死亡率依旧处于逐渐上升的趋势,作为结直肠癌重要发生机制之一的MMR系统的基因突变或甲基化,越来越受到临床医生及研究者的重视。
MMR系统的主要作用是在正常细胞增殖过程中,当细胞DNA在复制中出现碱基配对错误(正常细胞复制中最容易出现错配的是微卫星序列)时,MMR系统可以识别并纠正错配的碱基,保持基因转录翻译的稳定性,避免肿瘤的发生。而一旦MMR系统中的基因发生了突变或甲基化,就会导致细胞基因组稳定性下降,产生MSI,MSI使得正常的基因发生突变并使某些癌基因或突变的抑癌基因不断累积,最终导致机体产生肿瘤。
目前发现的MMR蛋白共有9种,正常时MMR蛋白无缺失称为pMMR,而当MMR系统中的基因发生突变或甲基化后,会导致相对应的MMR蛋白出现表达缺失,即为dMMR。其中MLH1、PMS2、MSH2和MSH6蛋白表达缺失是临床最为常见的dMMR类型,而MMR系统中的基因突变导致任意一种dMMR均会引发MMR系统功能障碍,导致MSI发生[10]。
国内外指南均推荐检测组织MMR和MSI状态[7-9]。不过由于MSI基因突变检测费用比较昂贵限制了其临床应用,而免疫组织化学检测法检测MMR蛋白表达因其费用较低,且具有高度敏感性和特异性,与MSI基因突变检测的一致性较高,所以近年来大多采用免疫组织化学法作为首选的方案对患者的手术标本MMR蛋白进行检测来预测MSI状态。最常见的免疫组织化学法检测结果是MSH2和MSH6染色正常,而MLH1和PMS2同时缺失,表明患者可能是Lynch综合征相关的结直肠癌或错配修复基因蛋白缺失的散发性结直肠癌。
本研究结果显示,在234例结直肠癌患者术后标本中发生dMMR的共有29例(12.4%),pMMR的有205例(87.6%),dMMR发生率与之前的研究结果相近[11]。在本研究临床病理学指标的相关性分析中dMMR组与pMMR组在肿瘤原发部位、分化类型、分期、T分期、淋巴结转移方面的差异有统计学意义,提示dMMR更多见于右半结肠癌患者,低分化及黏液腺癌为多,分期相对较早(Ⅱ期偏多),肿瘤浸润深度较深(T3、T4),淋巴结转移发生较少,提示MMR检测对于结直肠癌患者的风险和预后评估有一定的意义。在单因素预后分析中dMMR组与pMMR组的生存率差异有统计学意义(P<0.05),提示dMMR组患者较pMMR组患者预后更好,这与另一项纳入了2 940例根治性切除术后结直肠癌患者的临床试验结果相一致,dMMR导致MSI高的患者预后较好[12]。
血清肿瘤标志物CEA、CA19-9、CA72-4、CA12-5是目前临床诊疗中常用的肿瘤标志物,广泛地应用于肺癌、结直肠癌、胰腺癌、胃癌、卵巢癌、乳腺癌等多种肿瘤的诊断与预后判断中。虽然国内外的一些研究[13-15]都分别提示CEA、CA19-9、CA72-4、CA12-5有助于结直肠癌术前诊断、疗效评价及预后判断,但单一标志物的特异性都不高,需要通过联合检测来提高预测结直肠癌转移和复发的准确性[16-18]。
Ki-67增殖指数与肿瘤分化程度、肿瘤浸润深度、区域淋巴结转移及临床分期有关[19-20]。本研究显示,pMMR组与dMMR组在Ki-67免疫染色阳性率、术前CEA、CA72-4的水平差异有统计学意义(P<0.05),而与术前CA19-9、CA12-5的水平差异无统计学意义(P>0.05)。具体表现为dMMR组患者的Ki-67增殖指数大多≤50%,术前CEA正常水平者较多,术前CA72-4水平升高者较多。而在单因素预后分析中术前Ki-67增殖指数及CEA、CA72-4表达差异有统计学意义(P<0.05),提示术前CEA、CA72-4水平升高是影响结直肠癌患者预后的危险因素。
本研究通过单因素分析得到影响结直肠癌患者预后的5项变量,然后进行多因素预后分析,其中错配修复蛋白表达、淋巴结转移与患者预后无显著相关,而分期及术前CA72-4水平与预后显著相关(P<0.05),提示较晚的分期和术前CA72-4水平升高是影响患者预后的危险因素。
综上所述,错配修复蛋白表达缺失与临床病理学参数(肿瘤原发部位、分化类型、分期、T分期、淋巴结转移)具有明显相关性。错配修复蛋白表达缺失在Ki-67增殖指数、术前血清CEA与CA72-4的水平上与错配修复蛋白正常表达差异有统计学意义,对于结直肠癌患者的预后评估具有一定的意义。
但由于本研究的病例数仍偏少,且错配修复蛋白表达缺失率本就不高,这可能造成偏倚,影响了统计学结果的可信度。在今后的研究中,可调整研究方案设计,尝试前瞻性研究,并扩充样本量,纳入术后治疗方案作为评价预后的参考指标之一,减少系统性偏差。
利益冲突声明:所有作者均声明不存在利益冲突。

