抑制素B 在拮抗剂方案体外受精-胚胎移植中的变化及价值
许菲菲,顾益惠,夏 飞
(1.泰州市人民医院妇产科,江苏 泰州 225300;2.苏州大学附属独墅湖医院妇产科,江苏 苏州 215000;3.苏州大学附属第一医院生殖中心,江苏 苏州 215000)
抑制素B(inhibin B,INHB)在配子发生、卵泡的发育和成熟、胚胎发育等生殖过程中都发挥着重要作用[1,2]。目前,INHB 已经在促性腺激素释放激素激动 剂(gonadotropin releasing hormone agonist,GnRH-a)相关方案中被认为可以有效地预测卵巢功能,并且与控制性促排卵(controlled ovarian stimulation,COS)及体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)的结局相关。而随着促性腺激素释放激素拮抗剂(gonadotropin releasing hormone antagonist,GnRH-A)的出现和进一步改良,GnRH-A 方案因为适用范围广、显著减少卵巢过度刺激综合症(ovarian hyperstimulation syndrome,OHSS)的发生、减少促性腺激素(gonadotropin,Gn)的用量等诸多优点被越来越多地应用于临床[3]。本研究主要对血清INHB 水平在GnRH-A 方案中的动态变化及与IVF-ET 相关参数的关系进行研究,以期进一步探讨INHB 在GnRH-A 方案中的临床意义及其对妊娠结局的预测价值。
1 资料与方法
1.1 一般资料 选取2018 年10 月-2020 年9 月于苏州大学附属第一医院生殖中心主要因输卵管因素或男方因素,首次接受辅助生殖(IVF/ICSI-ET)助孕的81 例患者,所有患者均采用GnRH-A 方案。年龄22~42 岁,BMI 18~30 kg/m2。排除相关药物禁忌证,严重心血管系统、呼吸系统、消化系统等基础疾病,内分泌相关疾病。收集患者一般资料,包括年龄、不孕年限、BMI、AMH。本研究经苏州大学附属第一医院医学伦理委员会批准,患者自愿参加本研究并签署知情同意书。
1.2 研究方法
1.2.1 GnRH-A 方案 月经第2 或3 天(Db)检测血清性激素水平,包括卵泡刺激素(follicular stimulation hormone,FSH)、促黄体生成素(luteinizing hor mone,LH)、雌二醇(estrogen,E2)、孕酮(progesterone,P),行阴道超声监测窦卵泡情况,开始给予Gn 150~300 IU/d;当使用Gn 第5 或6 天(DGn)时,在使用Gn 的同时加入注射用醋酸西曲瑞克(Baxter Oncology GmbH,国药准字H20050128,规格:0.25 mg/支)0.25 mg/d 直至扳机日。当B 超示双侧卵巢出现直径≥16~18 mm 的卵泡并且个数≥3 个时停用Gn,并于当晚皮下注射注射用醋酸曲普瑞林(Ipsen Pharma Biotech,国药准字H20030577,规格:0.1 mg/支)0.2mg,加重组人绒促性素注射液(Merck Serono S.p.A.,国药准字S20110045,规格:250 μg/支)250 μg,35~36 h后经阴道超声引导下穿刺取卵(oocyte pick up,OPU)。
1.2.2 标本采集 采集月经第2 或3 天、Gn 第5 或6天、使用GnRH-A 2 d 后(DGnRH-A)、HCG 日(DHCG)清晨外周静脉血,应用康润生物科技有限公司的酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)试剂盒对血清INHB 水平进行检测,同时收集DHCG-内膜、Gn 用量、Gn 天数、大中卵泡数(直径≥14 mm)、成熟卵泡数(直径≥18 mm)、DHCG-E2、获卵数、2PN 受精卵数、2PN 卵裂数、优质胚胎数及胚胎数。将38 例行新鲜周期胚胎移植的患者分为ET 妊娠组(n=17)和ET 未妊娠组(n=21);将71 例进行胚胎移植(新鲜周期和/或冷冻周期)的患者分为总妊娠组(n=40)和总未妊娠组(n=31),10 例患者未行胚胎移植,其中4 例患者无可移植胚胎,6 例患者在观察期内未行胚胎移植。观察INHB 的动态变化及与体外受精-胚胎移植结局参数的相关性,比较各妊娠分组中血清INHB 水平。
1.3 统计学分析 各研究数据均采用SPSS 23.0 统计软件处理系统,计量资料均表示为(),组间比较使用独立样本t检验,各检测节点间数据使用配对样本t检验,相关性分析使用Pearson 相关系数,使用GraphPadPrism 8.0 进行绘图。P<0.05 表示差异有统计学意义,P<0.01 表示统计学意义显著。
2 结果
2.1 GnRH-A 方案中血清INHB 水平的动态变化Db、DGn、DGnRH-A、DHCG的血清INHB水平分别为(148.98 ±117.88)pg/ml、(917.73 ±398.99)pg/ml、(1121.68±413.59)pg/ml、(1100.68±417.28)pg/ml,呈现先上升后下降的趋势,见图1。
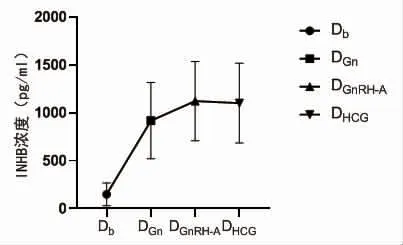
图1 血清INHB 水平的动态变化
2.2 GnRH-A 方案中血清INHB 水平与IVF-ET 相关参数的关系 DGn-INHB、DGnRH-A-INHB、DHCG-INHB与Gn 用量存在明显负相关(P<0.05),DGn-INHB 的负相关性最强,Db-INHB 与Gn 用量无明确相关(P>0.05);DGn-INHB 与大中卵泡数(直径≥14 mm)、成熟卵泡数(直径≥18 mm)、DHCG-E2、获卵数、2PN 受精卵数、2PN 卵裂数及胚胎数正相关性较强(P<0.05),DGnRH-A-INHB、DHCG-INHB、与这些参数也有较好的相关性。INHB 中与IVF-ET 结局参数相关性由强到弱的分别是DGn-INHB、DGnRH-A-INHB 及DHCG-INHB,均与优质胚胎数无明确相关性。Db-INHB除了与大中卵泡数存在正相关(P<0.05),其与成熟卵泡数、DHCG-E2、获卵数、2PN 受精卵数、2PN 卵裂数及胚胎数均无明确相关(P>0.05),见表1。
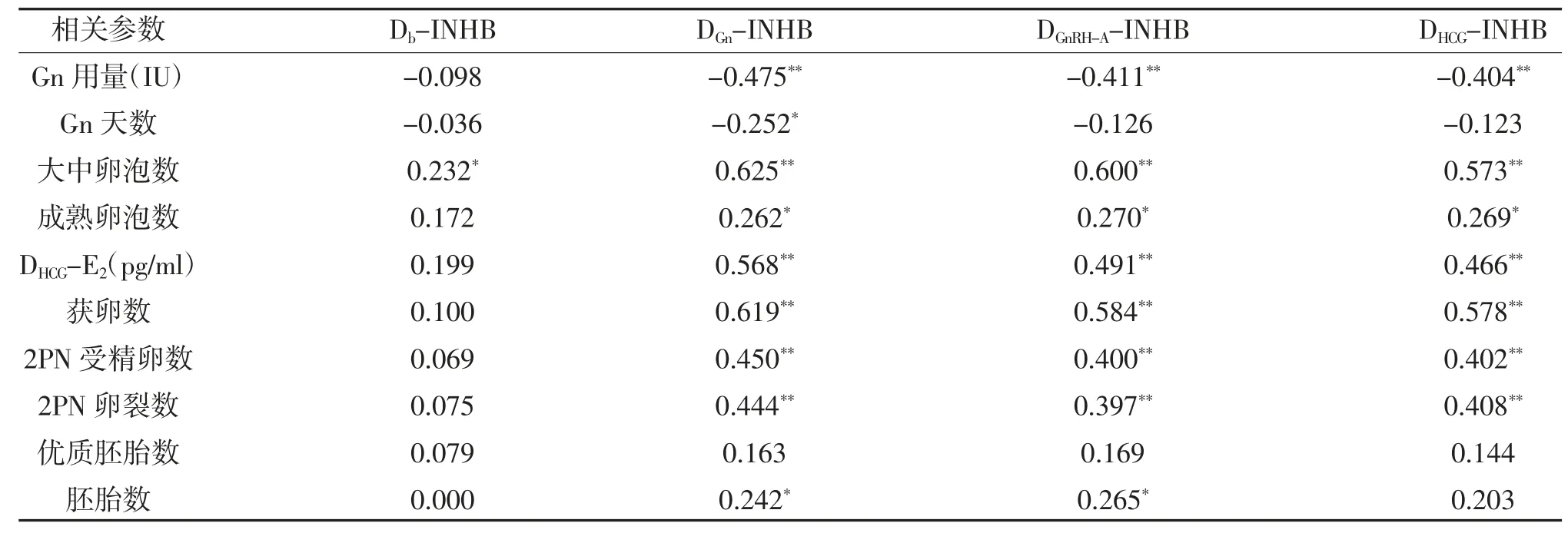
表1 血清INHB 与IVF-ET 相关参数的关系(r)
2.3 GnRH-A 方案中血清INHB 水平与妊娠结局的关系 ET 妊娠组和ET 未妊娠组中患者的一般情况分布比较,差异无统计学意义(P>0.05),见表2。ET妊娠组中各检测节点的血清INHB 均低于ET 未妊娠组,其中DGnRH-A-INHB 在两组中存在统计学差异(P<0.05),其余各期比较,差异无统计学意义(P>0.05);总妊娠组中2PN 受精卵数、2PN 卵裂数、优质胚胎数及胚胎数多于总未妊娠组,各检测节点的血清INHB 水平比较,差异无统计学意义(P>0.05),见表3。
表2 ET 妊娠组与ET 未妊娠组、总妊娠组与总未妊娠组患者IVF-ET 相关参数比较()
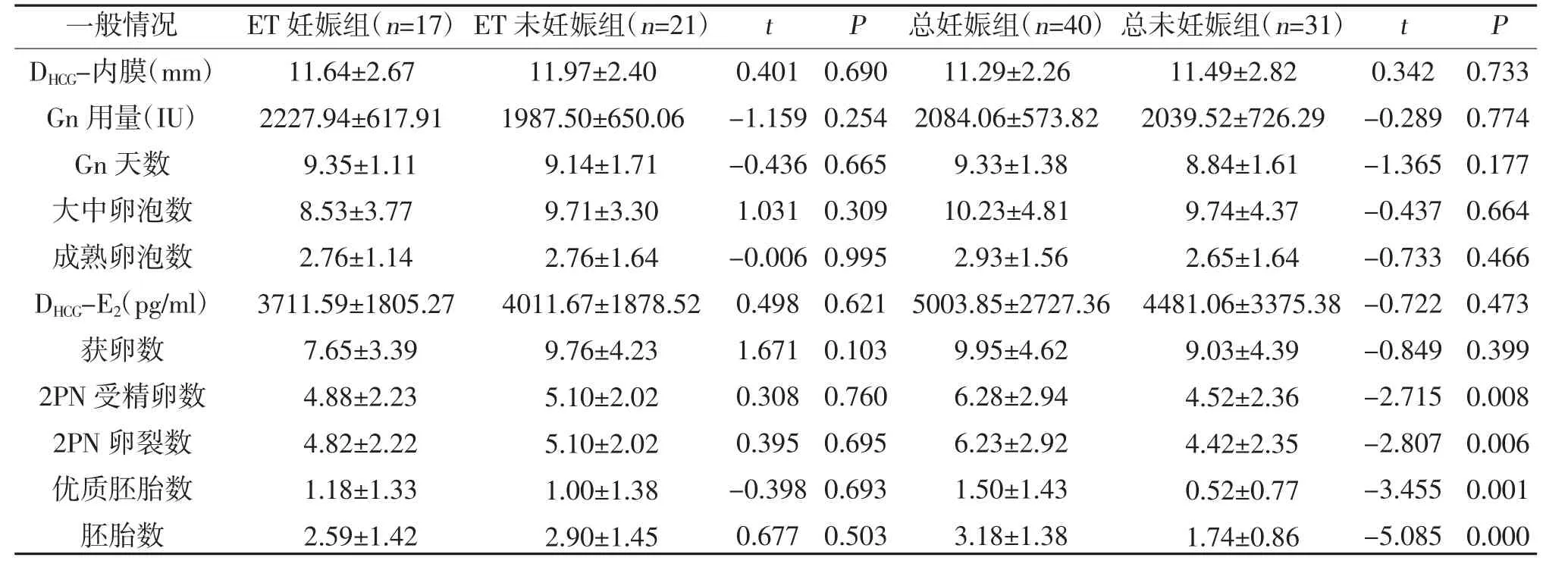
表2 ET 妊娠组与ET 未妊娠组、总妊娠组与总未妊娠组患者IVF-ET 相关参数比较()
表3 ET 妊娠组与ET 未妊娠组、总妊娠组与总未妊娠组患者血清中INHB 水平比较()
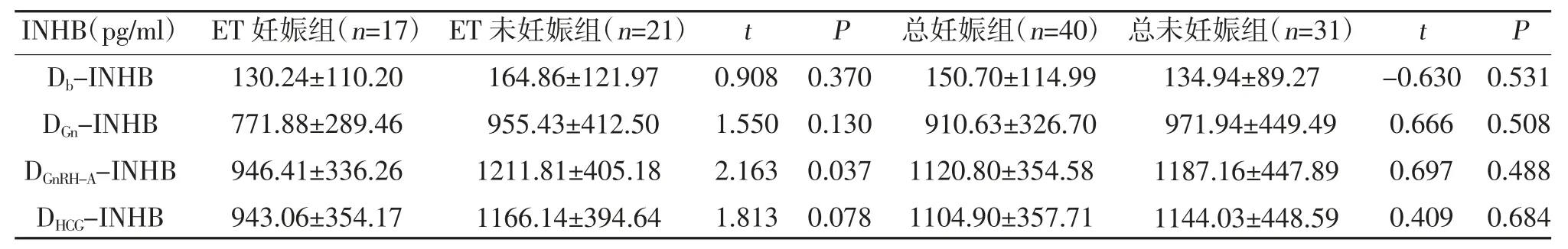
表3 ET 妊娠组与ET 未妊娠组、总妊娠组与总未妊娠组患者血清中INHB 水平比较()
3 讨论
女性体内的INHB 主要由中、小窦卵泡的颗粒细胞合成,呈脉冲式分泌。INHB 的分泌水平在幼年期很低,从青春期前开始逐渐升高,并在青春期后期达到最高峰,之后其水平逐年下降[4,5]。FSH 可以诱导颗粒细胞分泌INHB,而INHB 又会通过负反馈抑制垂体Gn 的合成及向细胞外的释放,同时INHB 还可以通过调节增加E2底物的产生来促进E2的产生[6]。在女性正常月经周期中,INHB 水平存在着动态变化,呈“双峰型”,在早卵泡期缓慢上升,卵泡中期达到高峰,于卵泡晚期和排卵前出现下降,又在卵泡破裂后出现高峰再迅速下降,并于整个黄体期维持在较低水平[7],这种变化被认为比FSH 和E2的变化更敏感。
20 世纪90 年代末,GnRH-A 开始应用于临床,主要用于生殖领域,现第三代GnRH-A(加尼瑞克、西曲瑞克)已广泛应用于临床,它替代了GnRH 部分位点上的氨基酸,减少注射刺激引起的组胺释放,从而减少注射部位的红肿、过敏等不良反应。GnRH-A 的作用原理为竞争性结合垂体上的GnRH受体,阻断内源性GnRH 对垂体的作用,快速抑制垂体细胞分泌LH 和FSH,且GnRH-A 能快速可逆并呈剂量依赖性地抑制Gn 的释放,所以GnRH-A凭借显著减少卵巢过度刺激综合症的发生、减少促性腺激素的用量、垂体抑制的可逆性、适用人群广等优点,在辅助生殖方面受到越来越广泛的应用。近几年国内各生殖中心已把GnRH-A 方案作为主流控制性促排卵方案之一[8]。既往的一些研究已经表明INHB 在多囊卵巢综合征[9]、卵巢早衰[10]、GnRH-a方案中发挥了重要的临床作用。
在应用GnRH-A 方案进行促排卵的过程中,加入Gn、GnRH-A 后血清INHB 水平均是显著升高的。外源性的Gn 主要通过刺激中小窦状卵泡颗粒细胞上表达的INHBα 及βmRNA 及蛋白,从而促进INHB 的分泌[11]。GnRH-A 加入后通过竞争性结合作用,阻断内源性GnRH 脉冲释放,直接抑制垂体细胞分泌Gn,但外源性的Gn 仍在发挥作用,并没有影响卵泡的发育,所以血清INHB 水平仍呈上升趋势。而在卵泡晚期,升高的E2及INHB 会对FSH 起到负反馈调节作用[12],同时Groome NP 等[13]的研究发现排卵前血清INHB 中的βmRNA 的表达会显著减少,这些均引起INHB 分泌的减少。
在本研究中,Db、DGn、DGnRH-A、DHCG的血清INHB水平呈现先上升后下降的动态变化,不同于激动剂方案控制性促排卵过程中的持续上升[14],是与自然周期中的INHB 水平变化趋势一致的,同时这也与GnRH-A 方案中卵泡发育更接近于生理模式相符[15]。
一般认为Gn 用量及天数越少,提示卵巢功能越好。既往的很多研究已证实,INHB 可以有效地反映卵巢功能[16,17],有关于GnRH-A 方案应用于PCOS患者的研究也提示了INHB 对卵巢的功能是存在预测价值的[18]。本研究中,DGn-INHB、DGnRH-A-INHB、DHCG-INHB 均与Gn 用量呈现显著负相关,其中以DGn-INHB 与Gn 用量、使用天数负相关性最强,即使用Gn 第5 或6 天的血清INHB 水平对卵巢功能预测价值最强。这与Peñarrubia J 等[19]在GnRH-a 方案中研究结论一致。分析其原因为INHB 主要由直径2~10 mm 的中小窦卵泡的颗粒细胞产生,其水平浓度随着卵泡直径的增加而增加,峰值出现在直径为9 mm 左右的卵泡中[20]。Gn 刺激后相应大小的卵泡数量增多,且这样的卵泡更有潜力成长为成熟卵泡。本研究提示,GnRH-A 方案中Gn 启动后的INHB 比其他时期检测的INHB 水平可以更好地反映卵巢功能。同时,一些GnRH-a 方案的研究中已有显示,基础血清INHB 水平、Gn 第5 天的血清INHB 水平临界值分别为45~50 pg/ml、400 pg/ml,对应节点的血清INHB 水平小于临界值则被认为卵巢功能下降[21,22]。
此外,INHB 还被认为是预测COS 结局的可靠指标[23]。本研究中DGn-INHB、DGnRH-A-INHB、DHCG-INHB与大中卵泡数(直径≥14 mm)、成熟卵泡数(直径≥18 mm)、DHCG-E2、获卵数、2PN 受精卵数、2PN 卵裂数及胚胎数均有明显的正相关性,但与优质胚胎数无明确相关,这其中总体以DGn-INHB 相关性最强,而经期基础的血清INHB 水平与这些参数未见明显的相关。因此,考虑经期INHB 水平更多地反映的是卵巢的储备功能,然而Abbey 近期的研究提出月经早期的INHB 也可能与黄体功能相关[24]。总之,INHB特别是Gn 刺激后的INHB 对卵母细胞及胚胎数量起到了好的评估作用,但并不能够可靠地评价胚胎质量,可能与实验人员胚胎处理、评级能力相关。
关于INHB 是否与临床妊娠相关,这一点是存在较大争议的。常飞等[25]的研究提示INHB 与妊娠率是有关的。Li Y 等[26]的研究提示INHB 动态水平与COS 结局呈正相关,但其与临床妊娠无直接关系。现INHB 在GnRH-A 方案中的相关研究还较缺乏,在本研究中,结果显示只有DGnRH-A-INHB 在ET妊娠组和ET 未妊娠组有显著的差异,其余各期的INHB 及各期间的INHB 变化均无明显统计学差异。因此推测加入GnRH-A 后的血清INHB 水平对新鲜周期胚胎移植妊娠结局可能存在预测价值。ET 妊娠组中各个检测节点的血清INHB 水平及变化均低于ET 未妊娠组,结合患者的一般情况来看,考虑在ET 妊娠组中血清INHB 水平偏低的原因可能是为了预防OHSS 发生,对部分卵巢高反应的患者行全胚冷冻,未予新鲜周期移植。本研究中已证实INHB与卵巢反应呈现正相关,这也就使得高血清INHB水平未能纳入新鲜周期进行分析,同时这也提示了高血清INHB 水平患者可能不适合进行新鲜周期胚胎移植。是否存在某种水平的血清INHB 既可以提示较多的卵泡及胚胎数量,又可以提示较理想的新鲜周期胚胎移植妊娠结局,这仍值得进一步探究。此外,后续的研究提示总的妊娠结局与INHB 水平无关,而是与优质胚胎数及胚胎数相关,有趣的是妊娠组中的血清INHB 水平也是偏低的,并且近期季兆芳等[27]、Turan T 等[28]的研究也得出类似的结论。
血清中的INHB 水平在GnRH-A 方案中与卵巢功能及IVF-ET 结局均密切相关,临床上可以结合血清INHB 水平了解Gn 用量并适当调整。若INHB 水平提示卵巢高反应,可考虑行全胚冷冻;若INHB 水平提示患者卵巢功能严重低下、预测出卵泡及胚胎情况不理想,在结合患者一般情况后可考虑取消周期,予适当的干预治疗后再行辅助生殖治疗,减少卵巢刺激相关不良反应的同时也可以降低不孕患者的经济负担。
综上所述,在GnRH-A 方案促排卵过程中,血清INHB 水平对卵巢功能、卵母细胞及胚胎数量存在一定的预测价值,可对新鲜周期胚胎移植妊娠结局提供参考依据。

