不同灭活方式对携带新型冠状病毒的物体表面标本核酸检测结果的影响
徐建男
江苏省苏州市吴中区疾病预防控制中心检验科,江苏苏州 215128
2020年2月11日,国家卫生健康委员会发布了关于修订新型冠状病毒肺炎英文命名事宜的通知,决定将“新型冠状病毒肺炎”英文名称修订为“COVID-19”,同时,国际病毒分类委员会声明将新型冠状病毒命名为“SARS-CoV-2”。目前,国家卫生健康委员会推荐的病原学检查方法是实时荧光定量PCR(RT-PCR)和新一代测序(NGS)方法,由于NGS方法存在价格昂贵、人员要求高等局限性,基层医疗机构和疾病预防控制机构仍然是以RT-PCR检测为主[1-2]。中华医学会检验医学分会发布的《新型冠状病毒肺炎病毒核酸检测专家共识》指出,需将待测标本56 ℃ 孵育至少45 min或更高温度进行灭活[3]。LECLERCQ等[4]对中东呼吸综合征冠状病毒(MERS-Cov)的研究表明其在56 ℃ 孵育25 min,病毒滴度会降低10-4,进一步升高温度到65 ℃处理15 min没有任何残留。RABENAU等[5]也发现SARS冠状病毒(SARS-CoV)在56 ℃孵育30 min后,滴度低于检测限,温度升高到60 ℃ 30 min,SARS-CoV完全被灭活。物体上携带的新型冠状病毒(SARS-CoV-2)也可以传染给人类,所以各级检测机构开展了对物体表面携带SARS-CoV-2的检测。为了明确SARS-CoV-2灭活后是否对核酸检测有影响,本研究将对灭活前和不同灭活处理方式(56 ℃ 45 min、60 ℃ 30 min、75%乙醇30 min处理)灭活后平均循环阈值(Ct值)进行比较分析。
1 材料与方法
1.1标本来源 选择区级检测机构送检的物体表面标本25份,经过RT-PCR检测结果均为阳性,其中14份(标本号1~14)标本为苏州市相城区疾病预防控制中心筛选送检的阳性标本,11份(标本号15~25)标本为苏州市工业园区疾病预防控制中心筛选送检的阳性标本。
1.2标本处理及灭活 每份标本平均分成4份,采用DMEM培养液(Gibco 公司,货号:12430-054)分别进行4种不同的处理方式:(1)未灭活组,100 μL标本+300 μL DMEM 4~8 ℃,30 min;(2)灭活组,①100 μL标本+300 μL DMEM 60 ℃,30 min;②100 μL标本+300 μL DMEM 56 ℃,45 min;③100 μL标本+300 μL 无水乙醇,形成终浓度75%的环境,4~8 ℃,30 min。
1.3核酸提取及RT-PCR检测 采用Roche MagNA Pure 96 system全自动核酸提取仪配套的MagNa Pure 96 DNA and Viral NA Small Volume Kit 提取病毒核酸,采用达安生物科技有限公司的SARS-CoV-2核酸检测试剂盒(国械注准20203400063),按试剂盒说明书在罗氏LightCycler 480Ⅱ PCR仪进行扩增,同时检测ORF和N基因,阳性判读标准参考试剂说明书。所有标本重复检测3次,记录Ct值。
1.4统计学处理 采用SPSS 17.0软件进行统计分析,未灭活组和不同灭活组间标本的Ct值采用Mauchly球形度检验和Greenhouse-Geisser 检验,以P<0.05为差异有统计学意义。
2 结 果
2.1未灭活组与灭活组标本Ct值比较 不同处理方式下ORF基因 和N基因的Ct值分布,见表1。未灭活组和灭活组Ct值比较,差异有统计学意义(ORF基因:F=48.740,Eta=0.720,P<0.05;N基因:F=65.597,Eta=0.781,P<0.05);灭活组60 ℃水浴30 min和56 ℃水浴45 min Ct值比较,差异无统计学意义(ORF基因:P=0.306;N基因:P=0.920),60 ℃水浴30 min与75%乙醇30 min Ct值比较,差异有统计学意义(ORF基因:P<0.05;N基因:P<0.05),56 ℃水浴45 min与75%乙醇30 min Ct值比较,差异有统计学意义(ORF基因:P<0.05;N基因:P<0.05)。
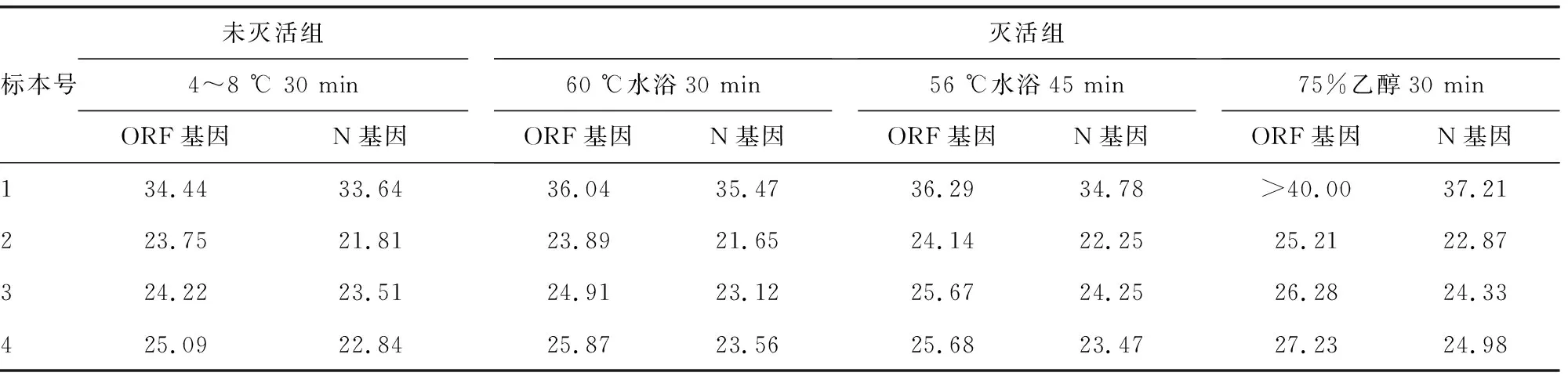
表1 未灭活组与灭活组ORF基因和N基因平均Ct值比较

续表1 未灭活组与灭活组ORF基因和N基因平均Ct值比较
2.2未灭活组和灭活组ORF基因和N基因Ct值区间变化 从图1 和图2中可以看出当未灭活组ORF基因Ct值为22~26时,未灭活组和灭活组Ct值比较接近,两组ORF基因、N基因Ct值比较,差异无统计学意义(P>0.05);随着未灭活组ORF基因Ct值的增大,未灭活组和灭活组Ct值差异逐渐加大,当未灭活组ORF基因Ct值>36时,灭活组不同处理方式下ORF基因的全部Ct值>40;而未灭活组ORF基因Ct值≥34时,75%乙醇30 min处理ORF基因Ct值>40。
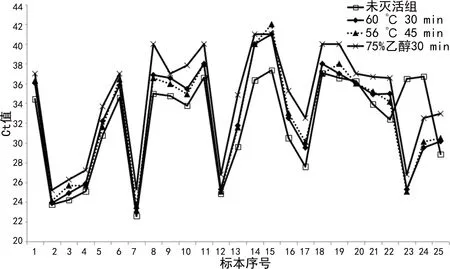
图1 未灭活组和灭活组ORF基因Ct值的区间变化
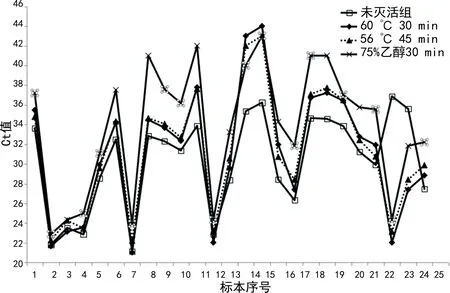
图2 未灭活组和灭活组N基因Ct值的区间变化
3 讨 论
新型冠状病毒肺炎作为突发公共卫生事件,其传播速度快,感染性强,给全人类带来了严重的健康威胁和经济负担。核酸检测作为目前确诊新型冠状病毒肺炎最主要的方法,灵敏度高,特异性强,在疾病早期快速诊断和动态观察抗病毒治疗效果中具有优势[6]。SARS-CoV-2属于β属冠状病毒,与蝙蝠 SARS 样冠状病毒同源性超过85%,具有高度的传染性[7]。《新型冠状病毒肺炎实验室检测技术指南(第四版)》中指出SARS-CoV-2对紫外线和热敏感,56 ℃ 30 min、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等脂溶剂均可有效灭活病毒[8]。
在实验室检测中如何能降低实验风险,这对全国范围内各级医疗机构开展核酸检测有着非常重要的作用,目前可采用前处理灭活病毒方式降低实验人员感染的风险。本研究发现,未灭活组和灭活组Ct值比较,差异有统计学意义(P<0.05),在未灭活组ORF基因Ct值为22~26时,未灭活处理和各灭活组ORF基因、N基因Ct值比较,差异无统计学意义(P>0.05),这与陈培松等[9]研究结果一致。随着未灭活组ORF基因Ct值增加,灭活组ORF基因Ct值相应也会增大,但是当未灭活组ORF基因Ct值>36时,灭活组ORF基因Ct值增加更大,Ct值会超过40,依据试剂盒说明书要求Ct值>40判为阴性,由此会出现漏检的可能。在灭活组中60 ℃水浴30 min和56 ℃水浴45 min Ct值比较,差异无统计学意义(P>0.05),两种灭活方式相差不大,而75%乙醇30 min相比60 ℃水浴30 min和56 ℃水浴45 min处理,Ct值增加更多,当未灭活处理Ct值≥34时,75%乙醇30 min处理就有可能会超过40,从而判为阴性。本研究中12份标本(标本号1、6、8、9、11、14、15、18、19、20、23、24)未灭活时ORF基因Ct值≥34,标本14、15、23和24号如果选择灭活处理就非常有可能判为阴性,造成漏筛。本研究发现灭活处理确实会造成RNA降解,特别是当标本携带病毒水平比较低时,灭活处理对检测结果影响较大,有可能造成漏检,这也与段秀枝等[10]研究结果一致。
由此可见,物体表面携带SARS-CoV-2的标本在核酸检测前进行灭活处理,核酸检测阳性结果有可能转阴,采用75%乙醇30 min处理相比60 ℃水浴30 min和56 ℃水浴45 min处理转阴的概率更大。因此,在保障生物安全的前提下,是否进行标本灭活处理,各实验室需慎重选择,避免出现漏检。
本研究分析了采用不同灭活方式对物体表面SARS-CoV-2核酸检测结果的影响,这是目前实验室检测过程中遇到的现实问题,市一级疾病预防控制中心为了确保后续研究和满足阳性标本的复核需要,一般不进行灭活检测,但是目前开展检测的医疗机构都对拟检测标本进行了灭活,而且灭活的条件还不尽相同,遇到核酸滴度很低的标本时极易漏检,而这种漏检在特殊情况下有较大传播风险,尤其是在大面积筛查时应注意这种风险。另外,由于灭活会升高临床检测标本的Ct值,而这在实际检测中会导致该类灭活标本(临界标本)结果不易判读,结果经常出现单靶标阳性,复核也不易得到准确结果,造成漏检或误判。因此,在高度怀疑标本为阳性标本时不建议事先进行灭活处理,可以在做好个人防护的情况下利用提取核酸的过程完成灭活,这样能尽量避免漏检。
本研究中的实验室数据还比较粗糙,样本量较小,还不能很好地推广结论。因此,建议扩大样本量,并使用其他高灵敏度的方法或抗原抗体方法来验证是否漏检,以进行更可靠的评价。

