抗坏血酸和水杨酸丸衣对NaCl胁迫下紫花苜蓿种子发芽特性的影响
欧成明,赵美琦,孙铭,毛培胜
(中国农业大学草业科技学院,草业科学北京市重点实验室,北京 100193)
紫花苜蓿(Medicago sativa)是一种多年生豆科牧草,因为其具有抗逆性好、优质高产等特点,被誉为牧草之王[1]。紫花苜蓿通过生物固氮的作用能对土壤进行改良[2],不仅有较高的经济利用价值,对生态环境的保护和修复也有很大的利用价值,在我国农业、畜牧业发展和保护生态环境中发挥着重要的作用[3],被广泛种植在盐碱地、滩涂地以及土壤退化地区进行土地改良和草原恢复。
盐胁迫作为一种主要的非生物胁迫,对植物种子的萌发、植物生长的速率、植物的光合作用等大部分生理代谢过程都会造成影响[4],尤其影响种子萌发和幼苗生长,在玉米(Zea mays)[5]、油菜(Brassica napus)[6]、燕麦(Avena sativa)[7]的研究中发现,当盐浓度到达某一阈值时种子的发芽势、发芽率降低,幼苗长度缩短,种子活力降低。郭湘等[8]进行了苜蓿耐盐性研究,结果表明当NaCl浓度达到250 mmol·L-1时,胚根生长受到显著抑制;种子萌发过程中的渗透调节能力下降,抗氧化酶活性降低,活性氧大量积累,种子萌发和幼苗生长受到明显抑制[9]。种子包衣技术是一种能增强种子抗逆性,促进种子萌发的种子处理技术,研究发现用黄腐酸、胺鲜酯和微肥对苜蓿种子进行包衣处理,能有效提高出苗率[10];用腐熟羊粪对老芒麦(Elymussibiricus)种子进行包衣处理,可以提高种子活力和幼苗的抗逆性[11],用脱硫石膏和粉煤灰对野牛草(Buchloe dactyloides)种子进行包衣处理,可以提高野牛草种子在盐碱地的发芽率[12]。目前,国内外工厂的膜衣、壳衣和丸衣等包衣工艺已经很成熟,但针对不同逆境条件促进种子萌发的丸衣技术,一直都是牧草种子加工研究与实践的重点。
氧化胁迫是植物响应盐胁迫的一种形式,盐胁迫会使植物体内活性氧(reactive oxygen species,ROS)增加,过量的ROS会对脂类物质进行攻击,造成细胞损伤[13]。抗坏血酸(ascorbic acid,AsA)是一种普遍存在于动植物组织中的抗氧化剂,也叫维生素C,化学名是L-苏糖型-六-2-烯醇-1内酯[14]。AsA是许多物质代谢和氧化还原反应的重要参与者[15]。用AsA处理种子能有效清除种子体内的ROS,防止细胞衰老,增强种子抗逆性,提高种子活力[16]。水杨酸(salicylic acid,SA)是一种植物内源激素,普遍存在于植物体内的酚酸类物质,学名邻羟基苯甲酸。研究表明,SA可以通过诱导逆境相关蛋白的表达等来缓解逆境胁迫对植物的影响[17]。用SA对植物叶片和种子进行处理,能提高植物对盐胁迫、干旱胁迫、低温胁迫的抵抗能力,提高种子的活力和幼苗成活率[18-19]。
AsA和SA提高植物耐盐性的研究主要集中在种子引发和外源喷施,用于种子丸衣的研究较少。因此,本试验以植物盐胁迫影响机制为基础,采用不同浓度的AsA和SA进行丸衣处理,通过分析NaCl胁迫下丸衣种子的萌发情况和种苗的生长变化,以期获得具有耐盐性能的紫花苜蓿种子丸衣配方,增强紫花苜蓿种子在盐胁迫下的萌发能力,旨在提高盐胁迫下紫花苜蓿播种效率,提高盐渍土地的利用效率,为天然草地改良和人工草地建设提供技术支持。
1 材料与方法
1.1 试验材料
试验所用的紫花苜蓿种子是由酒泉大业种业有限责任公司提供的中苜1号紫花苜蓿种子(2017年收获),种子初始含水量4.3%,千粒重2.153 g,发芽势90%,发芽率97%,死种子1%,硬实种子2%。试验于2018年进行。
1.2 试验设计与处理
1.2.1NaCl胁迫浓度筛选 将紫花苜蓿未丸衣种子在不同NaCl浓度下进行纸上发芽试验,NaCl浓度(质量分数)梯度设置为0、0.50%、1.00%、1.25%、1.50%,每个处理重复4次。
1.2.2丸衣处理 用1、2、4、8 mmol·L-1AsA和1、5、10、20 mmol·L-1SA溶液对紫花苜蓿种子进行拌种(药种比1∶100),然后进行丸衣处理[20](分别记为PAA1、PAA2、PAA4、PAA8和PAS1、PAS5、PAS10、PAS20;未丸衣种子为CK1,不做拌种处理的丸衣种子记为CK2)。
1.2.3丸衣种子耐盐性能评价 在1.2.1筛选出的NaCl浓度下,对1.2.2丸衣种子进行纸上发芽试验,4次重复,测量并计算种子的发芽势、发芽率、种苗长、苗重和平均发芽时间。
1.3 试验方法
1.3.1含水量调整 因为紫花苜蓿种子含水量太低,为使含水量达到同一水平,需要进行含水量的调整,根据样品种子的初始含水量(4.3%),按照下述方法调整,目标含水量为10%。具体调整方法如下:考虑平衡速度,选择KNO3饱和溶液进行水分的调整。称取0.1 kg KNO3放入大烧杯中,加入1 L蒸馏水,充分搅拌,确保烧杯底部有结晶析出后,将溶液过夜放置,确保溶液已经达到饱和状态。称取干净饱满的紫花苜蓿种子,质量记为W0,计算出达到相应含水量时种子的质量,记为W。将种子放入74μm的筛子中,贴上标签,放入干燥器,频繁称取其质量,达到要求后立即将种子密封于铝箔袋中保存于4℃冰箱中备用。达到要求含水量的种子质量:

式中:MC0为初始含水量;MCr为需达到的含水量;W0为初始种子质量(g)。
1.3.2发芽试验 参照牧草种子检验规程(GB/T 2930.4-2017)紫花苜蓿丸衣种子发芽标准进行纸上发芽试验,选取紫花苜蓿丸衣种子100粒,将其放入盛有3层滤纸的11.5 cm×11.5 cm有盖培养皿中,设4次重复,未丸衣种子为对照(CK)。将培养皿放置于光照培养箱(GXZ-380B-LED,宁波江南仪器厂)中,在20℃恒温,光照8 h和黑暗16 h条件下培养。初次计数为第4天,末次计数为第10天。统计正常种苗数、不正常种苗数、新鲜未发芽数、硬实种子数和死种子数,待第10天发芽结束后,计算发芽势、发芽率。培养期间每24 h统计种子发芽情况,以胚根突破种皮2 mm为标准,计算平均发芽时间。

式中:t为发芽时间;n为在时间t时,新发芽的种子数。
丸衣种子发芽方法同上。
1.3.3种苗生长指标测定 发芽10 d结束后,每个重复随机选取10株种苗测量种苗长度(cm)和鲜重(g),重复4次。
1.4 数据统计与分析
采用SPSS 20.0进行二因素方差分析和单因素方差分析(ANOVA)做平均值多重比较(Duncan),显著水平为0.05。
2 结果与分析
2.1 NaCl胁迫对紫花苜蓿未丸衣种子发芽的影响
结果表明,NaCl胁迫影响了紫花苜蓿种子的萌发,延长了平均发芽时间,降低了发芽势和发芽率;种苗长和鲜重也显著(P<0.05)降低。在NaCl浓度为0.50%时,紫花苜蓿种子的发芽势、发芽率和种苗鲜重与CK处理差异不显著(P>0.05),而平均发芽时间显著(P<0.05)延长,种苗长显著(P<0.05)降低(表1)。当NaCl浓度达到1.00%时,种子的发芽势、发芽率、种苗长和种苗重都显著(P<0.05)下降,平均发芽时间显著(P<0.05)延长。1.25%和1.50%浓度的NaCl显著(P<0.05)影响了种子发芽率(表1),发芽率分别下降到了56%和24%。因此以这两个浓度作为盐胁迫浓度进行丸衣处理的筛选。
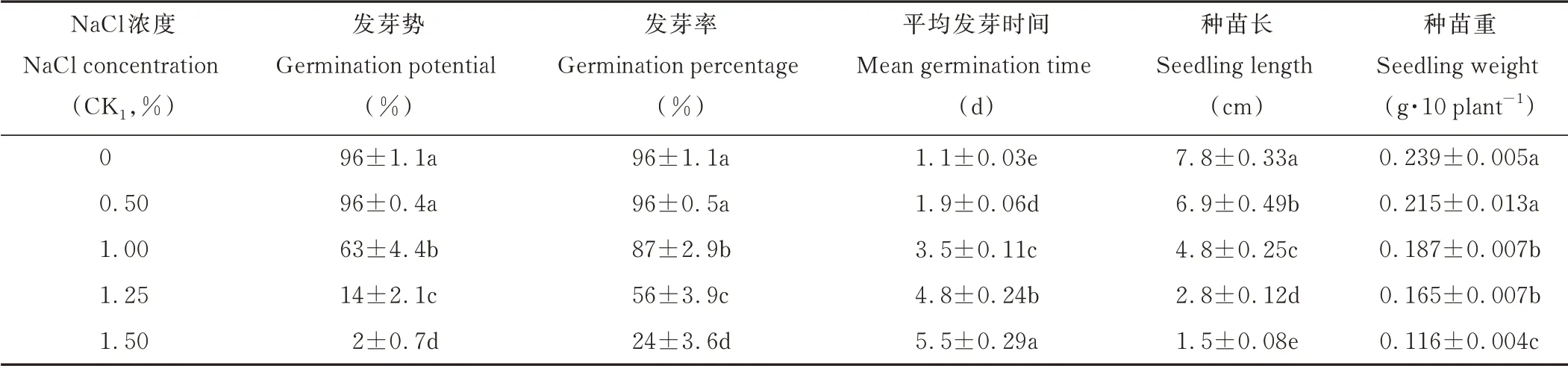
表1 NaCl胁迫对紫花苜蓿种子发芽的影响Table 1 Effects of NaCl str ess on alfalfa seed ger mination
2.2 NaCl胁迫对紫花苜蓿AsA丸衣种子发芽和种苗生长的影响
用AsA对紫花苜蓿种子进行丸衣处理,结果表明,在1.25%和1.50%NaCl胁迫条件下,AsA丸衣可以提高种子的发芽率(表2)。在0 NaCl处理中,CK1种子的发芽势和发芽率都最高,丸衣处理显著(P<0.05)延长了平均发芽时间,丸衣种子处理间发芽率和平均发芽时间差异不显著(P>0.05);在1.25%NaCl处理中,CK1种子发芽率最低,为56%,显著(P<0.05)低于丸衣种子。PAA1种子发芽势最高,为20%,显著(P<0.05)高于其他丸衣处理和CK1;在1.50%NaCl中,CK1种子发芽率最低,和CK2间差异不显著(P>0.05),且显著(P<0.05)低于PAA1、PAA4、PAA8处理,其中PAA4处理发芽率最高,其次是PAA8,发芽率分别为46%和43%。PAA2处理种子平均发芽时间最长,除PAA1外,显著(P<0.05)大于其他处理(表2)。
通过不同浓度NaCl处理,在紫花苜蓿AsA丸衣种子出苗后,测定其种苗生长情况。在0 NaCl条件下,CK1的种苗长显著(P<0.05)大于PAA8处理,但与其他处理间差异不显著(P>0.05);在1.25%和1.50%NaCl胁迫下,PAA4处理的种苗长度均达到最大,而且在1.50%NaCl时,显著(P<0.05)大于其他处理,且种苗重也是最大,但与其他处理无显著(P>0.05)差异。在1.25%NaCl中,各处理间种苗重无显著(P>0.05)差异,而在没有NaCl胁迫时,AsA丸衣处理可以不同程度的增加种苗重量(表2)。综上,紫花苜蓿AsA丸衣的最佳耐盐配方为PAA4(4 mmol·L-1AsA)。
方差分析结果表明(表3),NaCl胁迫和丸衣处理对紫花苜蓿种子发芽势、发芽率、平均发芽时间和种苗重都有显著(P<0.05)影响。NaCl胁迫和AsA丸衣处理在影响种子发芽势、发芽率、平均发芽时间和种苗重上有显著(P<0.05)互作效应。
2.3 NaCl胁迫对紫花苜蓿SA丸衣种子发芽和种苗生长的影响
方差分析结果表明,NaCl胁迫和SA丸衣处理在影响种子发芽势、发芽率、平均发芽时间和种苗长上有显著(P<0.05)互作效应(表3)。用不同浓度的SA对紫花苜蓿种子进行丸衣处理,在0 NaCl,CK1的发芽势和发芽率最高,平均发芽时间最短;CK2处理的发芽势最低,平均发芽时间最长。在1.25%NaCl时,PAS1的发芽势和发芽率最高,为17%和72%;PAS20发芽率最低,为50%,其他处理间差异不显著(P>0.05)(表2)。用SA处理的丸衣种子平均发芽时间显著(P<0.05)大于CK1和CK2,在1.50%NaCl时,PAS1处理的发芽率显著(P<0.05)高于其他处理,为42%,CK1和CK2的发芽率分别为24%和30%,随着SA浓度的增大,丸衣种子的发芽率逐渐降低;SA丸衣处理不同程度的延长了种子平均发芽时间(表2)。
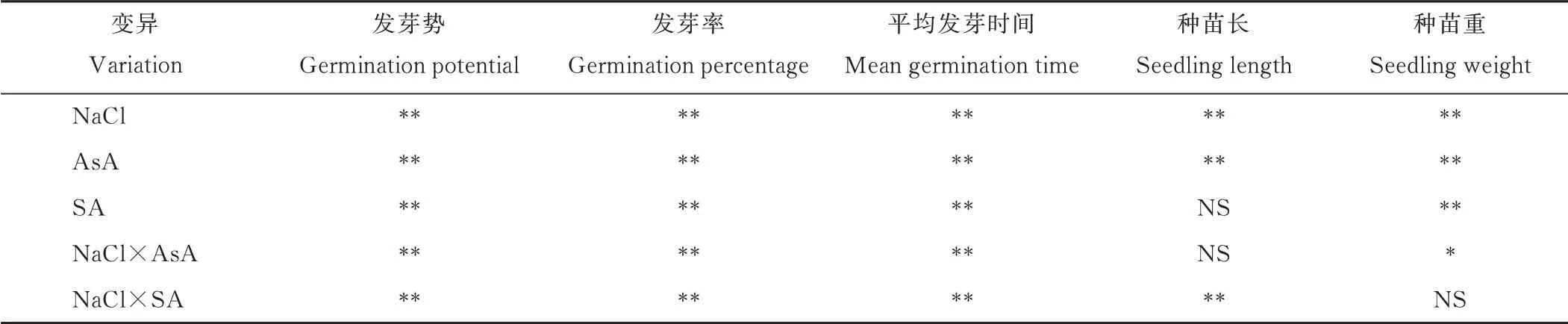
表3 NaCl和丸衣对紫花苜蓿种子发芽影响方差分析Table 3 Analysis of variance of NaCl and pelleting on germination characters in alfalfa seed
在紫花苜蓿SA丸衣种子出苗后,测定其种苗生长情况。在0 NaCl时,PAS5处理的种苗长小于其他处理,其他处理间差异不显著(P>0.05);丸衣不同程度地增加了种苗重量(表2)。在1.25%NaCl时,PAS5处理的种苗长显著(P<0.05)大于CK2,其他处理间无显著(P>0.05)差异。在1.50%NaCl时,除了PAS20以外,其他SA处理的丸衣种子的种苗长显著(P<0.05)大于CK1和CK2;PAS5处理的种苗重显著(P<0.05)大于PAS10和PAS20,其他处理间无显著(P>0.05)差异(表2)。
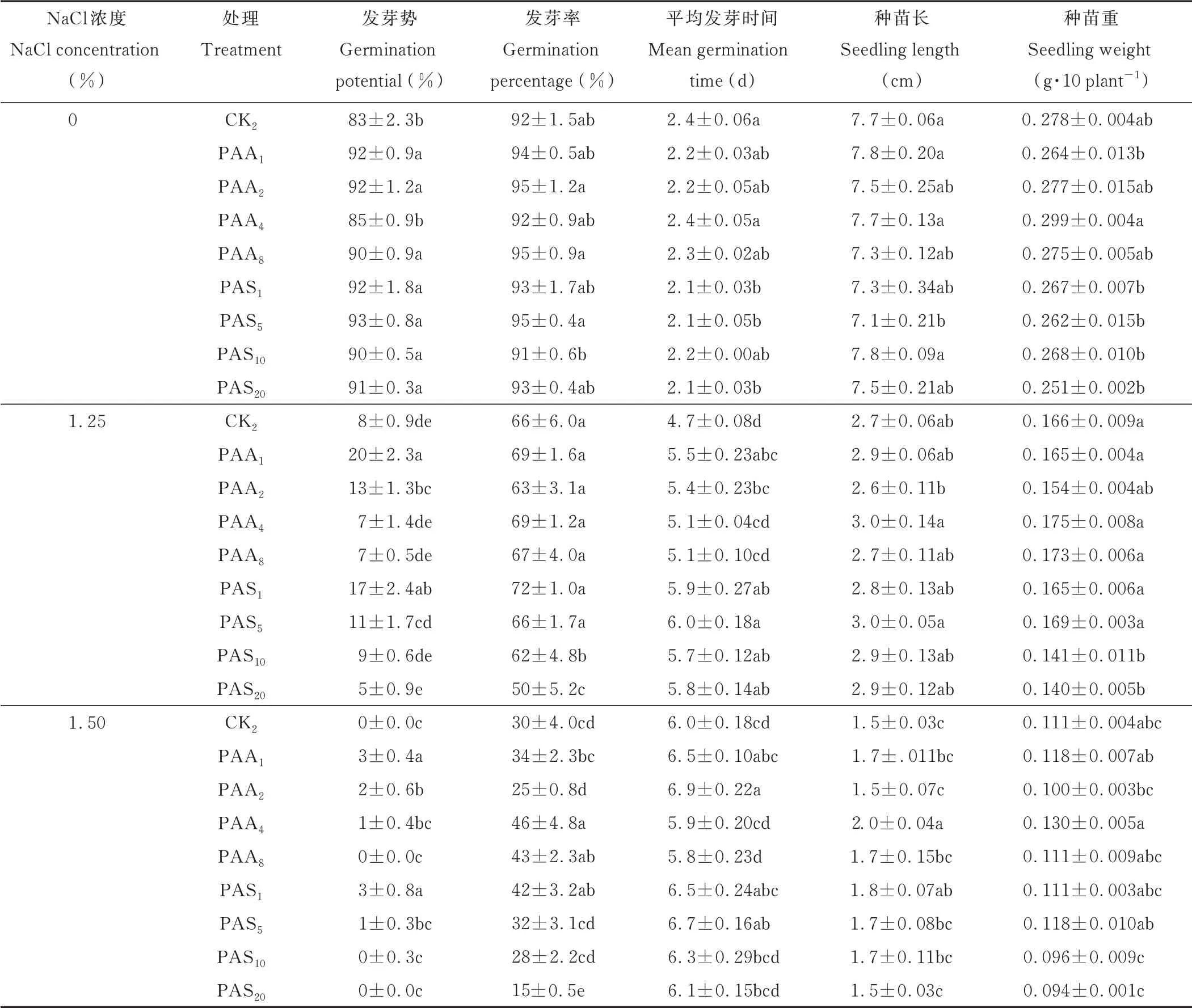
表2 不同含量AsA或SA对紫花苜蓿丸衣种子发芽的影响Table 2 Effects of differ ent contents of AsA or SA on ger mination in alfalfa pelleted seeds
综上,紫花苜蓿SA丸衣的最佳耐盐配方为PAS1(1 mmol·L-1SA)。
3 讨论
盐胁迫是一种常见的非生物胁迫,能够抑制植物种子的萌发,影响幼苗的生长发育。在高粱(Sorghum bicolor)[21]、黄瓜(Cucumissativus)[22]、小麦(Triticum aestivum)[23]、水稻(Oryza sativa)[24]等作物种子研究中发现,盐胁迫会不同程度的抑制植物种子的萌发。本试验结果也发现,随着NaCl浓度的增加,紫花苜蓿种子的发芽势、发芽率逐渐降低,当NaCl浓度达到1%时,发芽势和发芽率显著(P<0.05)下降,平均发芽时间显著(P<0.05)延长,苗长和鲜重也呈下降趋势。种子在萌发过程中受到盐胁迫时,会诱导活性氧的产生,同时会抑制抗氧化酶的活性,导致自由基无法被清除而大量累积,进而使细胞膜上的不饱和脂肪酸过氧化,损伤细胞膜结构,影响细胞膜功能,从而抑制种子的萌发[25]。
AsA是一种普遍存在于动植物组织中具有传递电子和质子能力的抗氧化剂,是许多物质代谢和氧化还原反应的重要参与者[14-15]。研究表明,用0.5 mmol·L-1AsA对青豆(Pisum sativum)种子进行浸种处理,可以提高种子活力和幼苗生长性能[26]。董秋丽等[27]采用NaCl溶液(浓度为0、50、100、200 mmol·L-1)、AsA溶液(浓度为0、0.5、1.0、1.5、2.0 mmol·L-1)处理燕麦种子,研究发现,NaCl胁迫降低了燕麦种子的活力水平,随AsA浓度的增加,燕麦种子的发芽率在100和200 mmol·L-1的NaCl胁迫下呈先升后降的趋势,1 mmol·L-1的AsA引发对NaCl胁迫的缓解效果最好,这说明AsA引发对NaCl胁迫的缓解作用与其浓度有关,适宜的浓度能有效缓解NaCl胁迫。并且用AsA浸种处理对不同浓度的NaCl胁迫缓解作用也不同[28],本试验的交互作用结果也说明了这一点,当NaCl浓度增加到1.25%和1.50%时,AsA丸衣可以不同程度地提高紫花苜蓿种子的耐盐性。其中,在NaCl浓度为1.5%时,配方PAA4处理的效果最好,显著(P<0.05)提高了在此盐胁迫浓度下种子的发芽率。这说明种子在萌发过程中受到一定程度盐胁迫伤害时,适宜浓度的AsA处理才会起到缓解作用,因此,不同的种子对NaCl胁迫的耐受性不同,相应地AsA处理的浓度也不完全相同。研究表明,NaCl胁迫会导致植物种子内活性氧的快速产生,而外源AsA可以促进酶促和非酶促抗氧化作用,有效清除盐胁迫产生的活性氧,从而提高植物种子耐盐性,促进萌发及幼苗生长[29],而盐胁迫的程度和外源AsA作用时机的关系和作用机理还有待进一步的研究。
SA是一种重要的信号分子,通过调节细胞抗氧化机制、诱导逆境相关蛋白的表达等来缓解外界胁迫对植物的影响[17]。在低温[30]、盐碱[31]、虫害[32]等逆境胁迫下,通过外源SA处理可以增强苜蓿抵抗逆境胁迫的能力。因此,利用SA对种子进行处理,研究盐胁迫下种子的萌发特性,对提高种子抗逆性和种子发芽能力具有重要意义。但SA处理的浓度与物种有关,马齿苋(Portulaca oleracea)种子在200 mmol·L-1的NaCl胁迫下,种子的发芽势和发芽率大大降低,1 mmol·L-1的SA处理可以提高种子各项发芽指标,对种子萌发有促进作用[33]。0.1~0.4mmol·L-1SA可以缓解盐胁迫对水飞蓟(Silybum marianum)种子造成的伤害,而当SA浓度大于0.6 mmol·L-1时,对种子萌发产生抑制作用[34]。另外,李防洲等[35]在研究棉花(Gossypium hirsutum)抗寒性时,发现1~10 mmol·L-1SA包衣能提高其抗寒能力,而过低或过高都没有很好的效果。本试验方差分析结果也表明(表3),NaCl和AsA浓度存在显著(P<0.05)的交互作用,低浓度的SA处理(PAS1)可以提高NaCl胁迫下种子的发芽率和种苗重,而高浓度的SA处理(PAS20)的发芽率和种苗重则是最低。通过比较说明,植物种子对于盐碱胁迫的耐受性不同,相应地SA处理的浓度也不完全相同,并且种子对SA的浓度较为敏感,适宜的SA浓度可以缓解盐溶液的胁迫,而过高则会产生抑制作用。研究表明,SA处理通过提高幼苗内超氧化物歧化酶、过氧化氢酶等细胞保护性酶的活性,从而提高蒲公英(Taraxacum mongolicum)[36]、三角叶滨藜(Atriplex triangularis)[37]对盐胁迫的抵抗能力。因此,低浓度SA处理可能未能激发种苗体内抵抗盐胁迫的保护酶活性,而过高浓度的SA则可能破坏了种苗内部的生理代谢过程,由此推测SA通过提高保护酶的活性来缓解盐胁迫的危害,而SA与保护酶响应盐胁迫的调控机制还有待进一步的研究说明。另外,SA对盐胁迫下种子萌发的影响也可能与种子本身所含的内源激素种类、分布及浓度不同有关。
4 结论
通过外源抗氧化剂AsA、植物激素SA拌种后进行紫花苜蓿种子丸衣处理,发现AsA和SA型丸衣可以提高紫花苜蓿种子的耐NaCl胁迫能力,筛选确定4 mmol·L-1AsA(PAA4)、1 mmol·L-1SA(PAS1)分别为最佳耐盐处理。

