干酪乳杆菌培养上清液对小鼠急性肝损伤的保护作用及机制研究
周颖 张谢 许丰 马燕燕 吴俊男 邵初晓
急慢性肝损伤的患者常常存在肠道菌群失调,表现为菌群多样性及双歧杆菌等益生菌数量明显减少,而肠球菌、肠杆菌及厌氧梭菌等致病菌的数量显著増多[1]。有研究显示,益生菌对肝损伤具有一定的保护作用,其中乳杆菌亚种如鼠李糖乳杆菌、植物乳杆菌对酒精性肝损伤具有保护作用[2]。干酪乳杆菌属于乳杆菌属,常和嗜酸乳杆菌、双歧杆菌并称为“健康三益菌”。研究表明干酪乳杆菌具有降低胆固醇、免疫调节等作用,还能改善乳糖不耐受、缓解过敏[3-4],但目前还鲜有干酪乳杆菌是否对急性肝损伤具有保护作用的报道。因此,本研究拟探究干酪乳杆菌培养上清液(lactobacillus casei-supernatants,LC-cs)对四氯化碳(carbon tetrachloride,CCl4)诱导的小鼠急性肝损伤的保护作用及相关机制,现将结果报道如下。
1 材料和方法
1.1 材料
1.1.1 实验动物 选取美国癌症研究所(Institute of Cancer Research,ICR)培育的雄性ICR小鼠24只,无特定病原体级,8周龄,体重20~25 g。由温州医科大学实验动物中心提供。饲养在12 h的光/暗循环条件下,维持25℃的饲养环境。
1.1.2 干酪乳杆菌培养 干酪乳杆菌购自广东省微生物研究所微生物菌种保藏中心。将干酪乳杆菌种子液接种于番茄汁培养基中,40~42℃培养16~20 h后置于2~6℃培养12~16 h。培养液离心,收集上清液并用膜过滤器分离过滤,得到细胞外代谢物,即LC-cs。
1.1.3 主要试剂和仪器 CCl4购自上海麦克林生物科技有限公司;ALT、AST试剂盒购自南京建城生物工程研究所;丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、总抗氧化能力(total antioxidant capacity,T-AOC)及脱氧核苷酸转移酶介导的缺口末端标记(terminal deoxynucleotidyl transferase mediated dUTP nick end labeling,TUNEL) 试剂盒购自上海碧云天生物技术有限公司;高迁移率族蛋白 B1(high mobility group box 1,HMGB1)、TNF-α 和IL-6酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒购自杭州联科生物技术股份有限公司;C/EBP同源蛋白(C/EBP homologous protein,CHOP)抗体购自美国CST公司;三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国Bioworld Technology公司;B淋巴细胞瘤-2基因(B cell lymphoma 2,Bcl-2)、Bcl-2相关 X 蛋白(Bcl-2 associated X protein,BAX)、葡萄糖调节蛋白 78(glucose-regulated protein 78,GRP78)、活化转录因子 6(activating transcription factor 6,ATF6)抗体购自英国Abcam公司;NF-E2相关因子(nuclear factor erythroid 2-related factor 2,Nrf2)抗体购自美国Proteintech公司;山羊抗鼠和山羊抗兔IgG-HRP二抗均购自杭州联科生物公司;Trizol RNA提取试剂盒购自上海生工生物工程股份有限公司;逆转录试剂盒及荧光定量q-PCR试剂盒均购自北京宝日医生技术有限公司。激光共聚焦显微镜(Ti-U型)购自日本Nikon公司;高速低温离心机(micro21R型)购自美国ThermoFisher公司;凝胶成像系统(chemidoc XRS+型)购自美国Bio-rad公司;荧光定量PCR(Light Cycler 480Ⅱ型)购自瑞士罗氏公司。
1.2 方法
1.2.1 动物分组与模型制备 将24只小鼠用随机数字表法分为CCl4组、LC-cs+CCl4组和对照组,每组8只。LC-cs+CCl4组小鼠用加有LC-cs的饮用水喂养2周,保证小鼠摄入LC-cs 1 ml/d,另两组用普通饮用水;2周后LC-cs+CCl4组和CCl4组腹腔注射用玉米油稀释为0.2%的CCl4 10 ml/kg以诱导急性肝损伤,对照组小鼠用玉米油(10 ml/kg)腹腔注射。所有操作均符合温州医科大学动物保护机构及实验动物伦理学规定。
1.2.2 小鼠急性肝损伤评估 腹腔注射24 h后对小鼠称重,采用水合氯醛麻醉,经眶静脉留取外周血,处死小鼠后留取肝脏组织并称重。计算各组小鼠的肝脏指数(肝脏指数=肝脏质量/小鼠体重)。外周血离心后取血浆,按照试剂盒说明书测定小鼠血浆ALT、AST和HMGB1水平。取小鼠肝脏组织约4 g,用4%甲醛溶液固定,石蜡包埋,5 μm切片后进行HE染色,显微镜下观察肝脏组织病理学改变。
1.2.3 小鼠肝脏组织炎症因子测定 采用ELISA法按照试剂盒说明书测定肝脏组织中IL-6和TNF-α的蛋白表达水平,RT-PCR法测定肝脏组织中IL-6和TNF-α mRNA表达水平。RT-PCR检测时先用Trizol一步法提取小鼠肝脏组织总RNA,再按试剂盒说明书进行逆转录。引物由上海生物工程股份有限公司合成,序列见表1。

表1 RT-PCR检测的引物序列
1.2.4 小鼠肝脏组织细胞凋亡检测 采用TUNEL试验检测肝脏组织凋亡细胞,根据TUNEL试剂盒说明书操作,在荧光显微镜下观察。采用Western blot法测定凋亡相关蛋白BAX、Bcl-2表达情况。具体步骤如下:二喹啉甲酸法测定肝脏组织总蛋白浓度,蛋白变性后行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转至聚偏氟乙烯膜上,3%胎牛血浆白蛋白封闭液,室温孵育1 h,加入一抗(1∶1 000),4 ℃封闭过夜,弃一抗,用缓冲液洗 3遍;加入二抗(1∶10 000),室温孵育 2 h后,弃二抗,缓冲液洗3遍,化学发光显色剂显色,曝光,测定蛋白表达量。
1.2.5 小鼠肝脏组织氧化应激指标测定 根据试剂盒说明书测定肝脏组织GSH-Px、T-AOC、SOD及MDA水平。用Western blot法测定肝脏组织Nrf2蛋白表达水平。
1.2.6 小鼠肝脏组织内质网应激相关蛋白测定 用Western blot法测定肝脏组织GRP78、ATF6和CHOP蛋白表达水平。
1.3 统计学处理 采用GraphPad 8.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠急性肝损伤评估 小鼠肝脏指数及血浆ALT、AST、HMGB1水平比较见表2。小鼠肝脏组织病理学改变见图1。
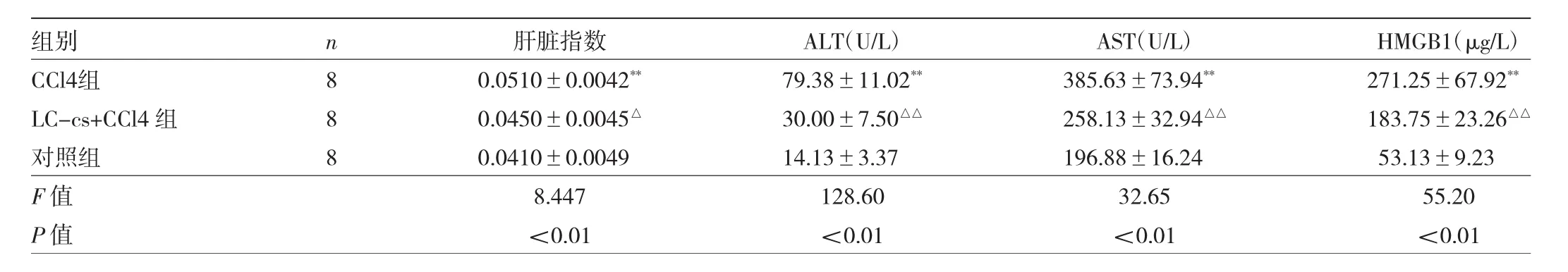
表2 小鼠肝脏指数及血浆ALT、AST、HMGB1水平比较
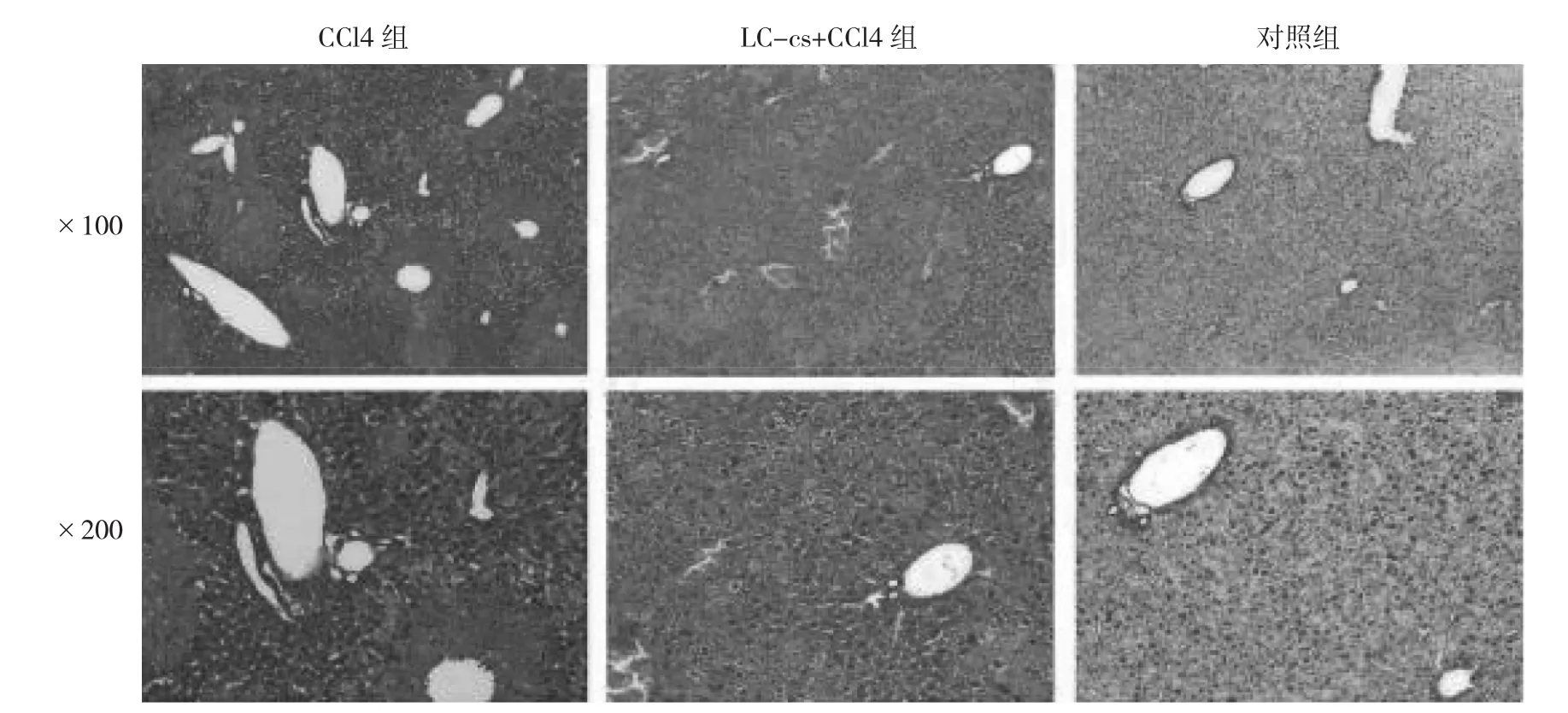
图1 小鼠肝脏组织病理学改变(HE染色)
由表2可见,3组间小鼠肝脏指数及血浆ALT、AST、HMGB1水平的差异均有统计学意义(均P<0.01)。CCl4组小鼠肝脏指数、血浆ALT、AST和HMGB1水平均高于对照组,LC-cs+CCl4组小鼠上述指标均低于CCl4组,差异均有统计学意义(均P<0.05)。
由图1可见,CCl4组的肝脏组织出现了脂肪变性、炎细胞浸润、小叶中心充血及坏死,LC-cs+CCl4组的肝损伤改变轻于CCl4组,而对照组小鼠肝脏组织病理学评估基本正常。
2.2 小鼠肝脏组织炎症因子测定 见表3。

表3 小鼠肝脏组织炎症因子测定
由表3可见,3组间小鼠肝脏组织IL-6和TNF-α蛋白及mRNA水平的差异均有统计学意义(均P<0.01)。CCl4组IL-6和TNF-α的蛋白及mRNA水平高于对照组,LC-cs+CCl4组IL-6和TNF-α蛋白及mRNA水平低于CCl4组,差异均有统计学意义(均P<0.05)。
2.3 小鼠肝脏组织细胞凋亡检测 TUNEL试验结果见图2。小鼠肝脏组织BAX和Bcl-2蛋白电泳图见图3,小鼠肝脏组织BAX和Bcl-2蛋白表达水平见表4。

图2 TUNEL试验结果

图3 小鼠肝脏组织BAX和Bcl-2蛋白电泳图

表4 小鼠肝脏组织BAX和Bcl-2蛋白表达水平
由图2可见,与对照组比较,CCl4组存在大量凋亡细胞,而LC-cs+CCl4组的凋亡细胞明显少于CCl4组。
由图3及表4可见,3组间小鼠肝脏组织BAX和Bcl-2蛋白表达水平的差异均有统计学意义(均P<0.01)。CCl4组BAX表达高于对照组,Bcl-2表达低于对照组,差异有统计学意义(均P<0.01);LC-cs+CCl4组BAX表达水平低于CCl4组,Bcl-2表达水平高于CCl4组,差异均有统计学意义(均P<0.05)。
2.4 小鼠肝脏组织氧化应激检测 小鼠肝脏组织GSH-Px、T-AOC、SOD和MDA水平见表5。小鼠肝脏组织Nrf2蛋白电泳图见图4。

图4 小鼠肝脏组织Nrf2蛋白电泳图
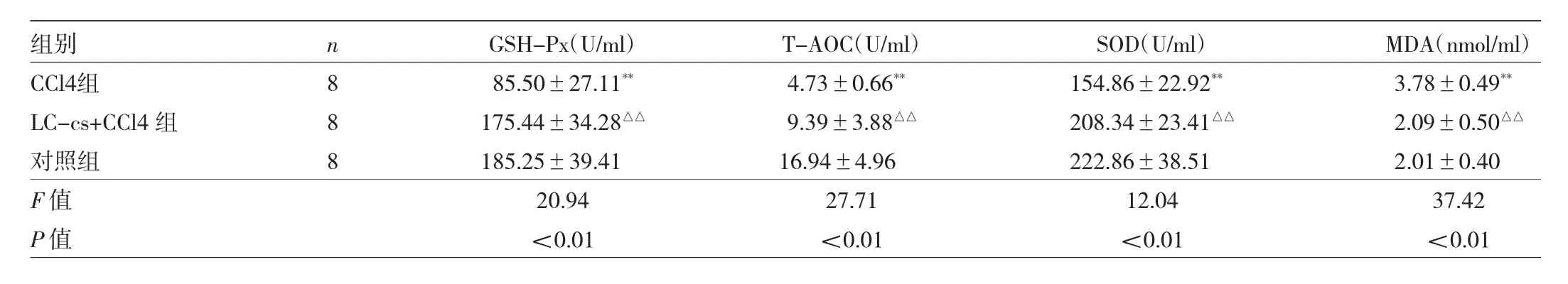
表5 小鼠肝脏组织GSH-Px、T-AOC、SOD和MDA水平
由表5可见,3组间小鼠肝脏组织GSH-Px、T-AOC、SOD和MDA水平的差异均有统计学意义(均P<0.01)。CCl4组GSH-Px、T-AOC和SOD水平低于对照组,MDA水平高于对照组,差异有统计学意义(均P<0.01)。LC-cs+CCl4组的GSH-Px、T-AOC和 SOD水平高于CCl4组,MDA水平低于CCl4组,差异有统计学意义(均 P<0.01)。
由图4可见,与对照组比较,CCl4组Nrf-2表达水平为 0.19±0.11,少于对照组的 0.35±0.14,LC-cs+CCl4组Nrf-2表达水平为1.06±0.23,高于CCl4组,差异均有统计学意义(均P<0.01)。3组小鼠Nrf2比较,差异均有统计学意义(F=36.99,P<0.01)。
2.5 小鼠肝脏组织内质网应激相关蛋白测定 小鼠肝脏组织GRP78、ATF6和CHOP蛋白电泳图见图5,小鼠肝脏组织GRP78、ATF6和CHOP蛋白表达水平见表6。

图5 小鼠肝脏组织GRP78、ATF6和CHOP蛋白电泳图
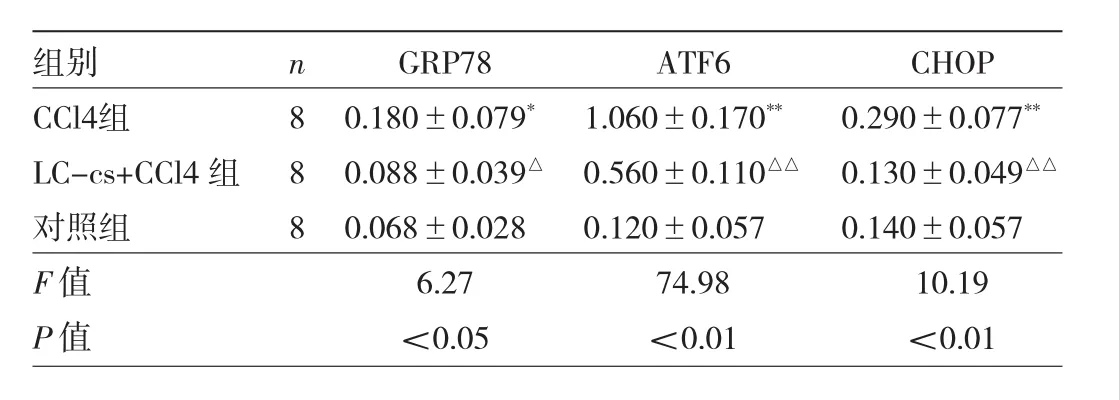
表6 小鼠肝脏组织GRP78、ATF6和CHOP蛋白表达水平
由图5及表6可见,3组间小鼠肝脏组织GRP78、ATF6和CHOP蛋白表达水平的差异均有统计学意义(均P<0.05)。CCl4组GRP78、ATF6和CHOP蛋白表达水平高于对照组,而LC-cs+CCl4组GRP78、ATF6和CHOP蛋白表达水平低于CCl4组,差异有统计学意义(均 P<0.05)。
3 讨论
肝脏是人体最重要的解毒器官,大部分药物和毒物进入人体后都需经肝脏代谢,导致肝损伤发生风险升高。急性肝损伤是临床上常见的肝损伤类型,主要病因包括药物、酒精和病毒感染等。其中药物诱发的急性肝损伤越来越常见,我国一项大规模的多中心回顾性研究发现,中国的药物性肝损伤年发病率高达23.80/10万[5]。CCl4是能够引起肝细胞坏死的毒性化合物,经肝脏细胞色素 P450代谢成三氯甲基自由基,由于CCl4在动物体内可部分重现人类肝脏损伤病程,是常用的动物肝损伤模型的造模剂[6]。近年来,有研究显示益生菌对急慢性肝病具有一定的治疗作用,但因其不稳定性和不良反应限制了其临床推广[7]。也有研究证实,益生菌的治疗作用可能得益于短链脂肪酸、胞外多糖等益生菌产生的生物活性代谢物[8]。因此本研究选用干酪乳杆菌的细胞外代谢物,即培养上清液作为干预药物,证实其对CCl4诱导的小鼠急性肝损伤具有保护作用。
HMGB1是一种细胞核内蛋白,也是一种炎症因子,各种原因所致的肝损伤可导致HMGB1释放,因此外周血HMGB1检测可联合肝功能指标与病理学检查共同评估肝损伤严重程度[9]。本研究结果显示LC-cs预处理后CCl4诱导的肝损伤减轻,表现为肝脏指数下降,组织病理学改变减轻,ALT、AST及HMGB1下降,说明LC-cs对CCl4诱导的急性肝损伤具有保护作用。
本研究进一步就LC-cs保护CCl4诱导的小鼠急性肝损伤的机制进行了探讨。既往研究显示炎症反应和细胞凋亡是急性肝损伤发生的主要机制之一[10-11]。IL-6和TNF-α是常用的肝脏炎症因子,TUNEL试验可显示组织中的凋亡细胞数量,联合促凋亡蛋白BAX和抗凋亡蛋白Bcl-2的测定可用于评估细胞凋亡情况。结果显示,LC-cs干预能显著降低IL-6和TNF-α水平,减少细胞凋亡,说明LC-cs通过抑制肝脏炎症因子表达和细胞凋亡来保护肝损伤。
CCl4诱导的肝损伤中氧化应激是主要机制之一[12]。因此,可以通过检测肝脏组织的GSH-Px、T-AOC、SOD和MDA的水平来评估肝脏氧化损伤[13]。本研究结果表明,LC-cs干预能显著提高肝脏组织GSH-Px、T-AOC和SOD水平,降低MDA含量。Nrf2抗氧化通路是体内重要的抗氧化系统之一,Nrf2在肝脏中高表达,当ROS攻击细胞时,受Nrf2调控的抗氧化酶基因表达转录激活[14]。该研究结果表明CCl4刺激降低肝脏Nrf2表达,而LC-cs干预可逆转该变化。以上结果表明LC-cs可通过减少氧化应激保护肝损伤。
有研究指出,抑制内质网应激可减少肝脏中的脂肪酸氧化[15]。因此,可通过检测内质网应激相关蛋白GRP78、ATF6和CHOP蛋白表达来评估内质网应激水平[16]。该研究结果显示,CCl4处理后上述蛋白水平显著升高,而LC-cs干预能使这些蛋白水平趋于正常,提示LC-cs可通过抑制肝细胞内质网应激来拮抗CCl4诱导的肝损伤。
综上所述,LC-cs对CCl4诱导的小鼠急性肝损伤具有保护作用,可能通过抑制炎症反应、细胞凋亡,减轻氧化应激及内质网应激等机制发挥作用。LC-cs中发挥保护作用的具体代谢物及作用机制有待进一步研究。

