海人酸致痫大鼠颞叶、海马区多药耐药基因1、P-糖蛋白的表达及相互关系
晏玉奎 胡建琴 王庄 张冰 钟婧 姜亦珍
目前,癫痫治疗的主要方法仍是药物治疗。据统计,高达30%的癫痫患者服用各种抗癫痫药物(antiepileptic drugs,AEDs)后癫痫仍持续发作,表现出多药耐药现象,进一步发展为难治性癫痫或耐药性癫痫(refractory epilepsy,RE)[1]。目前RE的机制尚不明确,有研究认为多药耐药现象与大脑毛细血管内皮上多药外排转运蛋白高表达有关,其作用是与细胞内脂溶性药物结合并将其泵出,使脑实质内药物水平降低,从而导致癫痫耐药。多药外排转运蛋白分为3种亚型:P-糖蛋白(P-glycoprotein,Pgp)、多药耐药相关蛋白、乳腺癌耐药蛋白,其中Pgp是一种跨膜蛋白,由人类多药耐药基因1(multidrug resistance gene1,MDR1)编码,与RE关系研究也较为深入[2]。有报道海人酸(kainic acid,KA)致慢性颞叶癫痫模型可对多种AEDs耐药,是研究人类RE的理想模型[3],因此,本研究探讨癫痫大鼠颞叶、海马区MDR1 mRNA、Pgp的表达及其相互关系,以期为开发新的治疗方法或药物提供依据,现将结果报道如下。
1 材料和方法
1.1 实验动物 选择健康清洁级雄性SD大鼠50只(购于上海斯莱克公司),体重200~220 g,饲养环境:温度18~24℃,湿度60%,日光照射时间12 h/d,自由摄入水分和食物。本研究经过医院动物伦理委员会审批通过(批准文号:20210709),操作严格按照《实验动物管理条例》的相关规定。
1.2 主要试剂和仪器 KA由美国Sigma公司提供,逆转录试剂盒、Real time PCR试剂盒均由日本TaKaRa公司提供,琼酯糖由美国Sigma公司提供;Trizol由美国Invitrogen公司提供,β-actin的引物和探针由上海皓嘉科技发展有限公司提供,Pgp鼠单克隆抗体C219由英国Abcam公司提供,即用型辣根过氧化物酶试剂盒以及非生物素广谱二抗均由上海长岛生物技术有限公司提供,脑立体定向仪由安徽淮北正华生物仪器设备有限公司提供,荧光定量PCR仪和Real time PCR专用96孔板膜由ABI公司提供。所需引物和探针由南京骥骜生物技术有限公司合成,β-actin:上游5'-GAAGATCAAGATCATTGCTCCT-3',下游 5'-TACTCCTGCTTGCTGATCCA-3',MDR1:上游 5'-CTCTCGCTGCTATCATCCACGGAACC-3',下游 5'-ACTGCTGTCGCTGACGGTCTGTGTA-3'。
1.3 方法
1.3.1 大鼠癫痫模型建立及行为学判定 采用10%水合氯醛(0.1 g/ml)按4 ml/kg腹腔注射麻醉,乙醇棉球局部消毒皮肤,剪除大鼠头皮毛发,沿正中线向后剪开头皮,用血管钳将头皮向两侧拉开并固定,分离皮下组织,充分暴露颅骨,参考《大鼠脑立体定位图谱》[4],选择海马区为穿刺点:X轴在前囟左侧方5.0 mm,Y轴在前囟后方5.0 mm,Z轴在硬膜下方5.0 mm。采用随机数字表法将大鼠分为观察组(30只)和对照组(20只),观察组将预先装有2 μl KA(含KA 1.0 μg)的微量注射器沿穿刺点进针,深度达5.0 mm,缓慢注入液体,注射时长0.5 h。对照组采用同样方法于穿刺点注射2 μl 0.9%氯化钠注射液。注射完毕后再次采用乙醇棉球局部消毒皮肤,全层缝合头皮,以碘伏消毒皮肤,最后腹腔注射0.5 ml青霉素预防感染。观察组大鼠癫痫发作行为学判定采用Racine标准(多次发作按最大发作程度计算),Ⅰ级:面部的肌肉抽搐;Ⅱ级:以点头运动为主的颈部肌肉抽搐;Ⅲ级:单侧前肢的阵挛、抽搐;Ⅳ级:双侧前肢阵挛、抽搐伴身体立起;Ⅴ级:双侧后肢强直,身体背曲强直,跌倒伴全身阵挛,分级达到Ⅲ~Ⅴ级发作为造模成功。观察组因麻醉意外死亡2只,余28只大鼠在注射KA后30~180 min内出现癫痫发作,反复发作持续1~3 h,其中6只因急性症状性癫痫持续状态而死亡,共成功建模22只。对照组20只均存活。两组大鼠继续饲养、观察1个月,以充分观察大鼠癫痫发作时间及频率,其中观察组平均每周观察到1~3次癫痫发作,对照组无癫痫发作。
1.3.2 颞叶、海马区组织Pgp表达水平检测 两组大鼠均采用10%水合氯醛按4 ml/kg腹腔注射麻醉、快速断头取脑,取出后立即用10%中性甲醛继续固定脑组织,采用梯度乙醇脱水,常规石蜡包埋,连续切片,脱蜡,用3% 过氧化氢处理5 min,加入稀释度1∶50鼠 Pgp单克隆抗体C219,4℃过夜,按二抗试剂盒推荐的方法进行免疫组化染色,辣根过氧化物酶显色5~10 min后水洗、分化、复染、脱水、透明、封片,采用光学显微镜采集系统分析颞叶、海马区组织病理切片,对每张病理切片选取3个不重复的阳性视野,计算每个视野的Pgp表达灰度值(反映Pgp的表达水平)。
1.3.3 颞叶、海马区组织MDR1 mRNA表达水平检测 颞叶、海马区组织总RNA提取:分别取大鼠颞叶、海马区组织30 mg,加 1 ml Trizol匀浆,加氯仿0.2 ml混匀、离心,使溶液分成3相,吸取上清液,加等体积异丙醇混匀、再次离心,弃上清液,加冰预冷的75%乙醇、离心,弃上清液,溶于20 μl 0.1%焦碳酸二乙酯(diethypyrocarbonate,DEPC)水。取上述RNA液 1 μl,加入 99 μl 0.1%DEPC 水,采用紫外分光光度仪确定RNA的纯度及RNA的水平,将OD值(A260/A280)维持在1.8~2.0。按照逆转录试剂盒提供的方法合成cDNA,体积为20 μl的反应体系包括MgCl24 μl,反转录 10×缓冲液 2 μl,dNTP 混合物 2 μl,总 RNA 1 μl,Oligo引物 1 μl,Taq 酶 1 U,无核酸酶水。反应条件为37℃ 15 min,85℃ 5 s,放置冰上5 min。采用实时荧光定量PCR法检测MDR1 mRNA表达:使用ABI 7300荧光PCR仪进行两步法扩增,预变性95℃ 10 s,PCR反应95℃ 5 s,60℃ 31 s,循环45次。体积为20 μl的反应体系包括 cDNA模板4 μl,上、下游引物各 1 μl,Premix Ex TaqTM10 μl,荧光探针溶液 1 μl,ROX 液 0.5 μl,无核酸酶水。MDR1 mRNA与β-actin同步扩增,自动得出循环阈值(cycle threshold,Ct)值,反应结束后,由软件自动得出荧光反应曲线以及每个标本反应体系的扩增效率及Ct值。采用2-ΔΔCt法计算待测样本中MDR1 mRNA拷贝数,反映MDR1 mRNA表达水平。
1.4 统计学处理 采用SPSS17.0统计软件。计量资料以表示,组间比较采用两独立样本t检验;MDR1 mRNA和Pgp表达水平的相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 两组大鼠颞叶、海马区Pgp表达灰度值比较 见表1。

表1 两组大鼠颞叶、海马区Pgp表达灰度值比较
由表1可见,观察组颞叶、海马区Pgp的表达灰度值高于对照组,差异均有统计学意义(均P<0.05)。两组大鼠颞叶、海马区典型病理切片见图1-4。
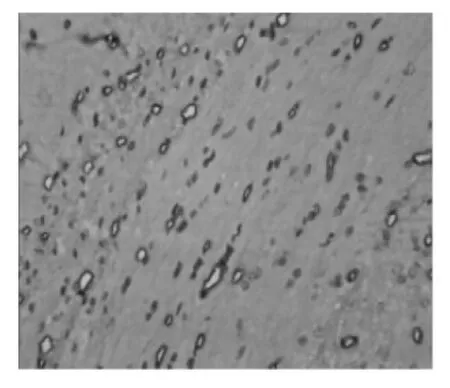
图1 观察组颞叶病理切片(免疫组化染色,×400)
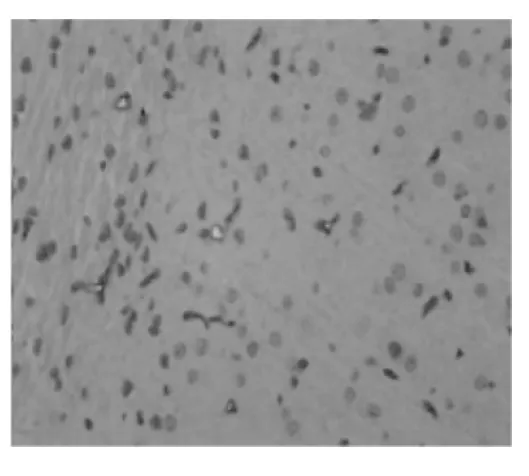
图2 对照组颞叶病理切片(免疫组化染色,×400)
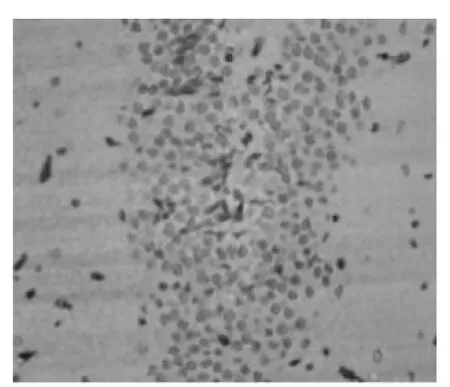
图3 观察组海马区病理切片(免疫组化染色,×400)
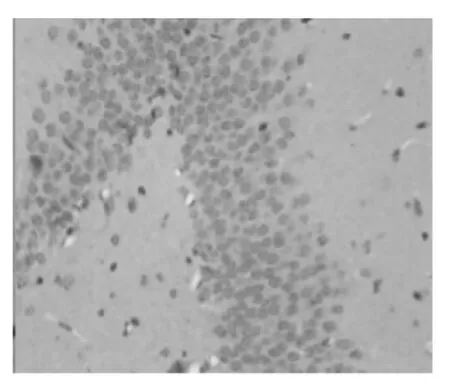
图4 对照组海马区病理切片(免疫组化染色,×400)
由图1-4可见,两组大鼠颞叶、海马区均可见着淡黄色或棕褐色的Pgp表达,以血管内皮部位多见。
2.2 两组大鼠颞叶、海马区MDR1 mRNA表达拷贝数比较 见表2。

表2 两组大鼠颞叶、海马区MDR1 mRNA表达拷贝数比较
由表2可见,观察组颞叶、海马区MDR1 mRNA表达拷贝数高于对照组,差异均有统计学意义(均P<0.05)。
2.3 观察组颞叶、海马区MDR1 mRNA表达水平与Pgp表达水平的相关性分析 见图5。
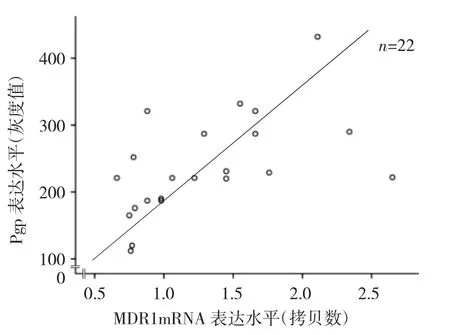
图5 观察组颞叶、海马区MDR1mRNA表达水平与Pgp表达水平散点图
由图5可见,观察组颞叶、海马区MDR1 mRNA表达水平与Pgp表达水平呈正相关(r=0.55,P<0.05)。
3 讨论
癫痫的耐药现象越来越受到关注,尽管新的药物不断问世,新的治疗手段如外科手术、生酮饮食等越来越多地应用于临床,但仍有20%~30%的患者癫痫发作难以控制。因此,探索AEDs耐药机制一直是研究者的方向。KA的化学结构和谷氨酸类似,可引起神经元兴奋性损伤导致癫痫发作。其诱发的癫痫模型,病灶主要累及颞叶、海马区,并且可出现反复自发性的癫痫发作,对苯妥英钠、卡马西平和丙戊酸钠等一线AEDs耐药,因此KA诱发的大鼠RE模型是研究人类RE的理想模型[3]。
近年来,多药外排转运蛋白在组织中的表达及耐药作用受到重视[5],在各种肿瘤组织中,发现有瘤细胞MDR1 mRNA、Pgp高表达,导致对化疗药物不敏感[6-7]。在癫痫耐药机制中,临床推测MDR1 mRNA、Pgp也存在高表达。本研究采用KA制作RE模型,探索MDR1 mRNA及其表达产物Pgp的关系,研究发现在颞叶、海马区均有Pgp的高表达,而且以毛细血管内皮细胞多见,同时MDR1 mRNA表达水平与Pgp表达水平呈正相关。Zhang等[8]用人 MDR1 mRNA转染的极化细胞系,进行AEDs双向转运试验和浓度平衡转运试验,也认为血脑屏障中高表达的Pgp可能是使癫痫耐药的一种新机制,而且这些AEDs转运效果被 Pgp抑制剂维拉帕米所阻断。也有研究发现大鼠离体脑组织的毛细血管暴露于谷氨酸盐后,其Pgp表达水平处于上调状态,进一步在癫痫动物模型体内观察到这种现象[9]。癫痫反复发作或慢性癫痫使血脑屏障遭到破环,毛细血管内皮细胞Pgp表达水平有增多趋势,这对RE也起到恶性循环作用[10]。
本研究发现,观察组大鼠癫痫发生1个月后颞叶、海马区组织仍较对照组MDR1 mRNA、Pgp表达水平高,也间接说明频繁发作与血脑屏障破环、基因表达异常有关联,今后可进一步观察不同癫痫发作频率以及发病时间对基因、蛋白表达的影响。Stasioek等[11]分析了外周血MDR1基因C3435T多态性与儿童RE发病率之间的关系,观察到RE的发病率与C等位基因有关,其可能会增加RE的发病风险。Sisodiya等[12]进一步分析了具有难治性病因(神经上皮肿瘤、局灶性皮质发育不良和海马硬化)的癫痫患者,发现手术切除标本有MDR1 mRNA的高表达,从而反映RE的耐药性。与普通癫痫患者比较,RE患者外周血MDR1 mRNA、Pgp表达水平显著升高,但经过第三代有效的AEDs艾司利卡西平治疗后,其外周血MDR1 mRNA、Pgp的表达水平显著降低,也提示RE患者的耐药性可能与MDR1 mRNA、Pgp的高表达有关[13]。
大鼠颞叶、海马区组织MDR1 mRNA、Pgp的高表达现象被证实,原因可能是多方面的,主要包括脑组织缺血缺氧、氧化应急反应等。MDR1 mRNA、Pgp的表达受多种信号通路调控,包括TNF-α/蛋白激酶C-β/鞘氨醇-1-磷酸受体1、血管内皮生长因子/Src激酶等[14-15]。Pgp抑制剂可增强脑组织中AEDs的浓度和提高疗效,但由于该类药物存在不良反应和缺乏组织特异性,临床使用存在一定的局限与困难。需进一步探讨有效调节Pgp内源性分子表达的方法,以改进治疗RE的策略。为了研究RE患者治疗的新方法,未来可在癫痫患者中使用生物标记 AEDs的方法进行体内成像研究,帮助发现相关新的研究方法[16]。

