6-姜酮酚抑制肝内胆管癌细胞的增殖、迁移、侵袭作用及其机制探讨
陈泽昊, 朱文杰, 申兵兵, 江建新
武汉大学人民医院 肝胆外科, 武汉 430061
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)来源于胆管上皮细胞,是第二常见的原发性肝脏恶性肿瘤[1],近年来ICC的发病率和死亡率不断上升,尤其是在亚洲国家[2]。全球范围内ICC常见的危险因素包括慢性乙型或丙型肝炎、饮酒、炎症性肠病以及胆汁淤积[3]。尽管外科手术、放化疗等治疗方法已得到较好的发展,但由于ICC的起病隐匿及化疗耐药性,患者的长期生存率仍不十分理想[1],因此寻找新型有效的药物对ICC的治疗具有重要的意义。
6-姜酮酚(6-Paradol)是一种从生姜中分离出来的具有生物活性的酚类化合物,它具有抗氧化、抗炎、调节血糖血脂和神经保护等多种生物活性[4]。Surh等[5]发现6-Paradol具有抗肿瘤、抑制肿瘤启动子刺激产生的炎症、抑制TNFα的产生和表皮鸟氨酸脱羧酶激活的作用。另一项研究[6]表明,6-Paradol对DMBA诱导的仓鼠颊囊肿瘤的形成有明显的抑制作用。然而,6-Paradol对ICC的作用目前尚未阐明,有待进一步深入探讨。
STAT3是转录信号转导子与激活子家族的成员之一,可调节细胞增殖、分化、凋亡、迁移侵袭、血管生成、炎症和免疫反应,它激活后转位入核内并与靶基因DNA相结合,调控靶基因Bcl-2及p21等的转录[7];自1993年发现p21是细胞周期蛋白依赖性激酶(CDK)的强效抑制剂以来[8],它就被认为是一种重要的调节剂。p21涉及多种细胞功能,包括调控G1/S细胞周期进程、DNA损伤、细胞凋亡及细胞迁移侵袭。因此,药物通过靶向STAT3-p21通路可能是有效的治疗方式。
1 材料与方法
1.1 细胞、试剂及仪器 人ICC细胞系HCCC 9810和HUCCT1(美国ATCC公司),RPMI 1640培养液(美国Gibco公司),6-Paradol(MCE公司),CCK-8试剂、SDS-PAGE凝胶配制试剂盒、Transwell小室(武汉博士德生物有限公司),Lipofectamine2000Reagent/Lipofectamine3000Reagent、Optim-MEM(Invitrogen公司),mRNA上下游引物(生工生物公司),兔抗人STAT3、p-STAT3、p21、SRC、p-mTOR、GAPDH单克隆抗体(武汉三鹰公司),mRNA逆转录试剂盒、qRT-PCR试剂盒(南京诺维赞生物科技公司),蛋白成像系统(Bio-Rad公司)。
1.2 CCK-8法检测6-Paradol作用后的细胞增殖活性 将细胞接种于96孔板中,每组设置6个复孔,分别用浓度为20、40、60、80、100 μmol/L的6-Paradol处理细胞,对照组予以含有DMSO(体积分数0.25%)的RPMI 1640培养液。置于培养箱中48 h、72 h后测吸光度。相对增殖率(%)=(1-药物组OD450 nm值/对照组OD450 nm值)×100%。
1.3 克隆形成实验检测6-Paradol作用后的细胞克隆形成能力 将细胞接种于6孔板中待细胞贴壁后以等体积DMSO(对照组)、不同浓度的6-Paradol(10、20和40 μmol/L)处理细胞。14 d后计数各组的克隆形成数。
1.4 划痕愈合实验检测6-Paradol作用后的细胞迁移能力 将细胞接种于6孔板中,待细胞融合度达90%时进行划痕并拍照观察0 h划痕情况是否一致,然后加入等体积DMSO(对照组)、不同浓度6-Paradol(10、20和40 μmol/L)。24 h后测量划痕面积并计算相对迁移率。相对迁移率(%)=各组24 h划痕面积/对照组24 h划痕面积×100%。
1.5 Transwell小室法检测6-Paradol作用后的细胞迁移侵袭能力 将细胞接种于Transwell上室中,待细胞贴壁后分别加入等体积DMSO(体积分数为0.25%,作为对照组)和不同浓度6-Paradol(10、20和40 μmol/L)。培养48 h后固定染色,随机选取5个视野(100倍)拍照,image J计数侵袭细胞数。
1.6 生物信息学软件预测6-Paradol作用蛋白靶点 在线数据库Swiss Target Prediction(http://www.swiss targetprediction.ch/)是一个预测化合物作用蛋白靶点的网站,可以通过导入化合物的结构文件预测化合物作用的蛋白靶点。本研究从化合物数据库PubChem Compound Search database(https://www.ncbi.nlm.nih.gov/pccompound)中下载6-Paradol的二维结构文件,把文件导入到Swiss Target Prediction中后获得6-Paradol作用的蛋白靶点。应用在线公共数据库STRING(https://string-db.org/cgi/input.pl)构建蛋白靶点互作网络,并用Cytoscape软件进行可视化及分析。
1.7 Western blot检测细胞中STAT3、p-STAT3、p21、Bcl-2、SRC、p-MTOR的表达 以不同浓度的6-Paradol(0、10、20和40 μmol/L)处理细胞48 h后提取蛋白,定量后加入到分离胶中电泳2 h以分离蛋白,然后转膜至PVDF膜;常温下封闭2 h后分别加入兔抗人SRC、STAT3、p-STAT3、p21、Bcl-2、p-MTOR和GAPDH单克隆抗体,4 ℃过夜。TBST洗涤后加入二抗,室温孵育2 h。曝光并检测各蛋白条带的灰度值。
1.8 药物亲和反应的靶点稳定性(DARTS)检测6-Paradol与蛋白靶点的相互作用 细胞提取蛋白,加入M-PER缓冲液稀释至蛋白浓度为1.5 mg/mL,然后分别加入等体积的DMSO及40 μmol/L 6-Paradol,冰上孵育1 h。孵育结束后向各组混合液中加入链霉菌蛋白酶PBS溶液(链霉菌蛋白酶浓度为5 mg/mL,酶与蛋白质量比为1∶50),40 ℃下酶解15 min。酶解结束后立即加入50 μL蛋白上样缓冲液终止酶解反应。
1.9 qRT-PCR 转染细胞48 h后提取总RNA并测定浓度后逆转录得到cDNA,以GAPDH为内参,采用qRT-PCR测量相关基因的表达,使用2-ΔΔCt法计算相关基因的表达量。实验中涉及的主要引物序列如下。STAT3:F-5′-CGGCGGAAACTCTACTTGTCCTT-3′, R-5′-ATCCAGTGCAGGGTCCGAGG-3′;p21: F-5′- TGTCCGTCAGAACCCATGC-3′,R-5′- AAAGTCGAAGTTCCATCGCTC-3′;GAPDH: F-5′-TGTTCGTCATGGGTGTGAAC-3′, R-5′-ATGGCATGGACTGTGGTCAT-3′。
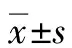
2 结果
2.1 6-Paradol对HCCC 9810和HUCCT1细胞增殖的影响 CCK-8检测结果显示,DMSO(对照组)和20、40、60、80、100 μmol/L 6-Paradol作用48 h及72 h后胆管癌细胞的增殖率依次下降(P值均<0.001)(图1 a、b);应用GraphPad软件计算得出48 h时6-Paradol对HCCC 9810细胞的IC50值为85.69 μmol/L;72 h时的IC50值为65.39 μmol/L; 48 h时6-Paradol对HUCCT1细胞的IC50值为122.30 μmol/L;72 h时的IC50值为84.33 μmol/L。克隆形成实验检测结果(图1c)显示,DMSO(对照组)和10、20、40 μmol/L 6-Paradol组中细胞克隆形成数依次递减(P值均<0.05)。以上结果提示,6-Paradol对HCCC 9810和HUCCT1细胞的增殖具有抑制作用并呈现时间和浓度依赖性。
2.2 6-Paradol对HCCC 9810和HUCCT1细胞迁移侵袭的影响 划痕愈合实验结果(图2a、c)显示,DMSO(对照组)和10、20、40 μmol/L 6-Paradol处理24 h后HCCC 9810细胞(t值分别为4.31、5.02、3.03,P值均<0.05)及HUCCT1细胞(t值分别为3.86、3.59、4.96,P值均<0.05)的相对迁移率依次递减。Transwell实验在检测迁移能力时结果显示(图2b),DMSO和10、20、40 μmol/L 6-Paradol处理组每个视野下迁移过膜的HCCC 9810(t值分别为4.10、2.88、6.30,P值均<0.05)和HUCCT1(t值分别为2.99、5.85、6.58,P值均<0.05)细胞数依次递减;Transwell实验在检测侵袭能力时结果显示(图2d),DMSO和10、20、40 μmol/L 6-Paradol处理组每个视野下侵袭过膜的HCCC 9810(t值分别为13.35、3.68、2.85,P值均<0.05)和HUCCT1(t值分别为4.30、11.21、25.09,P值均<0.05)细胞数依次递减。这些结果表明6-Paradol可显著抑制胆管癌细胞的迁移侵袭能力并呈现浓度依赖性。
2.3 6-Paradol作用的蛋白靶点预测及互作网络构建 从PubChem Compound Search database中获得6-Paradol的二维结构(图3a),使用Swiss Target Prediction预测了6-Paradol作用的蛋白靶点,在线公共数据库STRING构建蛋白靶点互作网络并用Cytoscape软件进行可视化,结果显示Degree得分最高的5个蛋白靶点为SRC、STAT3、HSP90AA1、ESR1、mTOR(图3b)。
2.4 6-Paradol对HCCC 9810和HUCCT1细胞中STAT3、p-STAT3、SRC、p-mTOR、Bcl-2、p21和p53蛋白表达的影响 基于已有的文献研究,选择了STAT3、SRC和mTOR作为6-Paradol可能的作用靶点进行下一步研究。 DMSO(对照组)和10、20、40μmol/L6-Paradol处理48 h后HCCC 9810细胞(t值分别为3.27、3.06、4.68,P值均<0.05)及HUCCT1细胞(t值分别为2.99、3.52、6.44,P值均<0.05)中STAT3的相对表达量均随着药物浓度的增加逐渐减少(图4a、b);同样地,DMSO(对照组)和10、20、40 μmol/L 6-Paradol处理48 h后HCCC 9810细胞(t值分别为2.99、3.52、6.44,P值均<0.05)及HUCCT1细胞(t值分别为3.90、11.40、7.72,P值均<0.05)中p-STAT3的相对表达量均随着药物浓度的增加逐渐减少(图4c、d);而SRC和p-mTOR蛋白的相对表达量差异均无统计学意义(P值均>0.05)。因此推测6-Paradol对HCCC 9810和HUCCT1细胞增殖及迁移侵袭的抑制作用是通过靶向STAT3实现的。进一步对STAT3下游可能的6-Paradol作用位点进行了研究,结果发现p21在HCCC 9810(t值分别为3.79、13.82、3.18,P值均<0.05)和HUCCT1细胞(t值分别为10.10、11.71、5.93,P值均<0.05)中的相对表达量随着药物浓度的增加明显增加,而Bcl-2的蛋白表达量无明显差异(P值均>0.05)(图4e、f)。通过查阅文献发现p21对肿瘤演变的影响在很大程度上还取决于p53蛋白在癌细胞中的状态,于是对细胞中p53的表达量进行检测,发现p53均呈现稳定表达的状态(图4e、f)。上述结果表明,6-Paradol可能通过作用于STAT3-p21通路来发挥对人HCCC 9810和HUCCT1细胞增殖及迁移侵袭的抑制作用。
注:a、b,CCK-8实验;c,平板克隆实验。*P<0.05, **P<0.01, ***P<0.001。

注:a、c,划痕愈合实验;b、d,Transwell小室实验(×100)。图2 不同浓度6-Paradol对人HCCC 9810和HUCCT1细胞迁移、侵袭能力的影响
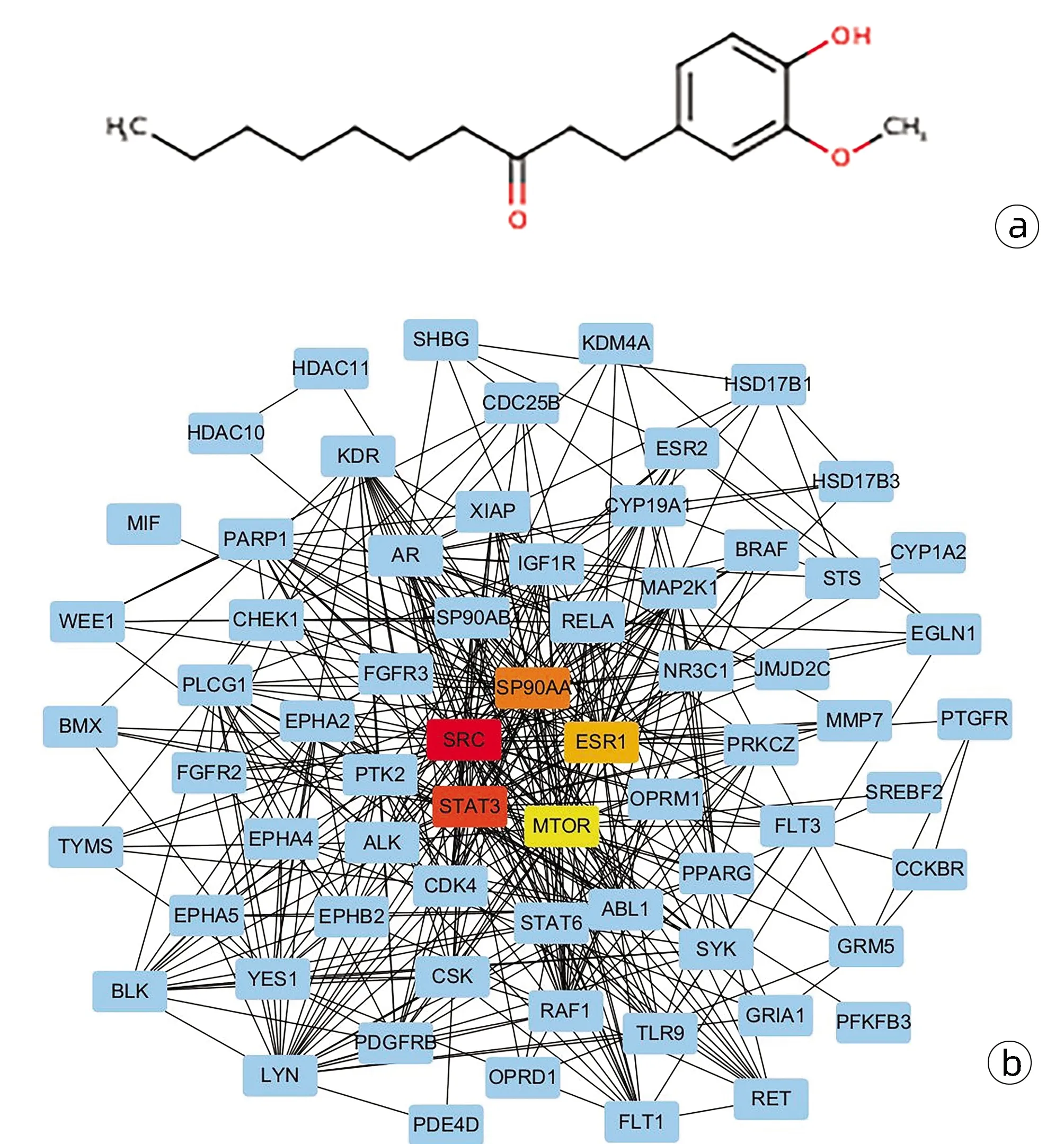
注:a,6-Paradol的结构;b,6-Paradol作用的蛋白靶点预测及互作网络构建。图3 6-Paradol的结构及其作用的蛋白靶点预测及互作网络构建
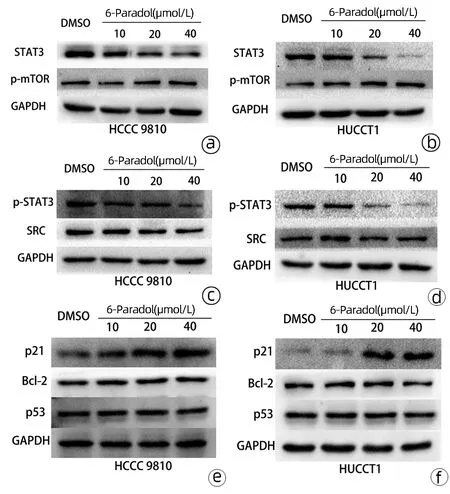
注:a,6-Paradol处理后HCCC 9810细胞中STAT3、p-mTOR蛋白表达量;b, 6-Paradol处理后HUCCT1细胞中STAT3、p-mTOR蛋白表达量;c,6-Paradol处理后HCCC 9810细胞中p-STAT3、SRC蛋白表达量;d, 6-Paradol处理后HUCCT1细胞中p-STAT3、SRC蛋白表达量;e, 6-Paradol处理后HCCC 9810细胞中p21、Bcl-2、p53蛋白表达量; f, 6-Paradol处理后HUCCT1细胞中p21、Bcl-2、p53蛋白表达量。
2.5 DARTS研究6-Paradol与STAT3间的相互作用 对6-Paradol 和STAT3的相互作用进行DARTS研究,结果显示(图5),与对照组相比,6-Paradol及链霉菌蛋白酶处理组的HCCC 9810和HUCCT1细胞中STAT3被蛋白酶水解的比例分别减少了48.66%、45.33%(t值分别为16.64、8.76,P值均<0.05),表明STAT3可以与6-Paradol结合从而在一定程度上使其免于被蛋白酶水解。
2.6 通过质粒在胆管癌细胞中过表达STAT3以及敲低p21的表达 为了进一步论证6-Paradol通过STAT3-p21通路对HCCC 9810和HUCCT1细胞的增殖、迁移侵袭发挥抑制作用,运用质粒分别过表达了STAT3以及敲低了p21的表达,qRT-PCR结果提示,转染过表达STAT3质粒后,与对照组相比,HCCC 9810和HUCCT1细胞中STAT3的表达量显著提升(t值分别为2.82、5.60,P值均<0.05)(图6a);转染sh-p21质粒后,与对照组相比,HCCC 9810和HUCCT1细胞中p21的表达量显著降低(t值分别为6.84、3.91,P值均<0.05)(图6b)。
2.7 6-Paradol通过STAT3-p21通路对HCCC 9810和HUCCT1细胞的增殖及迁移侵袭的抑制作用 CCK-8实验结果显示(图7a、b),与单独加药组相比,过表达STAT3或沉默p21均可部分逆转6-Paradol对细胞增殖的抑制作用(P值均<0.05);划痕实验结果表明(图7c、d),在过表达STAT3的HCCC 9810及HUCCT1细胞中,与单独给药组(6-Paradol:40 μmol/L)相比,划痕愈合率分别提升了67.83%、53.15%(t值分别为4.51、5.54,P值均<0.05);在沉默p21表达的HCCC 9810及HUCCT1细胞中,与单独给药组相比,划痕愈合率分别提升了61.80%、108.3%(t值分别为5.41、6.09,P值均<0.05);Transwell实验结果表明(图7e、f),在过表达STAT3的HCCC 9810及HUCCT1细胞中,与单独给药组(6-Paradol:40 μmol/L)相比,细胞迁移过膜细胞数分别提升了56.15%、88.20%(t值分别为4.28、18.81,P值均<0.05);在沉默p21表达的HCCC 9810及HUCCT1细胞中, 与单独给药组相比, 细胞迁移过膜细胞数分别提升了30.17%、15.40%(t值分别为2.80、2.90,P值均<0.05);在过表达STAT3的HCCC 9810及HUCCT1细胞中,与单独给药组(6-Paradol:40 μmol/L)相比,细胞侵袭过膜细胞数分别提升了82.82%、62.38%(t值分别为10.56、10.05,P值均<0.05);在沉默p21表达的HCCC 9810及HUCCT1细胞中,与单独给药组相比,细胞侵袭过膜细胞数分别提升了16.80%、20.53%(t值分别为2.82、3.79,P值均<0.05)。以上结果证实,6-Paradol通过靶向作用于STAT3-p21通路对HCCC 9810和HUCCT1细胞的增殖以及迁移侵袭发挥抑制作用。
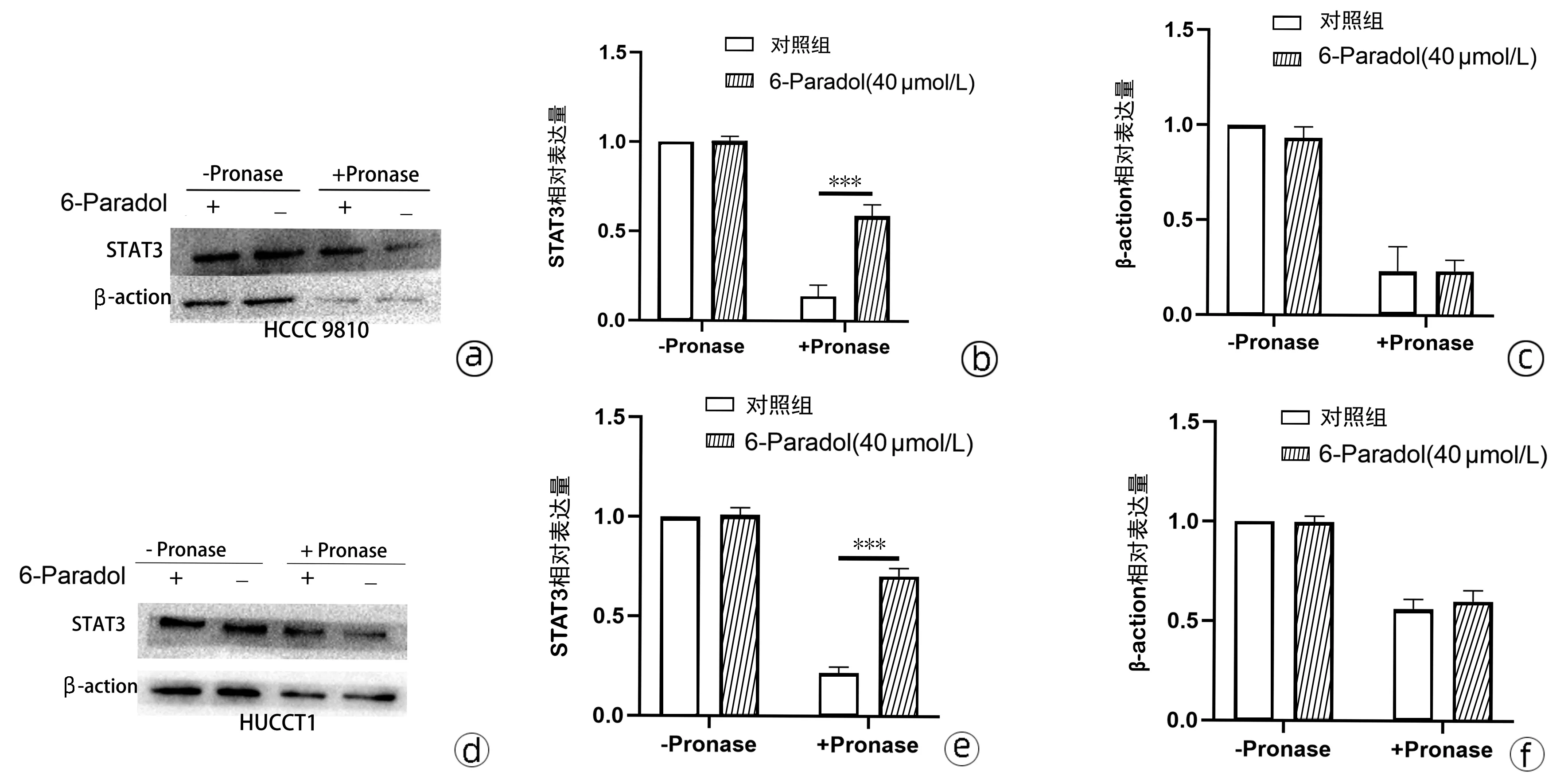
注:a、b、c, DARTS探究HCCC 9810细胞中6-Paradol与STAT3的相互作用;d、e、f,DARTS探究HUCCT1细胞中6-Paradol与STAT3 的相互作用。***P<0.001。图5 DARTS探究6-Paradol与STAT3的相互作用Figure 5 DARTS was used to explore the interaction between 6-Paradol and STAT3
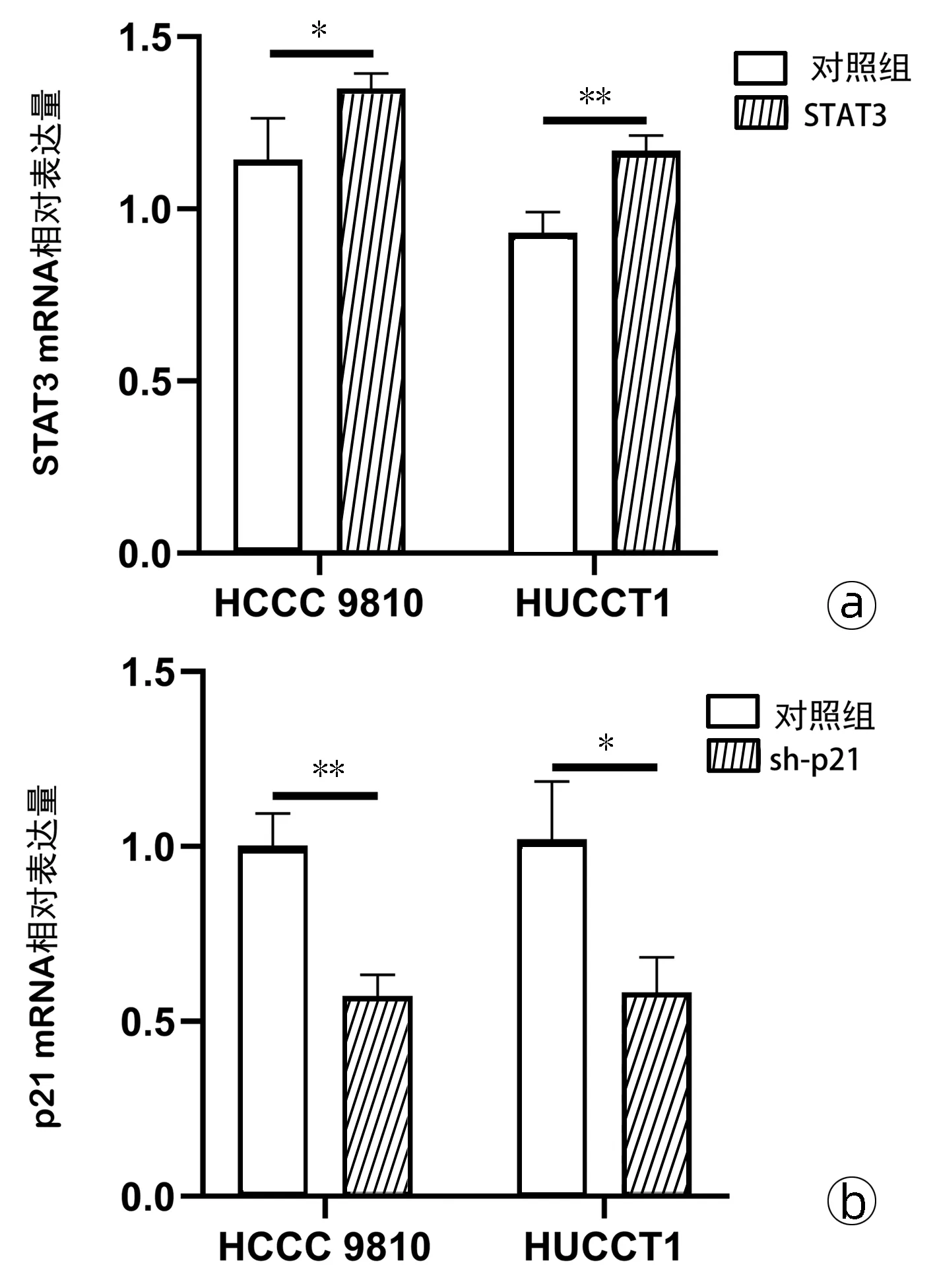
注:*P<0.05, **P<0.01。图6 qRT-PCR验证STAT3过表达质粒及sh-p21质粒的转染效率
3 讨论
ICC治疗方式有限且预后较差,大多数病例诊断时已是晚期,并且只有约三分之一的患者适合手术切除[2],因此寻找新型的药物协助ICC的治疗是目前亟待解决的问题。
6-Paradol是一种天然酚类化合物,一些体内、体外研究均发现其具有显著的抗肿瘤作用[9]。Li等[10]证实6-Paradol通过调控MAPK信号通路抑制肝癌细胞增殖和迁移并诱导细胞发生凋亡和G0/G1期细胞阻滞;也有研究[9]表明6-Paradol可显著降低DMBA诱导的小鼠皮肤肿瘤的发生率。本研究发现,在CCK-8实验中,6-Paradol对人HCCC 9810和HUCCT1细胞有明显的细胞毒性作用,并呈现时间和浓度依赖性;通过平板克隆实验发现6-Paradol对ICC细胞的克隆形成能力有明显的抑制作用;在划痕实验及Transwell实验中观察到6-Paradol对ICC细胞的迁移侵袭也有明显的抑制作用。以上结果均提示6-Paradol对HCCC 9810和HUCCT1细胞具有显著的抗肿瘤作用。
STAT3对于转导癌细胞中的受体和/或非受体酪氨酸激酶活化的信号以及调节众多促进肿瘤进展的基因表达的转录因子是不可或缺的[11]。STAT3的信号级联反应通过上游激酶的信号所触发,并经历磷酸化、同型二聚化、转位到细胞核并与DNA结合,从而影响肿瘤细胞增殖、侵袭转移、血管生成及免疫编辑等过程中的目的基因表达[7]。STAT3的过度活化已被报道存在于多种类型的肿瘤中,比如肝[12]、胰腺[13]、卵巢癌[14]等,并且在这些
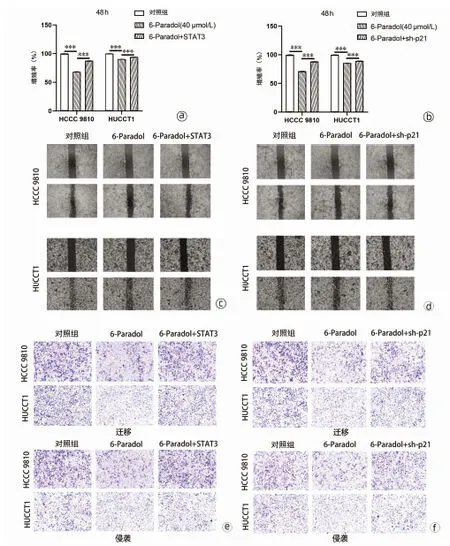
注:a、b,CCK-8实验检验细胞增殖能力;c、d,划痕实验;e、f,Transwell小室实验(×100);***P<0.001。图7 6-Paradol对HCCC 9810和HUCCT1细胞增殖及迁移、侵袭的抑制作用Figure 7 Inhibitory effect of 6-Paradol on the proliferation, migration and invasion of HCCC 9810 and HUCCT1 cells
肿瘤中,活化的STAT3表达水平与不良预后呈正相关。鉴于STAT3的异常激活为参与肿瘤细胞增殖、血管生成、迁移和侵袭的肿瘤转移提供了有利条件以及STAT3信号传导是肿瘤微环境中免疫逃逸的诱因,因此靶向STAT3可抑制肿瘤进展并改善抗肿瘤免疫反应。本实验中,Western blot检测结果显示,与对照组相比,6-Paradol处理组细胞中STAT3蛋白的相对表达量明显减少且药物处理组中人胆管癌细胞的增殖、克隆形成、迁移侵袭能力均弱于对照组,提示6-Paradol可能通过靶向STAT3发挥了肿瘤抑制作用,笔者进一步对STAT3过表达的胆管癌细胞进行了药物处理(6-Paradol:40 μmol/L),结果通过功能实验发现胆管癌细胞的增殖及迁移侵袭能力得到了部分恢复,从而论证了6-Paradol可能通过靶向STAT3发挥其肿瘤抑制作用。
p21由CDKN1A基因编码,是CDK2的主要抑制剂,因此也被称为CDKN1A或CDK相互作用蛋白1[15],除了在细胞周期调节中的作用外,p21还参与了细胞分化、迁移侵袭、细胞骨架动力学、细胞凋亡、转录、DNA 修复等功能[16]。既往研究[17]表明,p53的状态是p21特性和活性的主要决定因素,即p21在p53富集的环境中起抑癌作用,而在p53缺乏的环境中则促进肿瘤发生。本研究结果显示,随着6-Paradol浓度的逐渐递增,胆管癌HCCC 9810和HUCCT1细胞中p21的表达量呈现递增的趋势,且p53呈现稳定表达的状态,表明6-Paradol可能通过调节p21发挥其肿瘤抑制作用。通过沉默p21后行CCK-8、划痕愈合及Transwell实验,进一步论证了此猜想。
在本研究中,首先发现6-Paradol对HCCC 9810和HUCCT1细胞的增殖、迁移及侵袭具有明显的抑制作用,并且6-Paradol对胆管癌细胞的毒性作用呈现时间和浓度依赖性。然后通过生物信息学分析筛选出6-Paradol最有可能的蛋白作用靶点后,采用Western blot进行验证发现,随着6-Paradol浓度的逐渐递增,胆管癌细胞中STAT3及p-STAT3的表达量呈现明显的递减趋势,表明6-Paradol可抑制胆管癌细胞中STAT3及p-STAT3的表达。然后对JAK-STAT信号通路下游可能的作用位点进行分析,结果发现p21蛋白的表达呈现递增的趋势,而其他下游位点均无明显的变化趋势。然后通过CCK-8、划痕愈合及Transwell实验论证了上述猜想。据以上结果可推断,6-Paradol通过靶向作用于STAT3-p21通路介导对HCCC 9810和HUCCT1细胞增殖、迁移、侵袭的抑制作用。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:陈泽昊对于研究的思路或设计有关键贡献;陈泽昊、朱文杰参与了研究数据的获取及分析解释;陈泽昊、申兵兵参与起草或修改文章关键内容;江建新参与文章的审阅及批改。

