持续高温胁迫对克氏原螯虾生长、消化酶活性与免疫指标的影响
何乃娟 阮国良 刘玉林 方 刘 王 乾 付运银 李生瑄 李青松
(长江大学动物科学学院, 湿地生态与农业利用教育部工程研究中心, 荆州 434025)
克氏原螯虾(Procambarus clarkii)俗称小龙虾,具有适应性广、食性杂、繁殖力强、易饲养和营养丰富等特点[1], 是我国当前养殖产量最大的经济淡水甲壳类动物[2]。但是, 在长江中下游等地的虾-稻共作与池塘精养中, 克氏原螯虾在夏季养殖过程中极易受到持续性的高温胁迫, 如在江汉地区的虾-稻共作系统中其7月份的平均水温和瞬时水温分别高达31.4℃和39.7℃[3]。克氏原螯虾生长的最佳水温为21—27℃[4—6], 高温胁迫可引起该虾代谢失衡和免疫紊乱从而最终影响其正常生长甚至存活[7,8]。不仅如此, 一些研究表明高温胁迫对螯虾类动物的生存、摄食、生长、繁殖及抗逆性等均可造成广泛的负面影响[9—12]。然而, 在目前有关虾类及鱼类高温胁迫研究中, 多是采用急性试验的方法[7,8,13—15], 较长周期的高温胁迫试验不仅更能反映机体对环境压力的真实响应, 而且更符合养殖生产实际[9]。为此, 本试验以克氏原螯虾为对象, 通过1℃/d的缓慢升温后研究不同高水温的长期胁迫对该虾生长、消化及免疫功能的影响, 旨在探明该虾对持续高温胁迫的适应性及响应机制从而为其健康养殖提供理论依据。
1 材料与方法
1.1 试验动物与养殖管理
克氏原螯虾幼虾[均重(7.19±0.29) g, 均长(5.94±0.19) cm]由荆州市万金小龙虾养殖专业合作社提供, 试验虾在室内养殖系统的养殖缸(60 cm×40 cm×35 cm)中暂养7d后进行正式试验。暂养期间, 水温保持在(24.0±1.5)℃, 溶解氧>5 mg/L, pH为7.0—8.5,光周期为光照12h﹕暗12h。每天(8:30和17:30)投喂商品配合饲料2次, 日投喂量为该虾体重的3%。饲喂2h后, 用虹吸管吸出残饵和粪便, 以曝气自来水作为补充水源, 日换水量为1/3—2/3。
1.2 试验分组及动物处理
在暂养结束后, 将活力好、大小相近的克氏原螯虾平均分为4组, 根据克氏原螯虾生长的适宜和热胁迫温度范围, 设置高温梯度水平为29℃、32℃和35℃, 每组3个重复, 每个重复养殖22尾虾, 试验开始时测量其体长、体重。第1组(对照组)继续保持暂养水温24℃, 其他3个高温胁迫组养殖缸的水温以1℃/d的速度从24℃开始分别缓升至目标温度。各高温胁迫组的温度采用加热棒进行持续的恒温控制。试验期间, 所有处理组的其他养殖条件保持一致, 各胁迫组在换水前将所换水充分曝气并升至相应的目标温度。持续高温胁迫养殖试验周期为30d, 试验结束后从各组取所需组织。
1.3 样本收集
在试验结束后禁食24h, 对每组虾进行计数和体重、体长测定, 并计算增重及特定生长率。每个处理随机取6尾虾, 用1 mL无菌注射器从虾围心腔处抽取0.5 mL全血放入无菌EP管中, 4℃静置过夜,于4℃、12000 r/min离心15min, 取上清置于–80℃保存备用; 然后, 迅速冰上解剖并取出肝胰腺、胃和鳃等组织放入无菌EP管和无酶EP管中–80℃保存, 分别用于酶活性及基因表达测定。
1.4 指标测定
存活与生长 每天观察虾的存活、摄食与生长情况, 30d的养殖试验结束后统计其存活率与生长率。存活率(SR, %)=(Nt/N0)×100; 增重率(WGR,%)=(Wt–W0)/W0×100; 特定生长率(SGR, %/d)=(lnWt–lnW0)/t×100; 饵料系数(FCR)=F/(Wt–W0)。式中,N0和Nt分别为试验开始时和结束后的活虾数量(尾),W0和Wt分别为试验开始时和结束后的虾体重(g),t为试验天数(d),F为投饵量。
血淋巴免疫指标冻存血淋巴置于4℃冰箱解冻, 血蓝蛋白(HC)含量用稀释至1%的血淋巴采用紫外分光光度计测定[16], 酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、谷草转氨酶(AST)和谷丙转氨酶(ALT)活性均采用南京建成生物工程有限公司试剂盒进行测定。
消化酶活性及肝胰腺免疫指标冻存组织于冰上解冻, 取其肝胰腺和胃各0.1 g, 加入0.9 mL预冷生理盐水在冰水浴中用组织研磨机制成10%匀浆, 于4℃、3000 r/min离心10min, 取上清立即进行3种消化酶、总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)及丙二醛(MDA)的测定, 所有指标均采用南京建成生物工程有限公司试剂盒进行测定。
基因表达取肝胰腺、鳃组织的总RNA并电泳检测RNA质量, 使用PrimeScript™ RT reagent Kit with gDNA Eraser (TaKaRa)试剂盒进行mRNA的纯化和cDNA的合成, cDNA置于-20℃保存备用。肝胰腺和鳃中热应激蛋白基因(HSP70)的表达水平由荧光定量PCR(qRT-PCR)检测, 内参基因为18S RNA。扩增引物参照Guo等[8]HSP70F: 5′-GTTG ACCAAGATGAAGGAGAC-3′、HSP70R: 5′-CTGA CGCTGAGAGTCGTTG-3′和18S F: 5′-CTGTGATGC CCTTAGATGTT-3′、18S R: 5′-GCGAGGGGTA GAACATCCAA-3′, 引物由武汉天一辉远生物科技有限公司合成。使用SYBR®Premix DimerEraser™Kit (Perfect Real Time) (TaKaRa)试剂盒在StepOnePlus Real-Time PCR系统(Applied Biosystems)上进行分析, 其反应体系如下: SYBR®Premix DimerEraser(2×) 10 μL, cDNA模板10 ng, ROX Reference Dye(50×) 0.4 μL, 10 μmol/L正反向引物各0.6 μL, 使用灭菌双蒸水补齐到20 μL; 反应条件: 95℃ 30s, 95℃5s、56℃ 30s、72℃ 30s, 40个循环。HSP70基因的相对表达采用2–∆∆Ct法进行分析。
1.5 数据处理
所有数据均采用平均值±标准差表示。使用SPSS26.0软件对数据进行单因素方差分析(Oneway ANOVA)及多重比较(Duncan’s法), 分别以P<0.05和P<0.01表示差异显著或极显著。
2 结果
2.1 持续高温胁迫对克氏原螯虾存活与生长的影响
在试验结束后, 4个处理组的平均成活率分别为100%、95.45%、79.55%和63.63%, 因而随着持续胁迫温度的升高克氏原螯虾的存活率显著下降(P<0.05)。如表 1所示, 克氏原螯虾在为期30d的实验养殖条件下, 随着胁迫温度的升高其终末体重(FBW)、终末体长(FBL)、WGR和SGR等均呈先升后降的趋势且在29℃时均显著高于其他3个温度组(P<0.05); 32℃组与24℃对照组的各项生长性能指标无显著差异(P>0.05), 而35℃组的各项生长性能指标与24℃对照组相比均显著降低(P<0.05)。
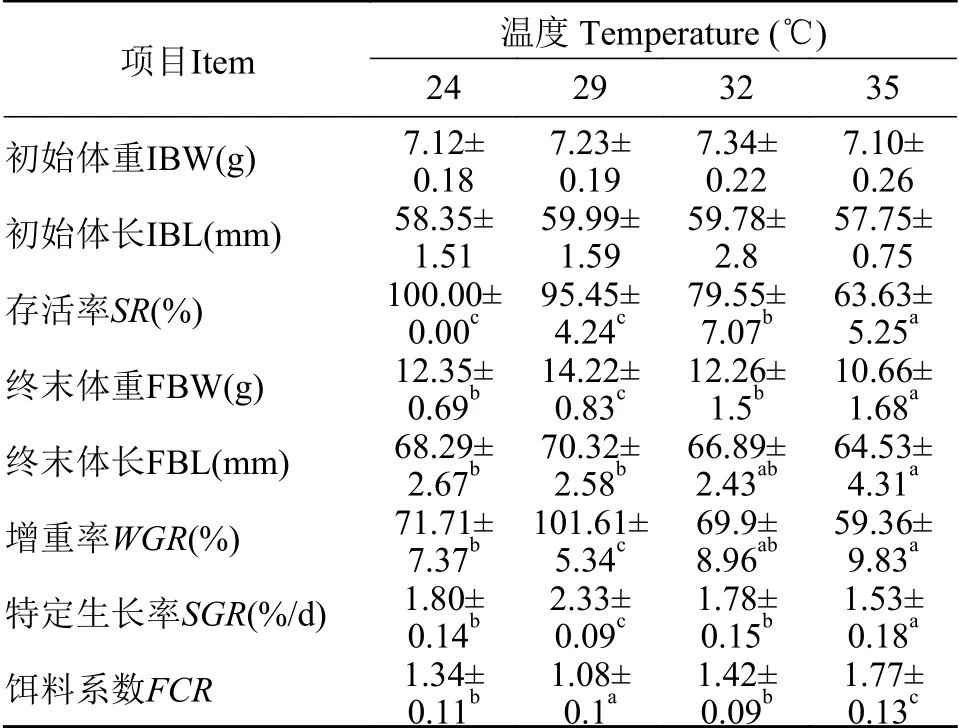
表1 持续高温胁迫对克氏原螯虾生长性能的影响Tab. 1 Effects of sustained high-temperature stress on growth performance of P. clarkii
2.2 持续高温胁迫对克氏原螯虾消化酶活性的影响
如图 1所示, 3种消化酶活性随温度的升高出现先升后降的变化趋势。29℃高温组的胃蛋白酶、淀粉酶和脂肪酶活性均达到峰值并显著高于其他3个温度组(P<0.05); 与24℃对照组相比, 32℃高温组淀粉酶、脂肪酶的活性显著升高(P<0.05)而胃蛋白酶活性无显著变化(P>0.05), 35℃高温组淀粉酶、脂肪酶的活性无显著变化(P>0.05)而胃蛋白酶活性显著下降(P<0.05)。
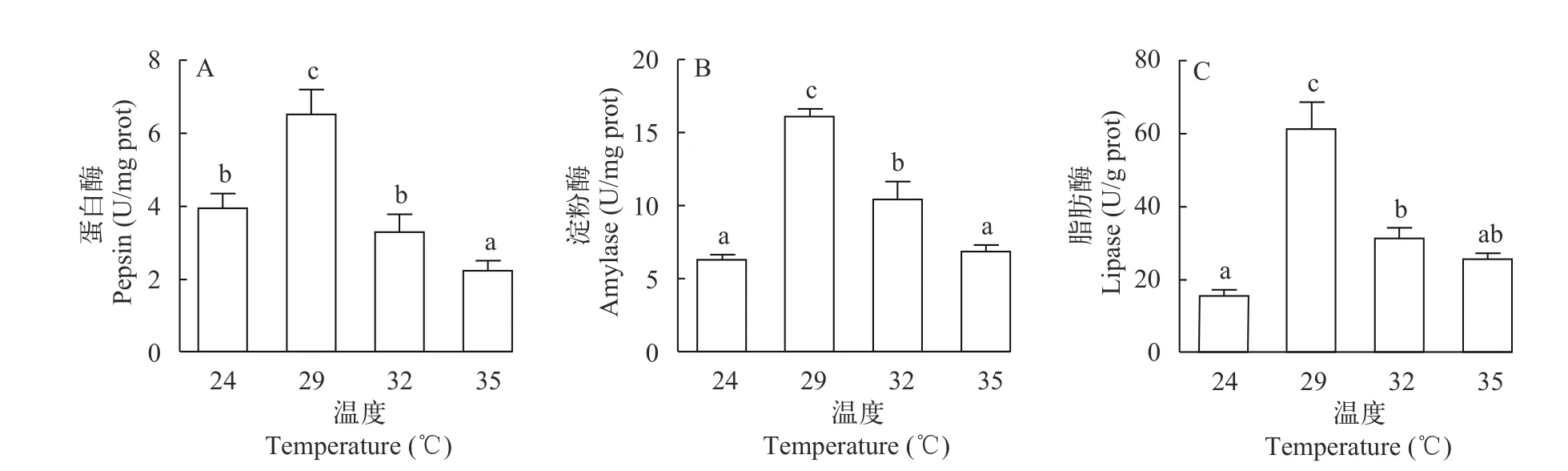
图1 持续高温胁迫对克氏原螯虾消化酶活性的影响Fig. 1 Effects of sustained high-temperature stress on digestive enzyme activities of P. clarkii不同字母表示处理之间差异显著(P<0.05); 下同Different small letters indicate significant difference (P<0.05); the same applies below
2.3 持续高温胁迫对克氏原螯虾免疫指标的影响
如图 2所示, 各高温组(29℃、32℃和35℃)HC含量(32℃除外)、ACP活性及AKP活性较24℃对照组均显著降低(P<0.05); 在4个处理中, 随着温度的上升AST活性和ALT活性逐步显著上升, 且在35℃时达到最高(P<0.05)。

图2 持续高温胁迫对克氏原螯虾血淋巴非特异性免疫指标的影响Fig. 2 Effects of sustained high temperature stress on nonspecific immune indices in hemolymph of P. clarkii
如图 3所示, 29℃组的T-AOC活性显著低于24℃对照组和32℃组(P<0.05)而其他三组的TAOC活性差异不显著(P>0.05); 29℃组的T-SOD活性均显著低于其他三组(P<0.05), 32℃组的T-SOD活性显著高于24℃对照组而35℃组的T-SOD活性与24℃对照组相比无显著差异(P>0.05); 丙二醛(MDA)含量随温度上升而逐步显著升高(P<0.05)。

图3 持续高温胁迫对克氏原螯虾肝胰腺抗氧化指标的影响Fig. 3 Effects of sustained high-temperature stress on antioxidant indices in hepatopancreas of P. clarkii
如图 4所示,HSP70基因在35℃时表达量最高且与其他三组的差异极显著(P<0.01); 与对照组相比, 29℃时两组织中HSP70基因表达量均显著增加(P<0.05)而32℃时该基因的表达无显著上升(P>0.05)。

图4 持续高温胁迫后克氏原螯虾不同组织HSP70基因的相对表达Fig. 4 The relative expression of of HSP70 gene in different tissues of P. clarkii after sustained high-temperature stress
3 讨论
3.1 持续高温胁迫对克氏原螯虾生长与消化的影响
在水生环境中, 温度是影响虾蟹等甲壳动物生存、代谢、免疫和细胞生理反应的关键环境因素之一[7,17], 而克氏原螯虾作为一种变温动物, 对环境温度变化的响应尤为明显[18]。本研究的数据显示,胁迫温度越高, 克氏原螯虾的成活率越低; 当克氏原螯虾长期处于29℃的温度时, 其生长性能显著高于其他组; 而32℃以上的持续高温则对其生长、消化均显著不利。一些研究表明, 克氏原螯虾幼体生长发育的适宜温度为25℃左右, 但最高不能超过30℃[5,19]; 谢伟[6]的养殖试验表明30℃高温可一定程度的促进该虾幼虾(初始均重5.42 g以上)的生长;Huner等[20]发现水温高于30℃时克氏原螯虾停止摄食, 高于32.2℃时则停止生长。此外, 对红螯螯虾(Cherax quadricarinatus)的70d养殖试验表明, 在16—32℃范围内该虾的存活率均在90%以上, 且水温28℃是其最适生长温度[21]。本研究中的最适生长温度与上述其他研究相一致, 但在此温度下长期生活的克氏原螯虾存在较大的健康风险。
本研究显示, 3种消化酶在29℃时表现出最大活性且显著高于其他3个温度组(P<0.05), 这表明该虾的生长与消化功能存在明显的一致性。消化酶活性的高低代表机体对营养素的消化能力[22—24]且与摄食之间存在相互促进的交互作用[23]。Croll和Watts[25]的研究显示, 在8—32℃内克氏原螯虾的摄食率和排便率随温度上升而提高, 且在高温下该虾的摄食和排便比另一种原螯虾属的Procambarus zonangulus更加旺盛。因而, 在较高温度条件下, 克氏原螯虾可大量摄食并通过较高的消化酶活性分解主要营养素而获得较高生长性能。另外在本研究中, 32—35℃引起3种消化酶活性的显著下降, 这可能是由于过高的养殖水温超出了机体的耐受范围并引起代谢紊乱, 从而抑制了消化酶分泌及其活性[26]。
3.2 持续高温胁迫对克氏原螯虾免疫指标的影响
非特异性免疫系统是无脊椎动物抵御胁迫的唯一防线[17]。甲壳类动物的血蓝蛋白兼具携氧与免疫功能, 水温升高不利于血蓝蛋白与氧结合[27],外来胁迫可诱导血蓝蛋白的酚氧化酶免疫活性和抗菌肽活性[27,28]。在本研究中, 当克氏原螯虾处于29℃及以上的高水温时其血淋巴血蓝蛋白含量显著下降, 这表明持续高温胁迫可能使该虾血氧亲和力与免疫功能同时受损。AKP和ACP是两种重要的代谢调节酶[8], 其在甲壳动物的非特异性免疫反应中发挥重要作用[29,30]。一些研究显示, 温度升高会显著降低克氏原螯虾ACP和AKP活性, 从而损害虾的免疫功能[31,32], 本研究结果表明随着温度上升血淋巴中的ACP和AKP活性显著降低, 这与上述其他研究一致; 此外, 脊尾白虾(Exopalaemon carinicauda)[33]和凡纳滨对虾(Litopenaeus vannamei)[34]中也有类似结果。
血淋巴中ALT和AST的活性可反映肝胰腺组织损伤程度[35], 在正常情况下肝胰腺中的ALT和AST仅少量释放于血淋巴中, 但肝胰腺的组织病变可导致大量转氨酶被释放[36]。在本研究中, 克氏原螯虾持续高温组的血淋巴中ALT和AST活性较常温组均显著上升, 且其活性与水温高低呈显著正相关。这表明, 持续高温胁迫可能使该虾的肝细胞在受损后其膜的通透性增加, 从而导致这两种转氨酶大量逸出肝胰腺。
水生生物在长期进化过程中形成了抵御氧化损伤的抗氧化系统[14,37], 过量活性氧(Reactive Oxygen Species, ROS)的产生会激活机体的抗氧化防御系统从而导致抗氧化酶类成分发生改变[38,39]。脂质过氧化物(Lipid peroxide, LPO)被认为是ROS氧化脂质的产物之一[40], MDA是脂质过氧化代谢终产物, 其含量高低作为氧化损伤的指标, 可反应机体细胞的受自由基攻击程度及受损的严重程度[41];SOD是一种重要的抗氧化酶, 通过专一性催化超氧阴离子自由基转化为分子氧(O2)和过氧化氢(H2O2), H2O2再经过氧化氢酶(Catalase, CAT)和谷胱甘肽过氧化物酶(Glutathione peroxidase, GPx)等的催化生成水和O2从而使活性氧自由基得以清除;T-AOC是衡量所有酶促抗氧化剂(如SOD、CAT和GPx)累计作用的一个总体表现指标[42,43]。一些关于螯虾的其他胁迫研究表明, 窄爪螯虾(Astacus leptodactylus)在长期饥饿过程中其SOD活性与MDA水平分别显著下降和显著上升[38], 而克氏原螯虾在环境毒物有机硅处理后其肌肉中的SOD活性与MDA水平呈不同程度的上升[44,45]。本研究结果显示, 肝胰腺的总抗氧化能力(T-AOC)和总超氧化物歧化酶(T-SOD)活性在29℃时最低且在35℃时也略低于常温组; 持续胁迫温度越高其MDA水平也显著越高。因此, 遭受环境胁迫的螯虾类会启动氧化应激反应而导致MDA水平上升。但是, SOD活性的升降可能与胁迫的类型、条件和程度等有关,Guo等[8]的急性高温胁迫试验结果显示, 克氏原螯虾在6—48h内其SOD活性显著升高, 但在72h时恢复正常水平。然而, 从本研究的总体结果可初步推断, 持续高温应激导致了克氏原螯虾抗氧化应激能力下降与MDA有害物在体内的积累。
HSP70通过促进内源性过氧化物酶活性来应对氧化应激[46], 从而保护细胞免受损伤[47]。已有研究表明, 该基因的表达主要由热处理诱导所致[48]。高温胁迫可导致虾体内未折叠或错误折叠的蛋白质含量增加, 从而引发HSP70基因的过表达, 而被温度诱导的热应激蛋白最终用以修复因高温胁迫损伤的蛋白质[49]。在适宜温度条件下螯虾HSP70基因的表达量较低, 但高温环境下会使其表达量显著升高[8,50]; Mohamad等[47]在对罗氏沼虾(Macrobrachium rosenbergii)进行30d的高温胁迫处理后,发现其肝胰腺中HSP70基因的表达量在35℃时较28℃显著上升。在本研究中, 肝胰腺和鳃组织中HSP70基因在29℃时显著上升, 且在35℃时其表达量显著高于其他处理组, 这与上述其他的研究结果类似。因此可以推断,HSP70表达升高可能是克氏原螯虾响应水温升高的一种应激保护机制。
综上所述, 相比于24℃的适宜生活温度, 29℃的持续高温虽可显著促进克氏原螯虾的生长与消化, 但对其免疫及抗氧化功能显著不利, 而32℃以上的持续高温胁迫则对其存活、生长与消化、免疫及抗氧化功能均造成显著的负面影响。为此, 在夏季的养殖生产中, 有必要对持续高温的养殖水环境进行有效的综合调控, 如采取加深水位、监测和调节水质、维护良好的水草生态空间等生态措施以降低克氏原螯虾的栖息水温; 同时, 通过营养免疫和精准投喂等营养调控方式来提高该虾对持续高温胁迫的免疫抵御能力。

