CT 引导下经皮微波消融术对肝癌患者免疫功能及生存率的影响
王 建
(濮阳市范县人民医院介入科,河南 濮阳 457500)
肝癌起病隐匿,一般有症状进行就诊时多数患者已发展至晚期,失去手术切除机会,增加临床病死率[1]。临床对于无法手术治疗的肝癌患者通常予以肝动脉化疗栓塞术(TACE)、射频消融术、微波消融术等方式治疗,但单一使用效果局限,联合应用可提高治疗效果[2]。而近年发展成熟的CT 引导下经皮微波消融术具有视野清晰、精准病灶消融等优势[3]。基于此,本研究分组探讨加用CT 引导下经皮微波消融术在肝癌患者中的应用效果,现报告如下。
1 资料与方法
1.1 一般资料:回顾性选取2017年4 月至2018年5 月我院肝癌患者94例,予以TACE 治疗的46例为TACE 组,在TACE 组基础上予以CT 引导下经皮微波消融术治疗的48例为研究组。研究组男35例,女 13例;年龄 41~72 岁,平均(55.98±7.45)岁;肿瘤最大径 20~80mm,平均(49.26±14.35)mm。TACE 组男 33例,女 13例;年龄 43~72 岁,平均(57.24±7.09) 岁;肿瘤最大径 18~80mm,平均(47.29±13.91)mm。两组基线资料均衡可比(P>0.05)。
1.2 选取标准:纳入标准:经CT 等影像学与病理活检检查确诊为肝癌,均为晚期;Child-Pugh 分级A、B级;至少有1个可测量病灶,均未接受过其他放化疗治疗;卡氏评分(KPS)>70 分;临床资料完整。排除标准:存在广泛肝外转移者;合并严重凝血功能异常者;合并严重肝硬化者;认知功能障碍者;伴有重度骨髓抑制者。
1.3 方法
1.3.1 TACE 组:予以TACE 治疗,局麻下经皮穿刺股动脉进行置管,在造影机监视下肝管经股动脉插管进入肝总动脉进行造影,部分患者实施膈动脉造影、肠系膜上动脉造影,明确肿瘤滋养动脉,将导管插管于供血动脉内,向其注入奥沙利铂100mg、碘化油,未能完全阻断肿瘤病灶供血者予以明胶海绵颗粒栓塞剂1/3~2/3 支,术后再次行肝动脉造影,评估栓塞程度与肝动脉分支血流,依据肿瘤大小确定治疗次数,每次间隔约4周,术后常规进行护肝、止痛、加强营养支持等治疗。
1.3.2 研究组:在TACE 组基础上予以CT 引导下经皮微波消融术治疗,TACE 治疗同TACE 组,在TACE 治疗7d 后进行CT 引导下经皮微波消融术,使用德国西门子的Emotion16 CT 机、微波消融治疗仪、微波消融天线治疗,行腹部CT 平扫确定患者肿瘤位置,嘱咐患者取左侧卧位或仰卧位,确定穿刺路径、穿刺点,在荧光屏监视下选择最短穿刺路径,注意避开肠管、胆管、胃及大血管等;依据患者肿瘤大小、部位等设定微波功率(40~60W)、时间(5~8min),经引导针向病灶内注入生理盐水,消融范围>肿瘤边缘约10mm;对于肿瘤长径>50mm 者采用多点叠加消融扩大消融范围,整个消融范围在CT 监视下进行,注意肝内局部变化;消融结束后抽出穿刺针,进行针道消融,防止病灶通过针道转移,然后行CT 增强扫描,观察消融范围是否覆盖肿瘤靶区,来决定是否进行补充消融,术后治疗同TACE组。
1.4 观察指标:治疗3个月后评估客观缓解率。完全缓解(CR):靶病灶无动脉期增强,病灶消失(维持1个月以上);部分缓解(PR):动脉期增强扫描显示靶病灶最大径缩小≥30%,维持1个月以上;疾病进展(PD):有新发病灶,或动脉期增强扫描显示靶病灶最大径增大≥20%;疾病稳定(SD):靶病灶缩小或增大介于PR 与PD 间,将CR、PR 计为客观缓解率;免疫功能。于治疗前、治疗3个月后采集两组外周静脉血,使用流式细胞仪测定T 淋巴细胞亚群CD4+、CD8+水平;生存率。统计比较两组1年及2年生存率。
1.5 统计学分析:运用SPSS22.0 软件分析数据,计量资料采用t 检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 客观缓解率:研究组客观缓解率60.42%高于TACE组 39.13%(χ2=4.257,P=0.039),详见表 1。
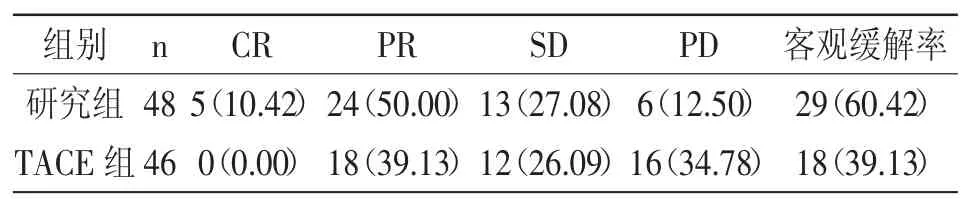
表1 两组客观缓解率比较 [n(%)]
2.2 免疫功能:治疗后研究组CD4+及CD8+水平均优于 TACE 组(P<0.05),详见表 2。
表2 治疗前后两组免疫功能比较 ()

表2 治疗前后两组免疫功能比较 ()
组别 n CD4+ CD8+治疗前 治疗后 治疗前 治疗后研究组 48 16.27±4.03 35.12±6.02 54.12±5.17 26.33±4.94 TACE 组 46 17.41±3.57 29.27±5.85 53.04±4.48 33.86±5.23 t 值 1.852 4.530 1.080 7.179 P 值 0.065 <0.001 0.283 <0.001
2.3 生存率:研究组1年生存率为70.83%,TACE组1年生存率为60.87%,差异无统计学意义(χ2=1.039,P=0.308);研究组 2年生存率为 56.25%,高于 TACE 组 34.78%(χ2=4.362,P=0.037)。
3 讨论
手术切除是治疗肝癌的有效手段,但对于失去手术切除机会的肝癌患者,由于肝癌易发生血管侵犯,故临床常用TACE 治疗,但研究显示单纯应用TACE 治疗临床疗效局限,难以有效延长患者生存期,主要是化疗药物敏感性及供血动脉存在多条等致使肿瘤复发,增加死亡率[4-5]。
研究显示,超声引导下微波消融术联合TACE治疗特殊部位肝癌,疗效与安全性均得到临床认可。而影像技术CT 具有更清晰的成像优势,与微波消融术结合,可提高消融精准度。本研究在TACE 治疗基础上应用CT 引导下经皮微波消融术治疗肝癌,结果显示,研究组客观缓解率与2年生存率均高于TACE 组,说明较单纯使用TACE 而言,加用CT 引导下经皮微波消融术可提高患者客观缓解率与2年生存率,主要是在应用TACE 后病灶边缘血流速度减慢,间接增大微波消融范围,此时应用微波消融可降低血流吸热效应,避免消融温度降低而影响效果;另一方面CT 引导后可明确界定瘤体边界,提高治疗精确度,且消融过程中实时监控便于定位与评估消融范围,因此加用CT 引导下经皮微波消融术,长期效果更为肯定,可提高患者2年生存率。
肝癌患者自身细胞免疫受到严重抑制,外周血T 淋巴细胞亚群中CD4+水平低于正常机体,CD8+水平则出现明显上升,使得肿瘤细胞更易侵袭正常组成。加用CT 引导下经皮微波消融术治疗肝癌患者后发现,治疗后研究组CD4+及CD8+水平均优于TACE 组,表明较使用TACE 治疗,加用CT 引导下经皮微波消融术可改善肝癌患者免疫功能,主要是加用CT 引导下经皮微波消融术治疗后机体释放的肿瘤因子明显减少,解除肿瘤对机体的免疫抑制,且热效应灭活肿瘤细胞,刺激肝组织产生热休克蛋白,形成复合物,参与机体肿瘤抗原呈递T 淋巴细胞,激活细胞免疫,从而改善患者免疫功能。
综上所述,与单纯使用TACE 治疗相比,加用CT 引导下经皮微波消融术治疗肝癌患者,临床效果确切,能改善患者术后免疫功能,进而提高患者2年生存率。

