带状疱疹急性期发生后遗神经痛患者血清免疫球蛋白、炎性因子、疼痛介质水平及关系分析
夏爱华,施翠芬
(1.盐城市第一人民医院检验科,江苏 盐城 224006;2.盐城市第二人民医院感染科,江苏 盐城 224002)
带状疱疹(herpes zoster,HZ)是一种疱疹性皮肤病,其主要是由水痘 - 带状疱疹病毒(VZV)感染所致,临床上常因VZV的病毒特性而导致患者出现神经性疼痛,即为后遗神经痛(PHN)。PHN作为HZ的一种愈后并发症,亦属于神经性疼痛,发生率较高,且会严重影响到患者的日常生活与工作[1]。HZ急性期患者发生PHN会使得患者产生疼痛感,进而可导致多项疼痛介质水平发生变化;VZV感染后体液免疫应答紊乱可造成机体免疫球蛋白异常分泌,同时易促使多项促炎因子的分泌与释放,加重病情[2]。故临床上通过对影响PHN的相关生物指标进行深入研究,以得出早期诊断结果,在患者的临床治疗与预防中发挥着重要的指导意义。故本研究旨在探讨HZ急性期患者发生PHN与血清免疫球蛋白、炎性因子水平的相关性,现报道如下。
1 资料与方法
1.1 一般资料选取盐城市第一人民医院2017年1月至2021年1月收治的113例HZ急性期患者,其中53例治愈后3个月发生PHN,将其作为PHN组,60例治愈后3个月未发生PHN,将其作为HZ组,并选取同期60例健康体检志愿者作为对照组,进行前瞻性研究。对照组研究对象中男性34例,女性26例;年龄25~75岁,平均(53.46±10.24)岁。PHN组患者中男性24例,女性29例;年龄24~75岁,平均(52.48±10.27)岁。HZ组患者中男性32例,女性28例;年龄23~74岁,平均(52.50±10.25)岁。3组研究对象的性别、年龄经比较,差异均无统计学意义(均P>0.05),组间可进行比较。纳入标准:所有患者均符合《皮肤性病诊断与治疗》[3]中关于带状疱疹的诊断标准,且PHN组患者符合《带状疱疹后神经痛诊疗中国专家共识》[4]中的相关诊断标准;所有患者均属于急性起病,且在皮肤红斑处有簇集性水疱者;PHN组疼痛为间歇性针扎感、烧灼感者等。排除标准:患有严重精神类疾病者;心、肝、肾等功能不全者;患有血液系统类疾病者等。本研究经盐城市第一人民医院医学伦理委员会审核批准,且所有研究对象均已签署知情同意书。
1.2 检测方法①血清免疫球蛋白指标检测:采集3组研究对象的空腹静脉血约5 mL,待其自行凝固后,以3 000 r/min转速离心15 min取血清,采用免疫散射比浊法检测并比较血清免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)水平。②血清炎性因子水平检测:血液采集、血清制备方法同①,采用酶联免疫吸附实验法检测并比较3组研究对象血清转化生长因子 -β1(TGF-β1)、白细胞介素 -2(IL-2)、肿瘤坏死因子 -α(TNF-α)、白细胞介素 -8(IL-8)、白细胞介素 -1β(IL-1β)水平。③血清疼痛介质水平检测:血液采集、血清制备及检测方法同②,比较3组研究对象血清降钙素基因相关肽(CGRP)、β- 内啡肽(β-ET)、P 物质(SP)、神经生长因子诱导蛋白(VGF)、神经降压素(NT)水平。
1.3 统计学方法应用SPSS 22.0统计软件分析数据,计量资料以(±s)表示,多组间比较行F检验;血清免疫球蛋白、炎性因子、疼痛介质各项指标的相关性用Pearson相关系数分析。以P<0.05为差异有统计学意义。
2 结果
2.1 血清免疫球蛋白水平PHN组、HZ组患者血清IgA、IgG、IgM水平均显著高于对照组;但PHN组患者血清IgA、IgG、IgM水平均显著低于HZ组,差异均有统计学意义(均P<0.05),见表1。
表1 3组研究对象血清免疫球蛋白水平比较( ±s , mg/L)
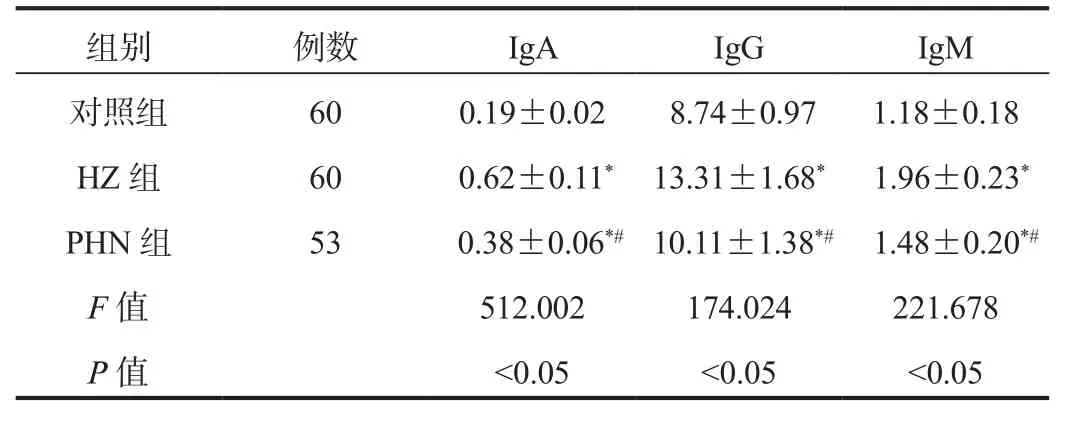
表1 3组研究对象血清免疫球蛋白水平比较( ±s , mg/L)
注:与对照组比,*P<0.05;与HZ组比,#P<0.05。HZ:带状疱疹;PHN:后遗神经痛;IgA:免疫球蛋白A;IgG:免疫球蛋白G;IgM:免疫球蛋白M。
组别 例数 IgA IgG IgM对照组 60 0.19±0.02 8.74±0.97 1.18±0.18 HZ 组 60 0.62±0.11* 13.31±1.68* 1.96±0.23*PHN 组 53 0.38±0.06*# 10.11±1.38*# 1.48±0.20*#F值 512.002 174.024 221.678 P值 <0.05 <0.05 <0.05
2.2 血清炎性因子水平PHN组、HZ组患者血清TGF-β1、TNF-α、IL-8、IL-1β水平均显著高于对照组,血清IL-2水平显著低于对照组;而PHN组患者血清TGF-β1水平显著高于HZ组,IL-2水平显著低于HZ组,差异均有统计学意义(均P<0.05);而HZ组与PHN组患者血清TNF-α、IL-8、IL-1β水平经比较,差异均无统计学意义(均P>0.05),见表2。
表2 3组研究对象血清炎性因子水平比较( ±s , ng/mL)

表2 3组研究对象血清炎性因子水平比较( ±s , ng/mL)
注:与对照组比,*P<0.05;与HZ组比,#P<0.05。TGF-β1:转化生长因子 -β1;IL-2:白细胞介素 -2;TNF-α:肿瘤坏死因子 -α;IL-8:白细胞介素 -8;IL-1β:白细胞介素 -1β。
组别 例数 TGF-β1 IL-2 TNF-α IL-8 IL-1β对照组 60 10.98±1.62 35.11±4.36 87.42±12.01 213.12±32.15 36.92±10.13 HZ 组 60 18.68±2.23* 18.02±2.14* 199.86±20.55* 650.43±34.22* 68.95±13.07*PHN 组 53 30.06±3.47*# 10.94±1.31*# 201.06±19.74* 655.02±35.49* 70.03±12.48*F值 815.372 1 018.013 792.379 3 289.881 145.646 P值 <0.05 <0.05 <0.05 <0.05 <0.05
2.3 血清疼痛介质水平PHN组、HZ组患者血清CGRP、SP、VGF水平均显著高于对照组,且PHN组显著高于HZ组;PHN组、HZ组患者血清β-ET、NT水平均显著低于对照组,且PHN组显著低于HZ组,差异均有统计学意义(均P<0.05),见表3。
表3 3组研究对象血清疼痛介质水平比较( ±s , pg/mL)
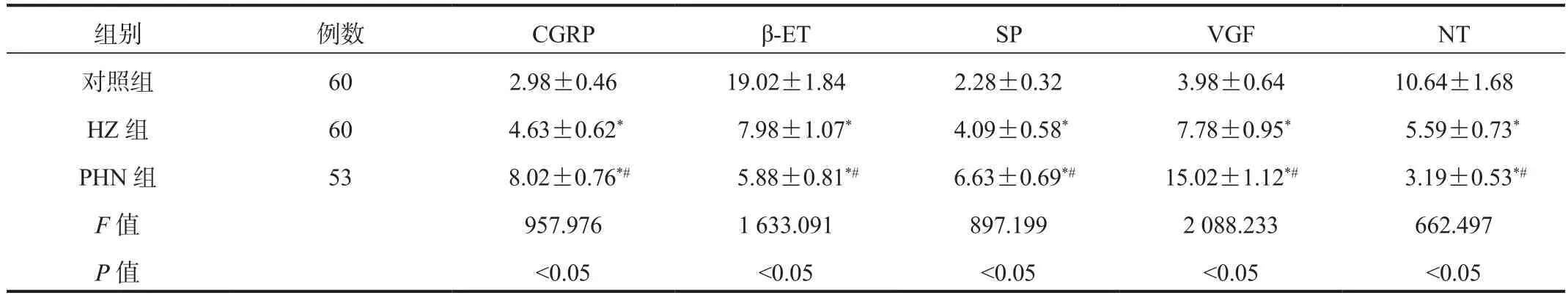
表3 3组研究对象血清疼痛介质水平比较( ±s , pg/mL)
注:与对照组比,*P<0.05;与HZ组比,#P<0.05。CGRP:降钙素基因相关肽;β-ET:β- 内啡肽;SP:P物质;VGF:神经生长因子诱导蛋白;NT:神经降压素。
组别 例数 CGRP β-ET SP VGF NT对照组 60 2.98±0.46 19.02±1.84 2.28±0.32 3.98±0.64 10.64±1.68 HZ 组 60 4.63±0.62* 7.98±1.07* 4.09±0.58* 7.78±0.95* 5.59±0.73*PHN 组 53 8.02±0.76*# 5.88±0.81*# 6.63±0.69*# 15.02±1.12*# 3.19±0.53*#F值 957.976 1 633.091 897.199 2 088.233 662.497 P值 <0.05 <0.05 <0.05 <0.05 <0.05
2.4 血清免疫球蛋白、炎性因子、疼痛介质各项指标相关性血清CGRP、SP、VGF水平均与IgA、IgG、IgM、TGF-β1、TNF-α、IL-8、IL-1β 呈正相关,与 IL-2 呈负相关;血清 β-ET、NT 水平与 IgA、IgG、IgM、TGF-β1、TNF-α、IL-8、IL-1β水平均呈负相关,与 IL-2 呈正相关,差异均有统计学意义(均P<0.05),见表4。
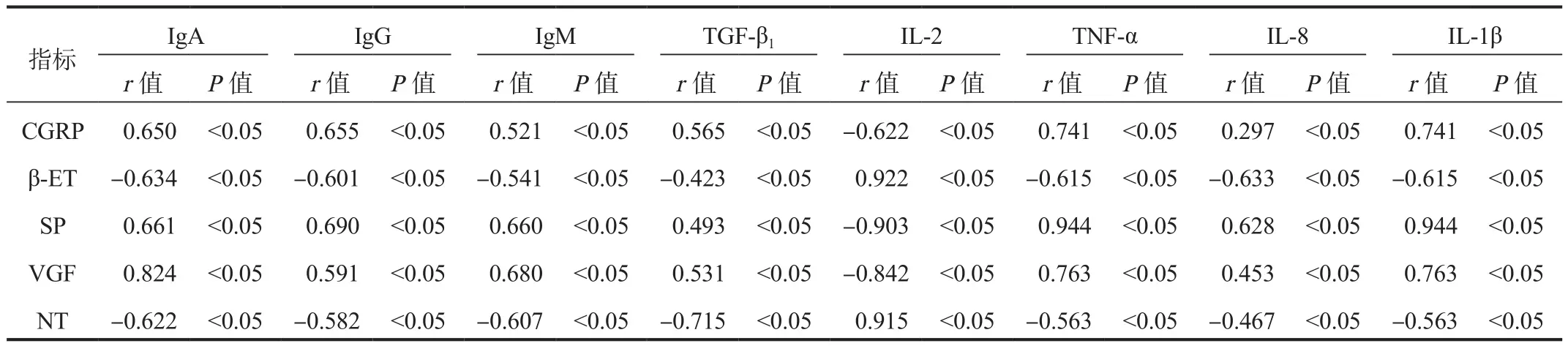
表4 血清免疫球蛋白、炎性因子、疼痛介质相关性分析
3 讨论
HZ急性期患者出现PHN主要是疱疹经治疗消退后所存在的神经性疼痛,其严重程度主要与机体的血管通透性、炎性因子分泌、神经元的兴奋性等多种因素有关,因此,对HZ急性期患者PHN发病机制的研究有利于改善患者预后。本研究主要对HZ急性期患者PHN的血清免疫球蛋白、炎性因子等实验室指标与疾病疼痛介质的相关性进行研究,以期为PHN的临床诊断提供依据。
VZV感染可引起细胞免疫紊乱,造成免疫球蛋白和细胞因子的异常,而免疫球蛋白水平与机体的抗病毒反应密切相关,进而可造成VZV在三叉神经节、脊髓后根神经节等部位再次复制,从而引起PHN的发生。IgA、IgG、IgM是主要的免疫球蛋白,其在血清中高水平表达会增强机体的免疫应答反应,清除机体病毒,进而对机体的神经性疼痛反应起到抑制的作用[5]。血清炎性因子是由于机体的T淋巴细胞免疫应答功能紊乱所引起的,血清TGF-β1、TNF-α、IL-8、IL-1β是T细胞亚群分泌紊乱所产生的主要炎性因子,其对于机体的抗病毒免疫具有抑制作用,会加重机体的疼痛反应;血清IL-2参与机体细胞的免疫应答反应,对于机体的抗病毒反应具有协同的作用,故其在血清中水平呈高表达,可以对机体的神经性疼痛起到缓解的效果[6]。本研究结果显示,HZ组、PHN组患者血清IgA、IgG、IgM、TGF-β1、TNF-α、IL-8、IL-1β 水平均显著高于对照组,血清IL-2水平均显著低于对照组,表明HZ急性期患者出现PHN可导致自身出现应激反应,进而导致机体各项免疫球蛋白、炎性因子水平出现异常。而本研究中,PHN组患者血清IgA、IgG、IgM、IL-2水平均显著低于HZ组,血清TGF-β1水平均显著高于HZ组,进一步说明当机体免疫应答不足,且分泌的免疫球蛋白不足以清除病毒时,就可引起PHN的发生,从而增强机体的炎性应激反应。
研究表明,HZ急性期患者出现PHN与血清中的疼痛介质水平变化密切相关,CGRP、β-ET、SP、VGF、NT是主要的疼痛介质,其在血清中的水平与机体的神经性疼痛程度关系密切。其中CGRP能够扩大机体的疼痛感觉,其在对机体的血管进行扩张的同时,会增加微循环的通透性,进而促进机体炎性因子的分泌,而且其在血清中高表达会抑制P物质的降解,进而使得机体的疼痛程度加重,促进病情;β-EP、NT是重要的有疼痛抑制作用的神经调节肽,能够对机体神经元的兴奋性产生促进的作用,在机体的神经性疼痛表达中可起到抑制疼痛的效果,其在血清中高水平表达,可以通过与相应的受体进行结合达到减轻机体疼痛的效果;而SP、VGF是具有致痛作用的神经调节肽,其在血清中高水平表达会提高神经元疼痛感觉的兴奋性,且积极参与神经性疼痛的整个过程,促使HZ急性期患者PHN的发生[7-8]。本研究中,PHN组、HZ组患者血清CGRP、SP、VGF水平均显著高于对照组,且PHN组显著高于HZ组;PHN组、HZ组患者血清β-ET、NT水平均显著低于对照组,且PHN组显著低于HZ组。
通过进一步对血清炎性因子、免疫球蛋白与疼痛介质的关系进行观察汇总发现,血清炎性因子、免疫球蛋白表达异常,可能会使得机体的组织受损,抗病毒能力减弱,进而加重机体的神经性疼痛,这可能与血清中的促炎因子通过不断分泌释放并参与机体的炎症反应,免疫球蛋白通过分解作用于机体的免疫反应,疼痛介质作用与机体神经系统的疼痛感知功能有一定的关系[9]。本研究结果显示,血清CGRP、SP、VGF水平均与IgA、IgG、IgM、TGF-β1、TNF-α、IL-8、IL-1β呈正相关,与IL-2呈负相关;血清β-ET、NT水平与IgA、IgG、IgM、TGF-β1、TNF-α、IL-8、IL-1β水平均呈负相关,与IL-2呈正相关,表明HZ急性期患者PHN发生疼痛程度与血清炎性因子、免疫球蛋白水平有显著的相关性,与史海军等[10]研究结果相符。
综上,HZ急性期患者PHN发生疼痛程度与血清炎性因子、免疫球蛋白水平有显著的相关性,临床上可通过检测上述指标评估PHN发生情况和严重程度,进而制定有效治疗和预防措施。

