载bpV(PIC)的神经干细胞联合神经营养素⁃3壳聚糖支架参与创伤性颅脑损伤后脑神经修复的研究
李军 管义祥 丁锦荣 刘小江 管诚
海安市人民医院神经外科(江苏海安 226600)
由交通事故、高空坠落等造成的创伤性颅脑损伤(traumatic brain injury,TBI)引起的神经受损会诱发多种神经并发症,并长期影响患者的生活[1]。但是研究显示成年人中枢神经系统损伤后难以修复,而促进神经元的再生和修复是保护TBI后神经功能的关键[2]。目前TBI 的临床治疗方法主要包括手术治疗、药物治疗、物理疗法,但效果大都不尽理想。随着神经干细胞(neural stem cells,NSCs)移植技术的发展,给TBI 神经修复带来了新的希望,NSCs 移植后在受损区域分化为神经元替代因损伤凋亡的宿主神经元,并且分泌多种神经营养类物质[3]。进一步的体内研究显示,NSCs 的抑制可以促进神经元的修复和再生,但移植后的NSCs 存活率相对低,所以疗效仍有欠缺,治疗方法待进一步改善[4]。PTEN 蛋白在脑组织中表达,并且当PTEN 失活,会促进神经元的增殖、分化和轴突的形成[5]。牛细小病毒bpV(PIC)可在短期内强力抑制PTEN 蛋白,研究已经显示使用bpV 处理可促进NSCs的存活,并促进NSCs的增殖和分化[6]。壳聚糖支架因具有生物降解性、低抗原性、良好的生物相容性和无热原效应等优点,而被广泛应用于脑组织工程中,研究显示神经营养素3(neuro⁃trophin 3,NT⁃3)修饰的壳聚糖支架可保护神经元,并可促进对骨神经损伤的修复[7]。本研究将载bpV(PIC)的神经干细胞联合NT⁃3 壳聚糖支架移植到大鼠颅脑损伤区域,探讨其对受损伤的神经修复作用观察大鼠神经功能恢复的情况。
1 材料与方法
1.1 材料和设备Sprague⁃Dawley(SD)雄性大鼠(SPF 级,8~10 周,270~290 g)以及孕14 d 雌性大鼠来自南通大学实验动物中,生产许可证号:SCXK(苏)2002⁃0019。SAR830/AP 呼吸机(CWE 公司,美国)。bpV(PIC)(ATCC 公司,美国)。NT⁃3壳聚糖支架(浙江金壳公司,中国)。莫里斯水迷宫(XR⁃XM101,上海新软信息技术有限公司,中国)。HE 染色。Leica EM UC6 切片机(Leica 公司,德国)。BrdU 试剂盒(碧云天公司,中国)。
1.2 大鼠建模、分组和干预将90 只大鼠随机分为对照组、TBI 组、TBI+NSCs 组、TBI+bpV(PIC)⁃NSCs 组、TBI+NT⁃3 壳聚糖组和TBI+bpV(PIC)⁃NSCs+NT⁃3 组(n=15)。根据参考文献构建TBI 模型[8],通过腹膜内注射水合氯醛(10%,3 mL/kg)麻醉大鼠,连接呼吸机,呼吸平稳后常规消毒剃毛,暴露骨窗,使用小动物颅脑撞击器敲击模拟中度皮层损伤。对照组大鼠仅暴露骨窗不敲击。根据组别,在敲击后立即植入NSCs(1×106个)、bpV(PIC)⁃NSCs(1×106个)、NT⁃3 壳聚糖(1 各单位)或者负载bpV(PIC)⁃NSCs 的NT⁃3 壳聚糖(1×106个NSCs+1 各单位)[9-10]。然后缝合伤口,注射抗生素预防感染。
1.3 负载bpV(PIC)⁃NSCs 的NT⁃3 壳聚糖支架的制备孕14 d 雌性大鼠吸入过量二氧化碳安乐死,取出胎鼠,根据参考文献[9]构建NSCs,将脑神经组织使用胰蛋白酶37 ℃消化30 min,0.15%Ⅱ型胶原酶37 ℃、5% CO2中消化8 h 获得原代NSCs。将NSCs 在含有10%胎牛血清的DMEM 中培养成具有干细胞特性的球状聚集细胞团,加入10 μmol/L BrdU 标记48 h 备用。根据参考文献[10],取NSCs 消化后制成浓度为5×104/mL 的单细胞悬液,500 μL 细胞悬液接种在24 孔板上,每孔2.5×104个细胞。培养基中加入终浓度为200 nm 的bpV(PIC)孵育7 d。收集干细胞球,将1×106个NSCs 种植于NT⁃3 壳聚糖支架上,4 ℃孵育3 h,制备成负载bpV(PIC)⁃NSCs 的NT⁃3 壳聚糖支架。
1.4 检测指标方法
1.4.1 mNSS 评分建模后3 h 和建模7 d 后通过mNSS 评分系统是评估大鼠神经功能缺损的通用标准,包括了运动、感觉、反射和平衡测试[11]。mNSS 分数最高为18 分,分数越高,神经损伤越严重。
1.4.2 水迷宫实验[12]建模7 d 后进行。水迷宫注满水,温度控制在(25±1)℃。水池直径为1.6 m,高度为40 cm。一个平台隐藏在水面以下1 cm 处。第一阶段(定位导航):将小鼠依次靠墙放置在四象限水迷宫中,如果动物在90 s 内登上平台区域,则记录结束;如果动物在90 s 内没有登上平台区域,则用棍子将小鼠引导到平台并在那里保持30 s。每只小鼠每天训练4 次。试验之间的间隔大于2 min。第二阶段(探索):第一至第四象限全部完成,拆除水迷宫平台,将小鼠置于同一象限靠墙观察动物90 s 的动作轨迹,记录目标象限停留时间和穿越平台次数,二者数值越低提示神经功能损伤越严重。
1.4.3 HE染色大鼠吸入过量二氧化碳后安乐死,取出脑组织并在室温下用4%多聚甲醛固定6 h。用乙醇脱水(从低浓度到高浓度)后,将组织包埋在石蜡中。然后将石蜡包埋的组织切成5 μm 的切片,并将这些切片固定在载玻片上。将载玻片在室温下放入苏木精中染色10 min。用自来水洗涤1~2 min 后,将玻片置于10%冰醋酸中10 s,然后置于1%氨水中,直到切片变蓝。随后用自来水清洗1~2 min 后,将玻片放入曙红中10 s。在乙醇(浓度分别为70%、90%、95%和100%)中脱水后,将玻片置于二甲苯中2 min;重复此步骤一次。最后,用中性胶密封玻片。在倒置显微镜下观察。
1.4.4 BrdU 染色检测神经元新生新增殖的细胞会利用具有绿色红色光的BrdU 合成DNA,用4%的聚甲醛固定脑组织并用梯度醇脱水,包埋在石蜡中,制成厚度为5 μm 的组织玻片标本,根据试剂盒说明书加入100 μL 的渗透剂(PBS,0.5%TritonX⁃100),然后加入100 μL 的BrdU 染色反应液体。使用激光共聚焦显微镜观察新生的神经元。
1.5 统计学方法统计分析使用SPSS 19 软件,计量资料以均数±标准差表示,采用重复测量方差分析,多组间两两比较要采用Bonferroni 校正。P<0.05 为差异有统计学意义。
2 结果
2.1 bpV(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架对TBI 大鼠mNSS 评分的影响建模后3 h,大鼠mNSS 评分升高且高于9 分,提示TBI 建模成功。建模后7 d,TBI+NSCs 组的mNSS 评分低于TBI 组(P<0.05);TBI+bpV(PIC)⁃NSCs 组的mNSS 评分低于TBI+NSCs 组(P<0.05);TBI+bpV(PIC)⁃NSCs+NT⁃3 组的mNSS 评分低于TBI+bpV(PIC)⁃NSCs 组(P<0.05)。见表1。
表1 bpv(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架对TBI 大鼠mNSS 评分的影响Tab.1 The effect of bpv(PIC)⁃NSCs combined with NT⁃3 chitosan scaffold on the mNSS score of TBI rats ±s,分
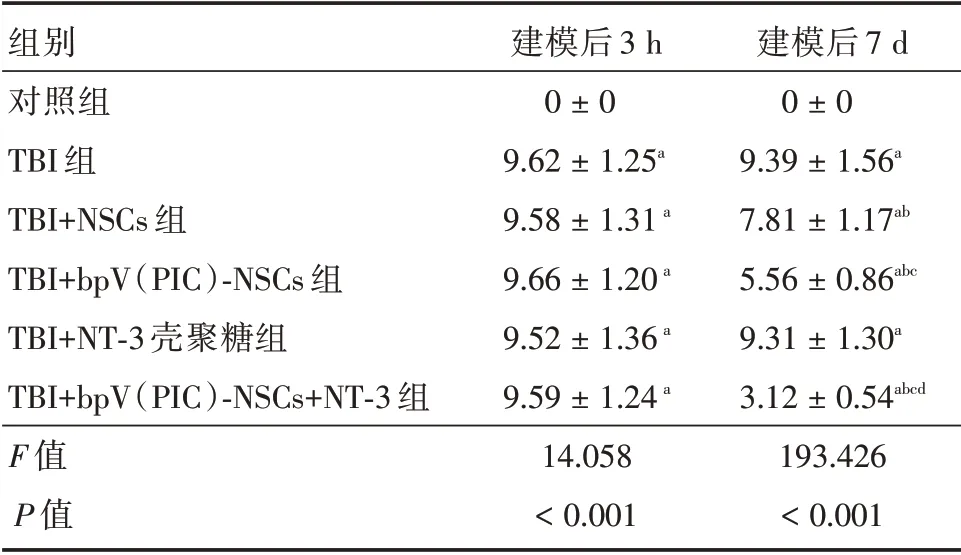
表1 bpv(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架对TBI 大鼠mNSS 评分的影响Tab.1 The effect of bpv(PIC)⁃NSCs combined with NT⁃3 chitosan scaffold on the mNSS score of TBI rats ±s,分
注:与对照组比较,aP<0.05;与TBI 组比较,bP<0.05;与TBI+NSCs组比较,cP<0.05;与TBI+TBI+NT-3壳聚糖组比较,dP<0.05
组别对照组TBI 组TBI+NSCs 组TBI+bpV(PIC)⁃NSCs 组TBI+NT⁃3 壳聚糖组TBI+bpV(PIC)⁃NSCs+NT⁃3 组F 值P 值建模后3 h 0±0 9.62±1.25a 9.58±1.31a 9.66±1.20a 9.52±1.36a 9.59±1.24a 14.058<0.001建模后7 d 0±0 9.39±1.56a 7.81±1.17ab 5.56±0.86abc 9.31±1.30a 3.12±0.54abcd 193.426<0.001
2.2 bpV(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架对TBI 大鼠神经功能的影响6 组的水迷宫实验结果比较差异有统计学意义(P<0.05)。TBI 组的神经功能水平低于对照组(P<0.05);TBI+NSCs 组的神经功能水平高于TBI 组(P<0.05);TBI+bpV(PIC)⁃NSCs 组的神经功能水平高于TBI+NSCs 组(P<0.05);TBI+bpV(PIC)⁃NSCs+NT⁃3 组的神经功能水平高于TBI+bpV(PIC)⁃NSCs组(P<0.05)。见表2。
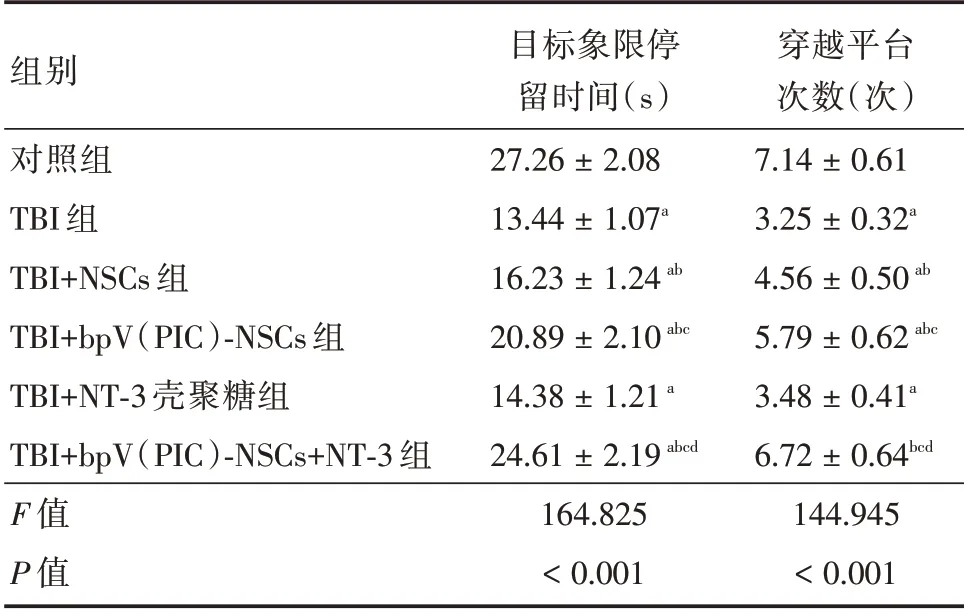
表2 bpV(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架对TBI 大鼠神经功能的影响Tab.2 Effect of bpv(PIC)⁃NSCs combined with NT⁃3 chitosan scaffold on nerve function of TBI rats x±s
2.3 bpV(PIC)⁃NSCs联合NT⁃3壳聚糖支架对TBI大鼠脑组织病理学的影响对照组神经元分布均匀,细胞核结构清晰。TBI 组的细胞核染色变深,细胞内出现空洞,出现间质性水肿。TBI+NSCs 组的损伤情况较TBI 组轻微改善。TBI+bpV(PIC)⁃NSCs 组的空洞和水肿情况显著改善。TBI+NT⁃3壳聚糖组损伤情况与TBI 组相似。TBI+bpV(PIC)⁃NSCs+NT⁃3 组基本正常,优于TBI+bpV(PIC)⁃NSCs组。见图1。
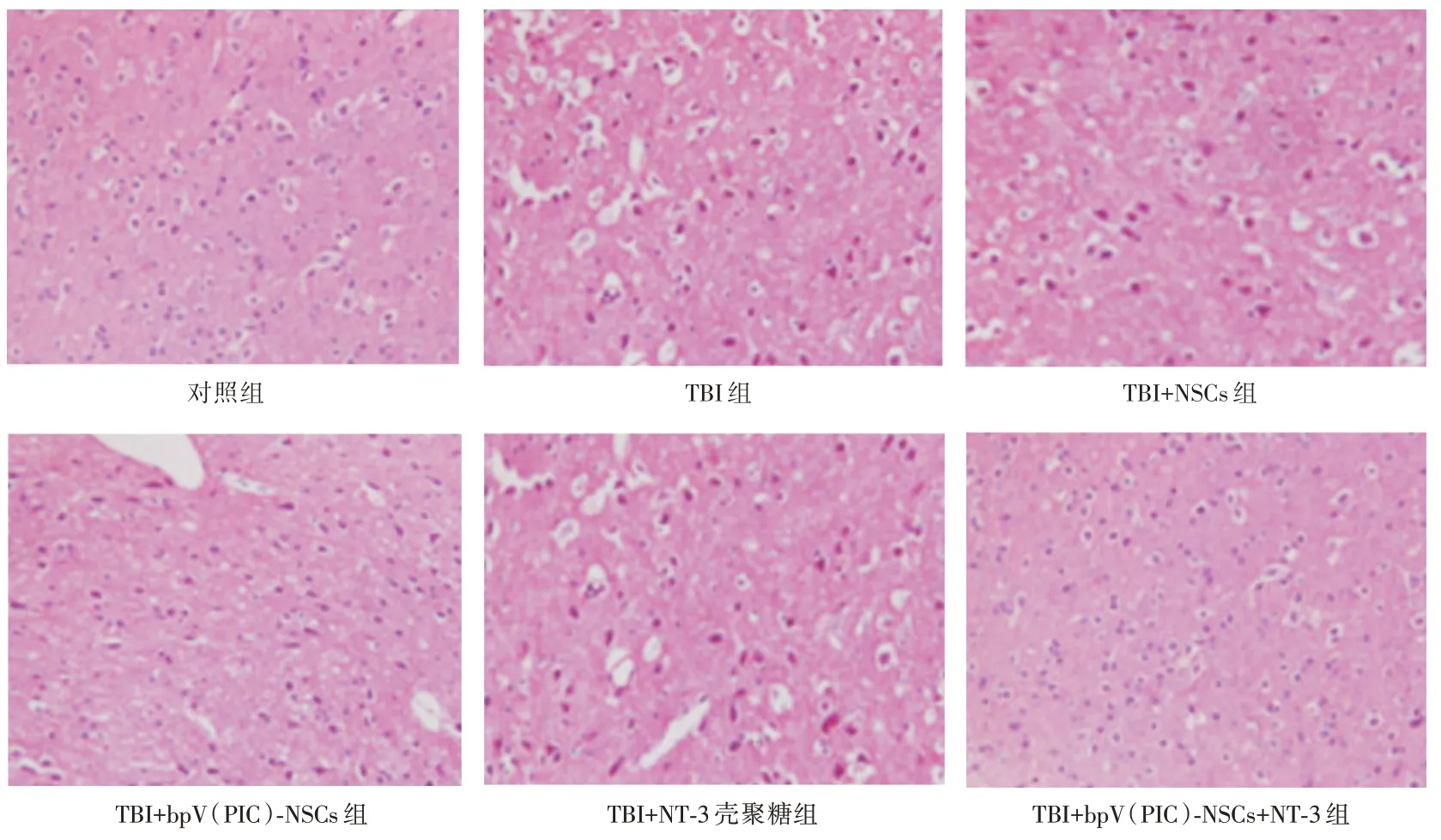
图1 HE 染色检测bpV(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架对TBI 大鼠脑组织病理学的影响(×200)Fig.1 HE staining to detect the effect of bpV(PIC)⁃NSCs combined with NT⁃3 chitosan scaffold on the pathology of brain tissue in TBI rats(×200)
2.4 bpV(PIC)⁃NSCs联合NT⁃3壳聚糖支架对TBI大鼠脑神经元新生的影响对照组正常,有少量新生神经元。TBI组新生数量较对照组略多。TBI+NSCs 组的新生神经元显著多于TBI 组;TBI+bpV(PIC)⁃NSCs 组的新生神经元显著多于TBI+NSCs组。TBI+NT⁃3 壳聚糖组的新生神经元与TBI 组类似。TBI+bpV(PIC)⁃NSCs+NT⁃3 组的新生神经元显著多于TBI+bpV(PIC)⁃NSCs 组。见图2、表3。
表3 bpv(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架对TBI 大鼠脑神经元新生的影响Tab.3 The effect of bpv(PIC)⁃NSCs combined with NT⁃3 chitosan scaffold on brain neurogenesis in TBI rats ±s

表3 bpv(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架对TBI 大鼠脑神经元新生的影响Tab.3 The effect of bpv(PIC)⁃NSCs combined with NT⁃3 chitosan scaffold on brain neurogenesis in TBI rats ±s
注:与对照组比较,aP<0.05;与TBI 组比较,bP<0.05;与TBI+NSCs组比较,cP<0.05;与TBI+TBI+NT⁃3壳聚糖组比较,dP<0.05
组别对照组TBI 组TBI+NSCs 组TBI+bpv(PIC)⁃NSCs 组TBI+NT⁃3 壳聚糖组TBI+bpv(PIC)⁃NSCs+NT⁃3 组F 值P 值新生神经元数目3.27±0.31 8.22±0.79a 17.64±1.21ab 29.38±2.25ab 8.97±1.04a 42.05±3.52abcd 957.225<0.001
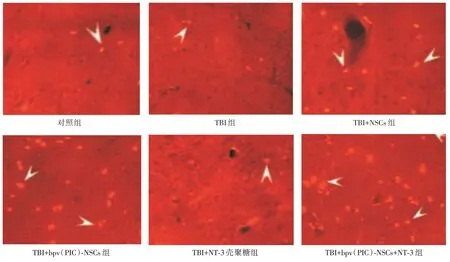
图2 BrdU 染色检测bpv(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架对TBI 大鼠脑神经元新生的影响(×400)Fig.2 BrdU staining detection of bpv(PIC)⁃NSCs combined with NT⁃3 chitosan scaffold on TBI rat brain neurons(×400)
3 讨论
TBI 后神经功能障碍已经成为意外伤害致死的首要原因[13]。研究表明,中枢神经系统自身修复困难的原因主要在于神经营养素的缺乏和胶质疤痕的空间阻隔,研究者们围绕上述理论进行了广泛的应用研究,但仍未有突破性的进展。成年人中枢神经自身内在生长能力的低下是其再生困难的主因[14-15]。
现阶段,研究已经证实提高自身内在生长能力的措施主要在于两方面,一是增加损伤局部神经再生种子细胞数量,并促使其分化为神经元,二是促进和引导轴突正确生长[16]。基于此,研究TBI后如何提高神经功能修复以改善TBI 的预后,成为当前针对TBI 研究的焦点。NSCs 具有分化成神经元等细胞的潜能,并可分泌神经营养因子促进神经元修复,研究也证实了NSCs 移植会促进损伤修复,但是由于NSCs 移植后存活率较低,所以治疗效果仍然有限[17]。PTEN 是调控神经元凋亡、增殖、更新、分化的重要蛋白,其可通过抑制PI3K/AKT 信号通路的转导影响抑制TBI 后神经元的再生[18],而抑制PTEN 则成为促进NSCs 存活和分化的重要策略。bpV(PIC)是一种特效的PTEN 抑制剂,并且研究已经证实,使用bpV(PIC)可抑制PTEN 并促进NSCs 在体内和体外增殖和分化[19]。为探索一种治疗急性脊髓损伤的新策略,本研究培养载bpV(PIC)⁃NSCs 进一步提高其移植后存活率,并进一步联合NT⁃3 壳聚糖支架移植到大鼠受损区域,探讨其对受损伤的神经修复作用,以期为该病的临床治疗提供参考。本次研究通过外科击打的方式构建TBI 模型,并在建模后立即植入NSE或者bpV(PIC)修饰的NSCs。结果显示NSCs 可促进神经元再生和缓解神经元损伤,并可提高神经功能,但是其作用有限。分析认为NSCs 移植到颅脑受损区域能够进一步分化成所需的神经细胞,实现神经回路局部重建,代偿部分受损神经细胞的功能;同时移植后的NSCs 促进多种神经营养因子分泌,改善TBI 后的局部微环境,防止进一步的继发性神经功能损害,有利于神经系统功能恢复;而bpV(PIC)修饰的NSCs 可显著的缓解神经损伤促进神经元新生,显著的促进神经功能的恢复,其作用显著优于NSCs。结合文献报道和本次研究结果,提示使用bpV(PIC)修饰抑制PTEN 后,NSCs的增殖、分化能力显著升高,从而提高对TBI 大鼠神经的修复作用。移植后的NSCs 能否长期存活是移植治疗疗效的关键因素,既往研究多通过单纯的NSCs 移植治疗TBI,但移植物的长期存活率在,有5%~30%不等,具有较高的可变性。而通过培养载有bpV(PIC)的NSCs 能够抑制PTEN 表达,有利于提高NSCs 在体内的长期存活率,进而保障更多的神经细胞增殖和分化,而分化后的NSCs 通过表达一些神经递质的受体,促进神经功能恢复。
为进一步体改NSCs 的存活提高治疗结果,本研究也利用NT⁃3 壳聚糖支架来负载NSCs。壳聚糖是一种天然生物聚合物,在结构上类似于糖胺聚糖。壳聚糖具有高度的生物相容性和可生物降解性,没有毒性作用,并具有抑菌性,是最受青睐的软骨、神经等再生生物材料之一[20],也是负载干细胞和维持干细胞存活的重要生物材料[21]。研究显示,使用NT⁃3 修饰后的壳聚糖能够为NSCs 提供营养,并促进NSCs 的存活,并在体内促进NSCs 修复神经元损伤的功能[22]。壳聚糖支架的多孔三维立体结构能够为移植的细胞提供了生长、营养代谢、分泌排泄、气体交换提供良好的场所,同时也为分化后神经细胞、新生神经组织提供了必要的结构基础,为轴突的生长提供了支架帮助神经元突起与宿主脑组织建立突触联系。本此研究结果显示,单独使用NT⁃3 壳聚糖支架对TBI 大鼠的神经功能没有明显的保护作用,但是与单独的bpV(PIC)⁃NSCs 比较,bpV(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架可更加显著的恢复神经元损伤,促进神经元再生,并恢复大鼠的神经功能。根据过往文献报道和本次研究结果,提示NT⁃3 壳聚糖支架会进一步促进bpV(PIC)⁃NSCs 对TBI 后神经功能的修复。
然而,本研究仅为定性实验,关于bpV(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架的有效性和安全性仍需要深入研究,其分子机制需要全面的、深入的分析,此外如何实现移植后更多的分化神经元还需要进一步的干预研究,关于移植bpV(PIC)⁃NSCs联合NT⁃3 壳聚糖支架后局部微环境改善相关营养因子的分泌释放需要进一步的免疫荧光标记来验证。
综上所述,联合bpV(PIC)⁃NSCs 联合NT⁃3 壳聚糖支架可显著的促进TBI 大鼠的神经修复,可能成为治疗TBI 和改善患者预后的新方法。

