撤机后序贯经鼻高流量湿化氧疗对肺癌根治术后呼吸衰竭患者的影响*
李洋,刘雷,李阔,赵明理
[1.湖北文理学院附属医院(襄阳市中心医院)急诊科,湖北 襄阳441021;2.河南中医药大学第一附属医院 胸外科,河南 郑州450046;3.华中科技大学同济医学院附属协和医院胸外科,湖北 武汉430022]
肺癌是临床最为常见的恶性肿瘤之一,多发于中老年男性群体,病因主要与吸烟、职业暴露、空气污染、饮食等因素有关,发病率、病死率较高[1]。近年来我国肺癌的发病率呈逐年上升趋势,有研究预测未来30年,将有1 800 万患者死于肺癌[2]。肺癌晚期患者的呼吸肌疲劳、排痰能力逐渐减弱,极易合并呼吸衰竭。氧疗是临床纠正呼吸衰竭的常用治疗方法,传统机械通气、面罩吸氧均为临床较常选用的氧疗方式,均可在一定程度上改善呼吸,但传统机械通气发生误吸、呼吸机相关性肺炎等不良反应的风险较高,且患者舒适感较差,面罩吸氧则不利于咳痰、进食[3-4]。经鼻高流量湿化氧疗是一种新型氧疗方式,不仅可快速缓解低血氧,还可通过给予高流量气体湿化气道,促使痰液排出,且相较于传统机械通气,其在舒适度、创伤性等方面具有明显优势[5]。已有研究表明,经鼻高流量湿化氧疗对急性呼吸衰竭患者的治疗效果较好[6],但对肺癌根治术后呼吸衰竭患者的应用较少。基于此,本研究将肺癌根治术后呼吸衰竭患者分组治疗,探讨经鼻高流量湿化氧疗对肺癌根治术后呼吸衰竭患者的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年7月—2021年6月湖北文理学院附属医院(襄阳市中心医院)肺癌根治术后呼吸衰竭患者120 例,根据术后氧疗方式不同分为干预组和对照组,每组60 例。对照组男性38 例,女性22 例;年龄37~72 岁,平均(51.63±4.32)岁;病程2~6年,平均(3.45±0.67)年。干预组男性37 例,女性23 例;年龄36~72 岁,平均(51.01±4.44)岁;病程2~6年,平均(3.51±0.63)年。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:符合《中国原发性肺癌诊疗规范(2015年版)》[7]中肺癌诊断标准,且接受肺癌根治术治疗者;合并Ⅱ型呼吸衰竭(PaO2<60 mmHg,伴有PaCO2>50 mmHg);经自主呼吸试验符合撤机指征者;患者自愿并签署知情同意书。排除标准:肺癌术后严重并发症者;拔管后再插管者;合并血液系统、免疫系统严重功能障碍者;神志不清或有精神疾病者;合并肝肾等其他器官恶性肿瘤者;合并肺结核等其他严重肺部疾病者。本研究经医院医学伦理委员会批准(批准号:201706)。
1.2 方法
1.2.1 治疗方法 两组患者均接受肺癌根治术。对照组术后气管插管撤机后常规面罩吸氧,控制氧体积分数(FiO2),使血氧饱和度(SaO2)>90%,呼吸频率(RR)<28 次/min。干预组术后气管插管撤机后序贯经鼻高流量湿化氧疗,采用HUMID-BHR 高流量呼吸湿化治疗仪(沈阳迈思医疗科技有限公司),呼吸参数:氧流量50 L/min,浓度30%~40%,温度37℃,SaO2>90%。两组患者均治疗两周。
1.2.2 呼吸力学指标检测 采用迈科肺功能仪(上海涵飞医疗器械有限公司)测定两组患者治疗前、治疗后14 d的RR、气道阻力(Raw)、平均气道压(Pm)。
1.2.3 血气指标检测 采用ABL9 血气分析仪(北京赛百奥科技有限公司)测定两组患者治疗前、治疗后14 d 的SaO2、氧合指数(PaO2/FiO2)、氧输送(DO2)。
1.2.4 血清学指标检测 于治疗前、治疗后14 d采集两组患者的空腹静脉血3 mL,3 000 r/min 离心5 min,取上清液待测。采用电化学发光免疫测定夹心法检测内皮素-1(ET-1)水平和中性粒细胞与淋巴细胞比值(NLR),采用酶联免疫吸附试验检测缺氧诱导因子1α(HIF-1α)和白细胞介素-6(IL-6)水平。
1.2.5 舒适度、气道湿化及急性生理学和慢性健康状况评价Ⅱ(APACHE Ⅱ) 舒适度、气道湿化均采用1~5 分五级评分法[8]。舒适度评分标准:舒适为1 分,稍舒适为2 分,不舒适但可耐受为3 分,不舒适且难以耐受为4 分,不舒适且需要药物辅助为5 分。气道湿化评分标准:可容易咳痰为1 分,痰液较难咳出为2 分,不易排痰且需辅助为3 分,不易排痰且需停机辅助为4 分,无法使用仪器排痰为5 分。APACHE Ⅱ包括急性生理学评分、年龄、慢性健康状况评价3 部分。急性生理学评分包括体温、平均动脉压、心率、RR、动脉血氧分压、pH 值、血清中钠和钾的浓度、肌酐浓度、血细胞比容、白细胞计数及格拉斯哥昏迷量表等12 项参数,每项为0~4 分,各项参数均为入组后第一个24 h 内的最差值;年龄分值0~6 分;慢性健康状况评价0~5 分;总分为0~71分。分值越高,预后越差,病死率越高。
1.2.6 不良反应 比较两组患者误吸、胃肠胀气、不耐受、气道损伤的总发生率。
1.3 统计学方法
数据分析采用SPSS 24.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验,计数资料用率表示,比较用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组呼吸力学指标比较
两组患者治疗前RR、Raw、Pm 比较,经t检验,差异无统计学意义(P>0.05);两组患者治疗后14 d的RR、Raw、Pm 比较,经t检验,差异有统计学意义(P<0.05),干预组均低于对照组。见表1。
表1 两组患者呼吸力学指标比较 (n=60,±s)

表1 两组患者呼吸力学指标比较 (n=60,±s)
组别对照组RR/(次/min)治疗前32.15±3.27治疗后14 d 26.37±2.59 Raw/[cmH2O/(L·s)]治疗前17.91±4.28治疗后14 d 12.26±3.69 Pm/cmH2O治疗前15.20±2.49治疗后14 d 10.37±2.22干预组t 值P 值32.08±3.34 0.116 0.908 24.46±2.44 4.158 0.000 18.06±4.19 0.194 0.847 10.52±3.21 2.756 0.007 15.36±2.53 0.349 0.728 9.12±1.95 3.277 0.001
2.2 两组血气指标比较
两组患者治疗前SaO2、DO2及氧合指数比较,经t检验,差异无统计学意义(P>0.05);两组患者治疗后14 d 的SaO2、DO2及氧合指数比较,经t检验,差异有统计学意义(P<0.05),干预组高于对照组。见表2。
表2 两组患者血气指标比较 (n=60,±s)

表2 两组患者血气指标比较 (n=60,±s)
组别对照组SaO2/%治疗前82.48±8.47治疗后14 d 90.64±8.17 DO2/[mL/(min·m2)]治疗前385.84±38.01治疗后14 d 470.11±48.64氧合指数治疗前152.84±19.17治疗后14 d 279.30±47.66干预组t 值P 值83.07±8.62 0.378 0.706 94.18±8.35 2.347 0.021 387.15±39.16 0.186 0.853 492.41±50.19 2.471 0.015 150.38±20.37 0.681 0.497 315.47±52.44 3.954 0.000
2.3 两组血清学指标比较
两组患者治疗前血清HIF-1α、IL-6、ET-1 水平及NLR 比较,经t检验,差异无统计学意义(P>0.05);两组治疗后14 d 的血清HIF-1α、IL-6、ET-1水平及NLR 比较,经t检验,差异有统计学意义(P< 0.05),干预组均低于对照组。见表3。
表3 两组患者血清学指标比较 (n=60,±s)

表3 两组患者血清学指标比较 (n=60,±s)
组别对照组HIF-1α/(ng/L)治疗前70.02±7.33治疗后14 d 47.41±6.06 IL-6/(ng/L)治疗前8.62±1.26治疗后14 d 6.22±0.99 ET-1/(ng/L)治疗前79.34±11.25治疗后14 d 56.80±10.14 NLR/%治疗前6.52±1.52治疗后14 d 2.66±0.91干预组t 值P 值69.80±7.26 0.165 0.869 43.88±5.89 3.236 0.002 8.55±1.21 0.310 0.757 5.77±0.86 2.658 0.009 78.73±11.06 0.300 0.765 48.48±8.57 4.854 0.000 6.47±1.60 0.175 0.861 2.14±0.79 3.342 0.001
2.4 两组舒适度、气道湿化及APACHEⅡ评分比较
两组患者治疗前舒适度、气道湿化及APACHEⅡ评分比较,经t检验,差异无统计学意义(P>0.05);两组患者治疗后14 d 的舒适度、气道湿化及APACHEⅡ评分比较,经t检验,差异有统计学意义(P<0.05),干预组均低于对照组。见表4。
表4 两组患者舒适度、气道湿化及APACHEⅡ评分比较 (n=60,±s)

表4 两组患者舒适度、气道湿化及APACHEⅡ评分比较 (n=60,±s)
组别对照组舒适度治疗前3.81±0.62治疗后14 d 2.88±0.57气道湿化治疗前3.96±1.01治疗后14 d 2.51±0.86 APACH治疗前27.92±5.15干预组t 值P 值3.85±0.60 0.359 0.720 1.97±0.49 9.378 0.000 4.05±0.95 0.503 0.616 2.06±0.63 3.270 0.001 28.10±5.09 0.193 0.847E Ⅱ评分治疗后14 d 22.12±4.03 18.45±3.59 5.267 0.000
2.5 两组不良反应比较
两组患者不良反应总发生率比较,经χ2检验,差异有统计学意义(χ2= 4.227,P=0.040),干预组低于对照组。见表5。
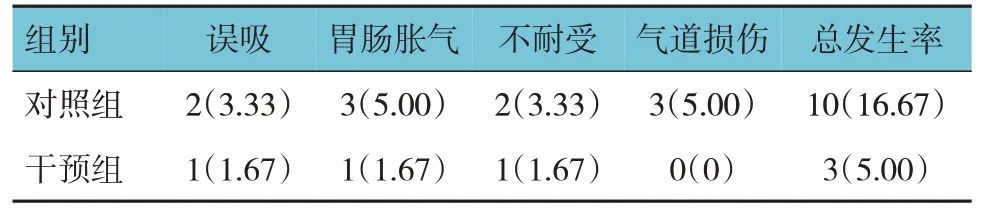
表5 两组患者不良反应发生情况比较 例(%)
3 讨论
近年来随着诊断技术、外科手术技术的不断发展,肺癌早期患者接受肺癌根治术可使病情明显缓解,生存时间大大延长,但手术创伤、应激反应、麻醉等均可对患者术后肺功能产生影响,导致呼吸衰竭。已有研究证实,术后气管插管撤机后氧疗有助于肺功能的改善,且不同氧疗方式的效果不一[9]。因此,肺癌术后呼吸衰竭患者氧疗方式的选择具有重要意义。
经鼻高流量湿化氧疗改良于经鼻导管吸氧,增加了加温湿化、流量控制等功能。经鼻高流量湿化氧疗通过流量传感器、空氧混合装置精准控制氧气输送的浓度、流速、流量,与患者呼吸相匹配,并可将高于患者自身吸气峰流量的氧气输送给患者,降低空气带入量,将氧浓度维持在较高水平[10]。本研究结果显示,治疗后干预组SaO2、DO2水平及氧合指数均比对照组高,治疗后干预组舒适度、气道湿化及APACHEⅡ评分均比对照组低,提示经鼻高流量湿化氧疗可有效改善肺癌术后呼吸衰竭患者血气指标,降低APACHEⅡ评分,且较为舒适。其原因在于,经鼻高流量湿化氧疗给予的气体经过湿化和加温处理,可有效降低痰液浓度,促进黏液的分泌,维持纤毛黏液系统,促使痰液排出,进而改善呼吸和氧合情况,提高肺顺应性,而肺功能得到改善,血气指标自然有所提升[11]。经鼻高流量湿化氧疗的湿化效果可进一步提高肺顺应性,降低气道分泌物的黏度,减少气流阻力,增强气道传导性,并可在一定程度上减少机体热量流失,降低支气管痉挛风险[12]。本研究结果显示,干预组治疗后RR、Raw、Pm 均低于对照组,提示经鼻高流量湿化氧疗可有效改善肺癌根治术后呼吸衰竭患者的呼吸力学指标。其原因在于,经鼻高流量湿化氧疗可精准控制气体流速、流量,达到持续性气道正压通气状态,产生气道正压,降低气道阻力及压力,并以高流量湿化气流冲洗气道,降低呼吸消耗,进而降低呼吸频率,改善呼吸功能[13]。
呼吸衰竭的发生、进展与炎症反应具有密切联系,炎症反应可促使IL-6、IL-17 等炎症因子大量释放,对肺组织造成损伤,甚至改变其构造[14]。NLR 是冠心病、脑梗死、恶性肿瘤等疾病的独立预测因子,慢性阻塞性肺疾病炎症反应可促使淋巴细胞凋亡,增加中性粒细胞数量,提高NLR。ET-1是一种缩血管物质,主要在肺部发挥作用,在呼吸系统疾病的发生、进展中起重要作用;同时,ET-1 也是一种炎症因子,可反映血管内皮细胞功能,收缩支气管平滑肌,增强气道黏膜毛细血管的通透性,促使气道高反应性,对气道组织造成损伤。有研究[15]指出,在慢性阻塞性肺疾病进展过程中,机体长时间缺氧,受到血管内活性物质的刺激,ET-1 水平上升,促进肺部血管收缩和肺血管重构。HIF-1α 是一种调节因子,可对细胞氧内环境修复起到诱导作用,在呼吸衰竭等呼吸系统疾病的进展过程中可促使机体长期处于慢性炎症状态,并产生缺氧症状,常作为急性加重期慢性阻塞性肺疾病病情的评估指标[16-17]。本研究结果显示,治疗后干预组血清HIF-1α、IL-6、ET-1、NLR 均比对照组低,提示经鼻高流量湿化氧疗可有效降低肺癌根治术后呼吸衰竭患者机体的炎症反应。低温环境可加重细胞炎症反应,而经鼻高流量湿化氧疗可加温气体至37℃,从而在一定程度上降低炎症反应[18]。本研究结果显示,干预组不良反应发生率低于对照组,提示经鼻高流量湿化氧疗较为安全,其原因在于,经鼻高流量湿化氧疗有助于肺内痰液的排出,且高流量通气的气道可产生呼气末正压效应,降低误吸的风险[19]。而加温湿化气体可湿润气道,避免高流量通气造成的气道干燥、损伤[20]。
综上所述,经鼻高流量湿化氧疗可有效改善肺癌根治术后呼吸衰竭患者的呼吸力学指标、血气指标、血清学指标及APACHEⅡ评分,降低炎症反应,患者舒适度较好,不良反应较少。

