氯化钙注射液灭菌工艺变更研究
王 焕
(上海信谊金朱药业有限公司,上海 201506)
0 引言
无菌是注射剂的关键质量参数之一,灭菌工艺是影响产品质量、保证患者安全的关键生产工艺步骤之一。《关于开展仿制药质量和疗效一致性评价的意见》以及《化学药品注射剂仿制药质量和疗效一致性评价技术要求》[1-2]等文件指出,对于不进行一致性评价的品种,需要对原工艺进行评估,必要时进行质量提升研究,尤其灭菌工艺、滤器与包材选择(含相容性研究)等需满足相关技术指导原则和法规要求。氯化钙为无机盐类注射液,处方亦无其他对温度敏感的辅料,所用包材为耐热性能良好的中硼硅玻璃安瓿。参考CDE发布的《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》[3]中注射剂灭菌工艺选择的决策树,氯化钙注射液应采用过度杀灭法生产,更有利于产品的无菌保障水平的控制。
本文中,氯化钙注射液原灭菌工艺为除菌过滤工艺,计划变更为终端灭菌工艺,以提升产品的无菌保障水平。除菌过滤工艺变更为终端灭菌工艺是企业常见灭菌工艺变更的一种[4],虽然对产品的无菌水平控制能力提升,但灭菌工艺的改变仍会对产品的质量产生较大影响,如药液的性状、含量、有关物质等,需要进行全面、科学的研究和验证工作。
本文以氯化钙注射液的除菌过滤变更为终端灭菌工艺(见图1)为例,简要讨论灭菌工艺变更研究工作内容。
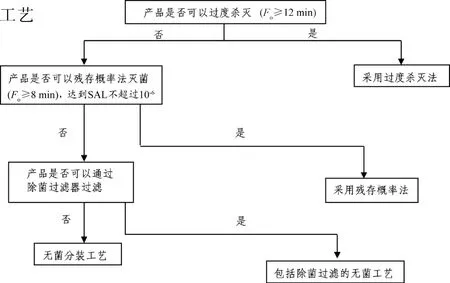
图1 注射剂灭菌工艺决策树
1 研究过程
1.1 灭菌工艺筛选
参考注射剂灭菌工艺决策树,初步设定采用终端灭菌工艺进行考查。在此基础上设定5个灭菌条件:121 ℃×8 min,121 ℃×12 min,121 ℃×15 min,121 ℃×30 min,115 ℃×40 min,以含量、性状、pH、颜色为考查指标,初步考查终端灭菌工艺参数。
结果(见表1)显示:通过对5个灭菌条件的考查,未发现灭菌条件对产品有明显影响,各样品含量均符合质量标准(95%~105%);灭菌后样品的pH升高,但均符合质量标准。上述结果表明,5个灭菌条件均满足终端灭菌需求,结合各个灭菌条件的无菌保障能力,初步选择121 ℃×15 min作为终端灭菌条件。
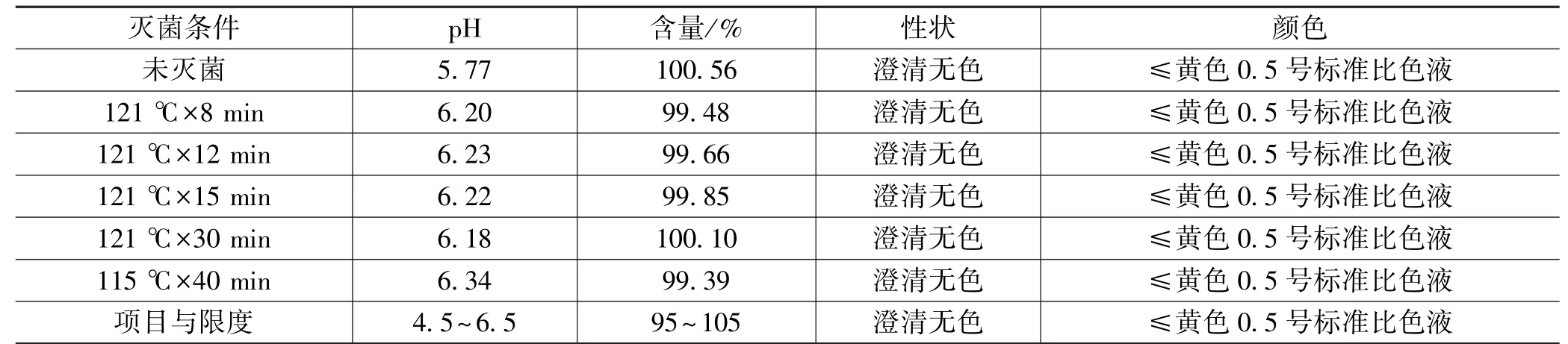
表1 灭菌条件考查结果
1.2 灭菌工艺验证
结合工艺筛选确定的终端灭菌工艺参数,进行工艺验证研究。氯化钙注射液的灭菌工艺验证主要在ASMD-2.5机动门水浴灭菌柜(山东新华医疗器械股份有限公司,设备编号12012911,12012922)上进行,灭菌参数为121 ℃×15 min。在20 mL规格中,连续灭菌3批样品(批号:2010601-4,2010701-4,2010702-4);在10 mL规格中,连续灭菌3批样品(批号:2110201-4,2110202-4,2110203-4)。
氯化钙注射液(20 mL)验证批量为90万毫升/批,理论生产支数约200盘产品,实际由于管路损耗及大量取样,可能减少到180盘左右。灭菌柜装载时分为两个笼吊(见表2),每个笼吊每层装8盘,故一层为16盘,20 mL产品最多放置7层(其中第7层由于笼吊中间有横梁影响放置位置,只能放置12盘)共计108盘,故需要分两次灭菌。第1次灭菌为氯化钙注射液(20 mL)满载,第2次灭菌为保证灭菌效果一致,采用填充物(灌装有胭脂红溶液的20 mL安瓿瓶)填充至满载。

表2 热穿透试验样品装载方式(20 mL)
氯化钙注射液(10 mL)验证批量为82万毫升/批,理论生产支数约256盘产品(约305支/盘),实际由于管路损耗及大量取样,可能减少到220盘左右;另一方面,II号灭菌器为2个笼吊放样(见表3),每个笼吊每层装8盘,故一层为16盘,8层共计128盘。故每批10 mL产品(约220盘)无法在灭菌柜中一次全部装样灭菌,因此采用分2次灭菌的形式。第1次灭菌时全部采用氯化钙注射液(10 mL∶0.5 g)进行满载,剩余样品在第2次灭菌时以胭脂红溶液为填充物,填补空余盘,保证达到满载形式。
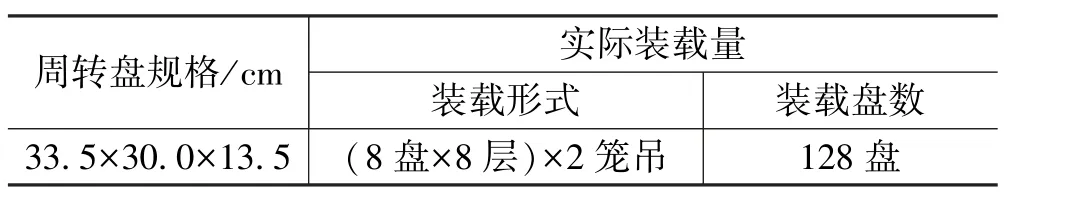
表3 热穿透试验样品装载方式(10 mL)
1.3 探头评估
氯化钙注射液(20 mL)进行灭菌时,探头位置设置见表4,探头摆放位置示意图见图2和图3。
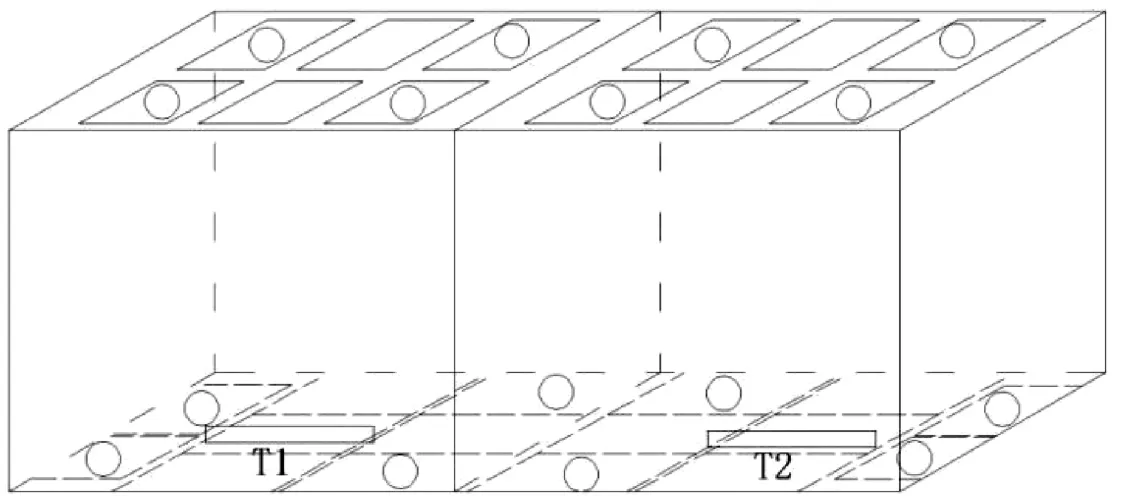
图2 探头摆放位置立体示意图(20 mL)
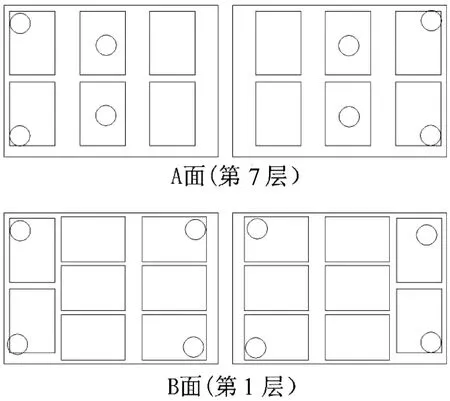
图3 探头摆放位置平面示意图(20 mL)
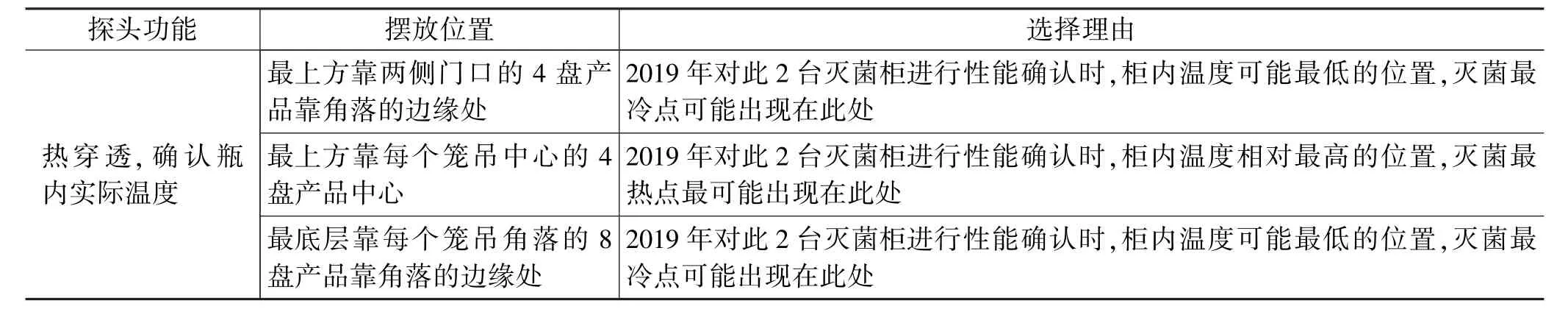
表4 探头位置评估(20 mL)
由于灭菌柜结构特点和样品的摆放情况,氯化钙注射液(20 mL)在灭菌时温度探头分布设置不充分,未考虑到每个笼吊中间位置的温度监控。因此,在氯化钙注射液(10 mL)的灭菌工艺验证中重新设计温度探头分布,探头位置设置见表5,探头摆放位置示意图见图4和图5。

图4 探头摆放位置立体示意图(10 mL)
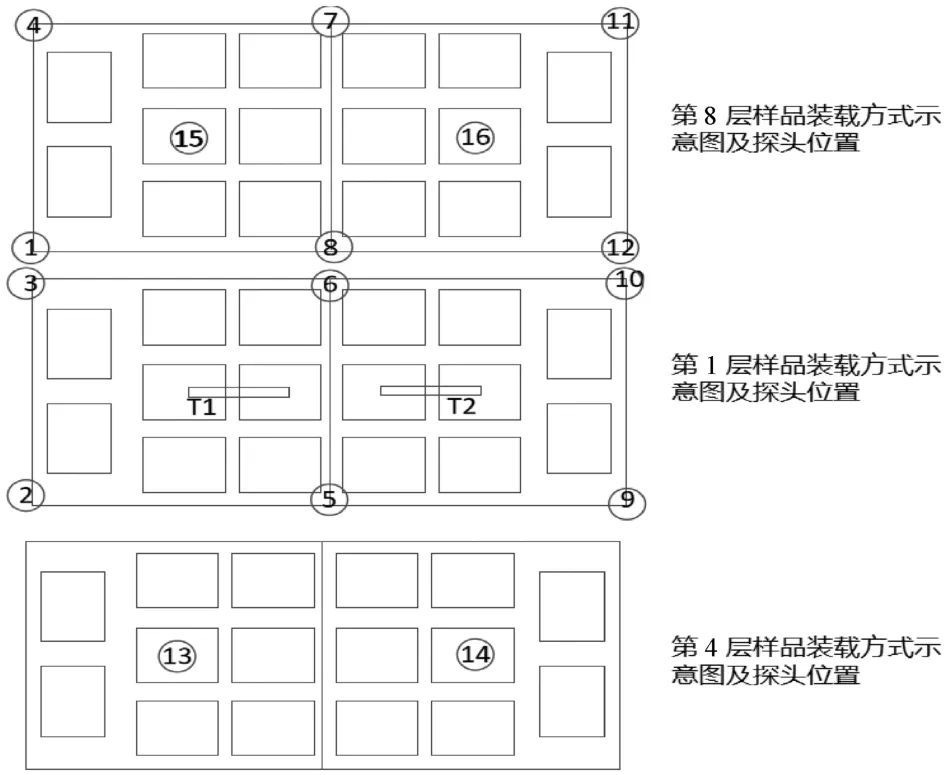
图5 探头摆放位置平面示意图(10 mL)

表5 探头位置评估(10 mL∶0.5 g)
1.4 热穿透试验
依据上述样品装载方式进行氯化钙注射液样品装载,装载产品后,将部分探头用电工胶带固定,将固定好探头的产品放置在相应位置,进行121 ℃×15 min程序灭菌,同步收集温度巡检探头数据。
1.5 生物指示剂挑战实验
在研究过程中,生物指示剂挑战实验与热穿透试验同时进行,生物指示剂摆放于温度探头附近。将生物指示剂与放置有探头的产品绑在一起灭菌,灭菌后取出,经56 ℃培养48 h;同时,培养一个相同批号的未灭菌生物指示剂,进行空白比对。
检测所用生物指示剂为3M压力蒸汽灭菌生物培养指示剂,由美国3M公司生产,指示剂孢子量为2.9×105cfu/支。根据生物指示剂说明书,以56 ℃下培养48 h后的结果为参考标准:培养后,指示管不变色,表示灭菌通过;指示管变色,表示灭菌不通过。
2 研究结果
2.1 热穿透实验结果
根据数据计算各探头F0值,两规格产品的热穿透试验结果如下。
氯化钙注射液(20 mL):从表6的结果评估,氯化钙注射液(20 mL∶1 g)的灭菌工艺验证中,II号灭菌器(设备编号:12012922)灭菌阶段121 ℃×15 min的灭菌F0值最低为18.98,符合最低F0值>12的验证要求;I号灭菌器在灭菌阶段F0值最低为17.99,符合最低F0值>12的验证要求。
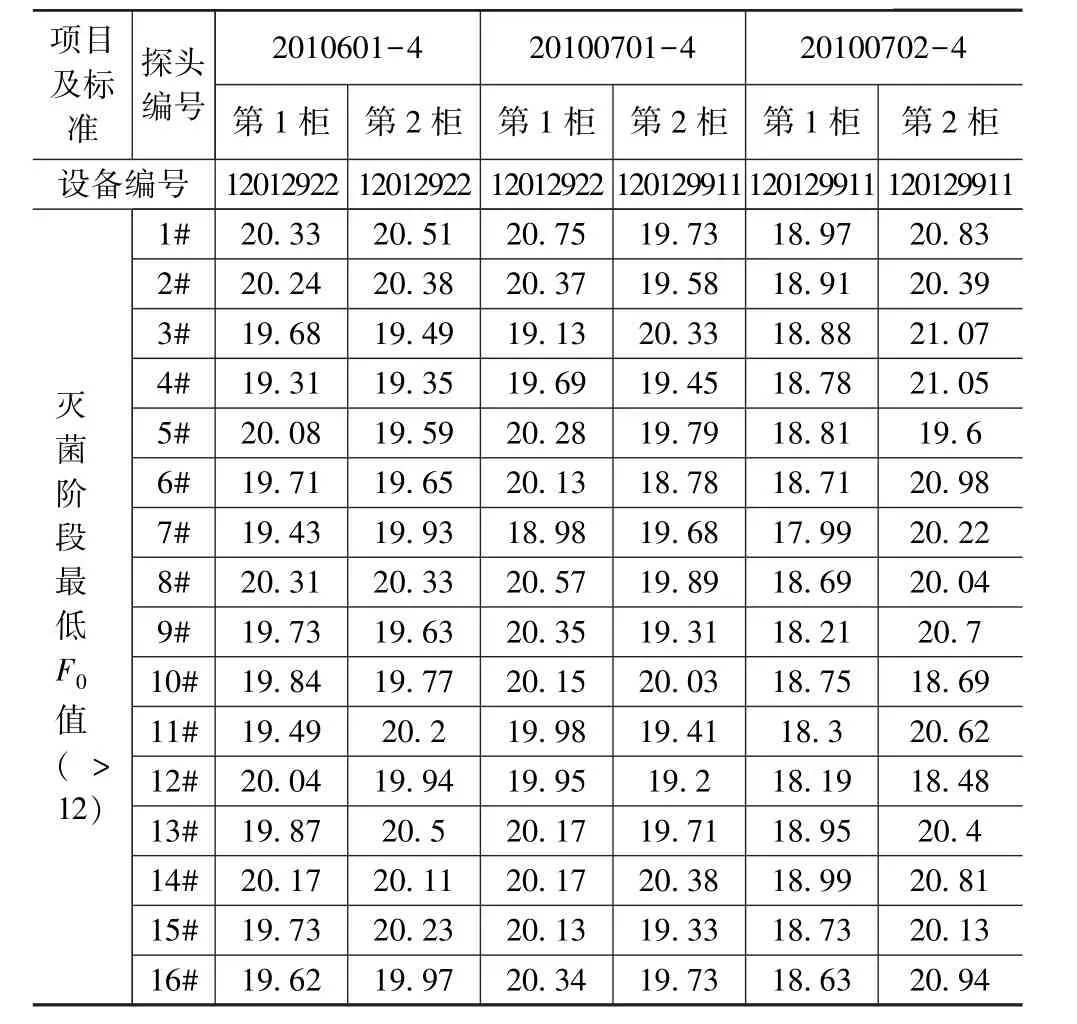
表6 热穿透试验结果(20 mL)
氯化钙注射液(10 mL):从表7的结果评估发现,氯化钙注射液(10 mL)的灭菌工艺验证中,II号灭菌器(设备编号:12012922)在灭菌阶段F0值最低为18.86,符合最低F0值>12的验证要求。
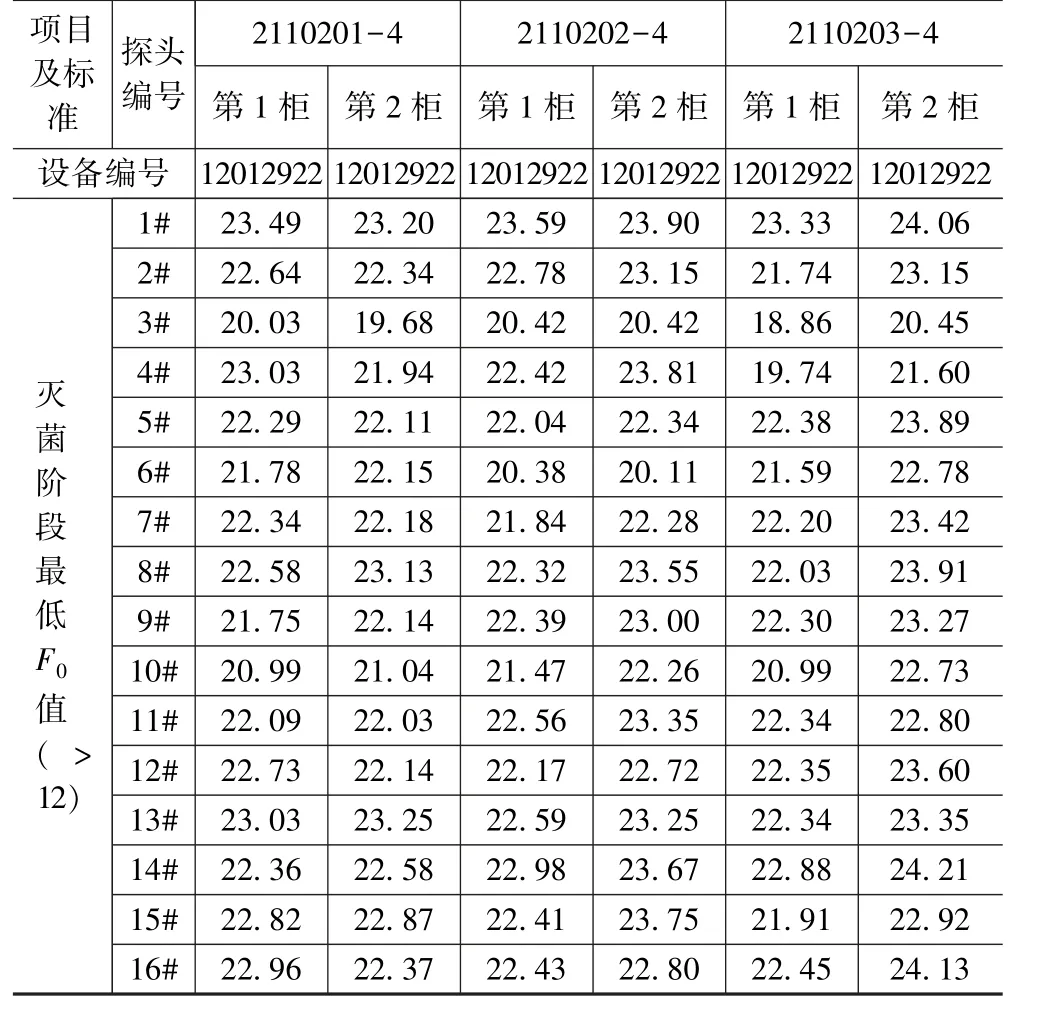
表7 热穿透试验结果(10 mL∶0.5 g)
2.2 生物指示剂挑战试验结果
结果显示,在两种规格的氯化钙注射液随验证批生产进行每次生物挑战试验时,在121 ℃×15 min灭菌条件下连续进行6次,同时每次送检进行培养时,均取用一支同批号生物指示剂进行空白对照培养,试验结果为阳性对照生物指示剂培养后均呈阳性,随产品灭菌的生物指示剂均呈阴性,符合验证标准,说明灭菌后产品能够保证无菌要求,检测结果见表8和表9。
表8 生物挑战试验结果(20 mL)
表9 生物挑战试验结果(10 mL)
2.3 灭菌工艺验证总结
通过两种规格的氯化钙注射液的灭菌工艺验证,Ⅱ号灭菌器(编号:12012922)在121 ℃×15 min终端灭菌条件下,设备运行、性能均符合验证设定标准,并且各项验证指标经过至少3次连续确认,证明该设备在本次拟定的终端灭菌条件下,装载量在108盘的情况下运行及性能合格稳定,可用于最终灭菌氯化钙注射液(20 mL∶1 g)的生产。使用Ⅰ号灭菌器(编号:12012911)对氯化钙注射液(20 mL∶1 g)进行终端灭菌时,最终灭菌结果合格,同样可用于产品生产。
3 结语
注射剂的灭菌步骤是影响药品质量、保证患者安全的关键工艺步骤之一。在灭菌工艺变更的研究工作中,需结合药物的理化特性,参考相关技术指导原则选择合适的灭菌工艺。在灭菌工艺选择中重点考虑被灭菌产品无菌保证水平以及药物的热稳定性,只要条件允许应首选过度杀灭法,该灭菌工艺的无菌保证水平高,但对工艺控制要求相对较低,只要严格遵循GMP的要求生产,即可确保产品的无菌水平符合要求[5-7]。
在灭菌工艺变更研究工作中[8-10],空载热分布实验、装载热分布实验、热穿透试验和生物指示剂挑战实验是重点考虑的几个研究工作。空载热分布主要目的是评估设备腔室的温度分布均匀性,测定腔室内不同位置的温差状况,确定可能存在的冷点、次冷点和热点、次热点的位置。装载热分布是在空载热分布试验的基础上,充分考虑最大、最小和生产过程中典型装载量情况,考查和评估在装载样品的条件下灭菌柜腔室内的温度分布均匀性,为后续验证、生产打下基础。在本次灭菌工艺验证过程中,在参考前期灭菌器的性能确认数据以及氯化钙注射液原灭菌装载方式的基础上,评估拟定的本次灭菌验证中的探头设计,不再进行额外的空载热分布和满载热分布验证,重点进行热穿透试验和生物指示剂挑战试验,以评估变更后的灭菌工艺。
然而,在本次研究工作中,由于忽略灭菌柜结构特点和氯化钙注射液(20 mL)样品的摆放情况,导致在灭菌时温度探头分布设置不充分,未考虑到每个笼吊中间位置的温度监控。因此,在氯化钙注射液(10 mL)的灭菌工艺验证中重新设计温度探头分布,补充了对中间位置的探头分布考查,并结合验证结果进一步证明了灭菌工艺的合理性。

