TCH新辅助化疗对HER2阳性早期乳腺癌患者的疗效及血清LCN-2水平表达的影响
毛琳
【摘要】 目的:研究TCH新輔助化疗对人表皮生长因子受体2(HER2)阳性早期乳腺癌患者的疗效及血清脂质运载蛋白-2(LCN-2)水平表达的影响。方法:将2017年5月-2020年3月铁岭市中心医院收治的93例HER2阳性早期乳腺癌患者纳入研究。采用电脑随机数字表法将其分为研究组46例和常规组47例。常规组开展TAC新辅助化疗,研究组则开展TCH新辅助化疗。分析两组疗效、不良反应发生情况,比较两组化疗前后血清LCN-2、转化生长因子-β1(TGF-β1)、血管内皮生长因子(VEGF)水平变化情况。结果:研究组总有效率高于常规组(P<0.05)。研究组化疗1、3、6个疗程后的血清LCN-2水平均低于常规组(P<0.05)。化疗6个疗程后,研究组血清TGF-β1、VEGF水平均低于常规组(P<0.05)。研究组不良反应发生率低于常规组(P<0.05)。结论:TCH新辅助化疗应用于HER2阳性早期乳腺癌患者的治疗中可获得较为理想的效果,同时可降低血清LCN-2、TGF-β1、VEGF水平,减少不良反应的发生,具有较好的安全性。
【关键词】 乳腺癌 人表皮生长因子受体2 TCH新辅助化疗 脂质运载蛋白-2
Efficacy of TCH Neoadjuvant Chemotherapy on Early Breast Cancer Patients with Positive HER2 and Its Effect on Serum LCN-2 Level Expression/MAO Lin. //Medical Innovation of China, 2022, 19(06): 0-018
[Abstract] Objective: To study the efficacy of TCH neoadjuvant chemotherapy on human epidermal growth factor receptor 2 (HER2) positive early breast cancer patients and its effect on serum lipid carrier protein -2 (LCN-2) level expression. Method: A total of 93 patients with early breast cancer with positive HER2 who were admitted to Tieling Central Hospital from May 2017 to March 2020 were included in this study. They were divided into study group (n=46) and conventional group (n=47) by computer random number table method. TAC neoadjuvant chemotherapy was performed in the conventional group, and TCH neoadjuvant chemotherapy was performed in the study group. The efficacy and incidence of adverse reactions in the two groups were analyzed, and the levels of serum LCN-2, transforming growth factor-β1 (TGF-β1) and vascular endothelial growth factor (VEGF) were compared between the two groups before and after chemotherapy. Result: The total effective rate of study group was higher than that of conventional group (P<0.05). The serum LCN-2 levels in the study group were lower than those in the conventional group after 1, 3 and 6 courses of chemotherapy (P<0.05). After 6 courses of chemotherapy, the levels of serum TGF-β1 and VEGF in the study group were lower than those in the conventional group (P<0.05). The incidence of adverse reactions in the study group was lower than that in the conventional group (P<0.05). Conclusion: TCH neoadjuvant chemotherapy can achieve ideal effects in the treatment of early breast cancer patients with positive HER2, and can reduce serum LCN-2, TGF-β1 and VEGF levels, thus reducing the occurrence of adverse reactions and showing good safety.
[Key words] Breast cancer Human epidermal growth factor receptor 2 TCH neoadjuvant chemotherapy
Lipid carrier protein-2
First-author’s address: Tieling Central Hospital, Liaoning Province, Tieling 112000, China
doi:10.3969/j.issn.1674-4985.2022.06.004
乳腺癌属于临床上较为常见的女性生殖系统恶性肿瘤之一,当前乳腺癌的发病率正呈逐年攀升趋势,且国内的发病率高出发达国家2%左右,是全球范围内乳腺癌发病率增长率最快的国家之一,严重威胁女性生命健康安全[1-2]。相关研究数据显示,临床上约有30%的乳腺癌患者人表皮生长因子受体2(HER2)阳性,该类患者恶性程度较高,侵袭性较强,临床治疗难度较大,预后普遍不良[3]。化疗是目前临床上公认的治疗HER2阳性乳腺癌有效方案,其中TCH新辅助化疗在该病中的治疗效果逐渐得到医务人员的认可[4]。此外,脂质运载蛋白-2(LCN-2)是一种肿瘤标志物,于多种肿瘤中均存在异常高表达,且参与了和HER2阳性乳腺癌的发生、发展过程[5]。鉴于此,本文通过研究TCH新辅助化疗对HER2阳性早期乳腺癌患者的疗效及血清LCN-2水平表达的影响,旨在为该化疗方案应用于HER2阳性早期乳腺癌患者的治疗提供理论依据,现报道如下。
1 资料与方法
1.1 一般资料 将2017年5月-2020年3月铁岭市中心醫院收治的93例HER2阳性早期乳腺癌患者纳入研究。采用电脑随机数字表法将其分为研究组46例和常规组47例。纳入标准:(1)所有受试者均与《外科学(第8版)》中所制订的HER2阳性早期乳腺癌诊断标准相符[6];(2)均经病理检查确诊;(3)既往未接受过新辅助化疗;(4)TNM分期为Ⅰ、Ⅱ期。排除标准:(1)心、肝、肾等脏器发生严重病变者;(2)合并其他恶性肿瘤者;(3)意识障碍或合并精神疾病者;(4)因故无法完成相关治疗或失访者。入组人员均于同意书上具名,医院伦理委员会获悉并核准本研究。
1.2 方法
1.2.1 治疗方法 常规组开展TAC新辅助化疗,即多西他赛注射液(生产厂家:正大天晴药业集团股份有限公司,批准文号:国药准字H20183209,规格:1 mL︰20 mg)75 mg/m2,第1天静脉滴注;盐酸表柔比星(生产厂家:浙江海正药业股份有限公司,批准文号:国药准字H20041211,规格:5 mL︰10 mg)80 mg/m2,第1天静脉滴注;环磷酰胺(生产厂家:山西普德药业有限公司,批准文号:国药准字H14023686,规格:0.2 g)500 mg/m2,第1天静脉滴注。以21 d为1个疗程,连续治疗6个疗程。研究组则开展TCH新辅助化疗,即多西他赛注射液75 mg/m2,第1天静脉滴注;卡铂注射液(生产厂家:齐鲁制药有限公司,批准文号:国药准字H20020180,规格:10 mL︰100 mg)第1天静脉滴注;曲妥珠单抗[生产厂家:Genentech Inc,批准文号:注册证号S20060026,规格:440 mg(20 mL)/瓶],初始剂量为8 mg/kg,之后改为6 mg/kg,第1天静脉滴注。以21 d为1个疗程,连续治疗6个疗程。
1.2.2 标本采集 分别于治疗前1 d以及治疗1、3、6个疗程后采集所有人员的晨起静脉血4 mL。以8 cm作为离心半径,3 500 r/min离心10 min,获取血清保存于-80 ℃冰箱中备用待测。
1.3 观察指标及判定标准 分析两组疗效,化疗前后血清LCN-2、TGF-β1、VEGF水平变化情况,不良反应发生情况等方面的差异。(1)疗效判定标准主要参照世界卫生组织(WHO)制订的统一标准进行,①完全缓解(CR):肿瘤病灶全部消失;②部分缓解(PR):肿瘤病灶体积缩小50%及以上;③稳定(SD):肿瘤病灶体积缩小不足50%或增加不足25%;④恶化(PD):肿瘤病灶体积增加≥25%,或有新病灶出现[7]。总有效率=(CR例数+PR例数)/总例数×100%。(2)血清LCN-2、TGF-β1、VEGF水平的检测主要是通过酶联免疫吸附法完成,一应操作遵循试剂盒说明书完成。相关试剂盒均购自上海亿丰生物有限公司。(3)不良反应以胃肠道反应、食欲降低以及血小板减少为主。
1.4 统计学处理 采用SPSS 22.0软件对所得数据进行统计分析,计量资料用(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 研究组年龄31~60岁,平均(45.29±6.23)岁;肿瘤类型:小叶癌22例,浸润性导管癌24例;TNM分期:Ⅰ期20例,Ⅱ期26例。常规组年龄31~60岁,平均(45.41±6.26)岁;肿瘤类型:小叶癌23例,浸润性导管癌24例;TNM分期:Ⅰ期20例,Ⅱ期27例。两组上述资料比较,差异均无统计学意义(P>0.05),具有可比性。
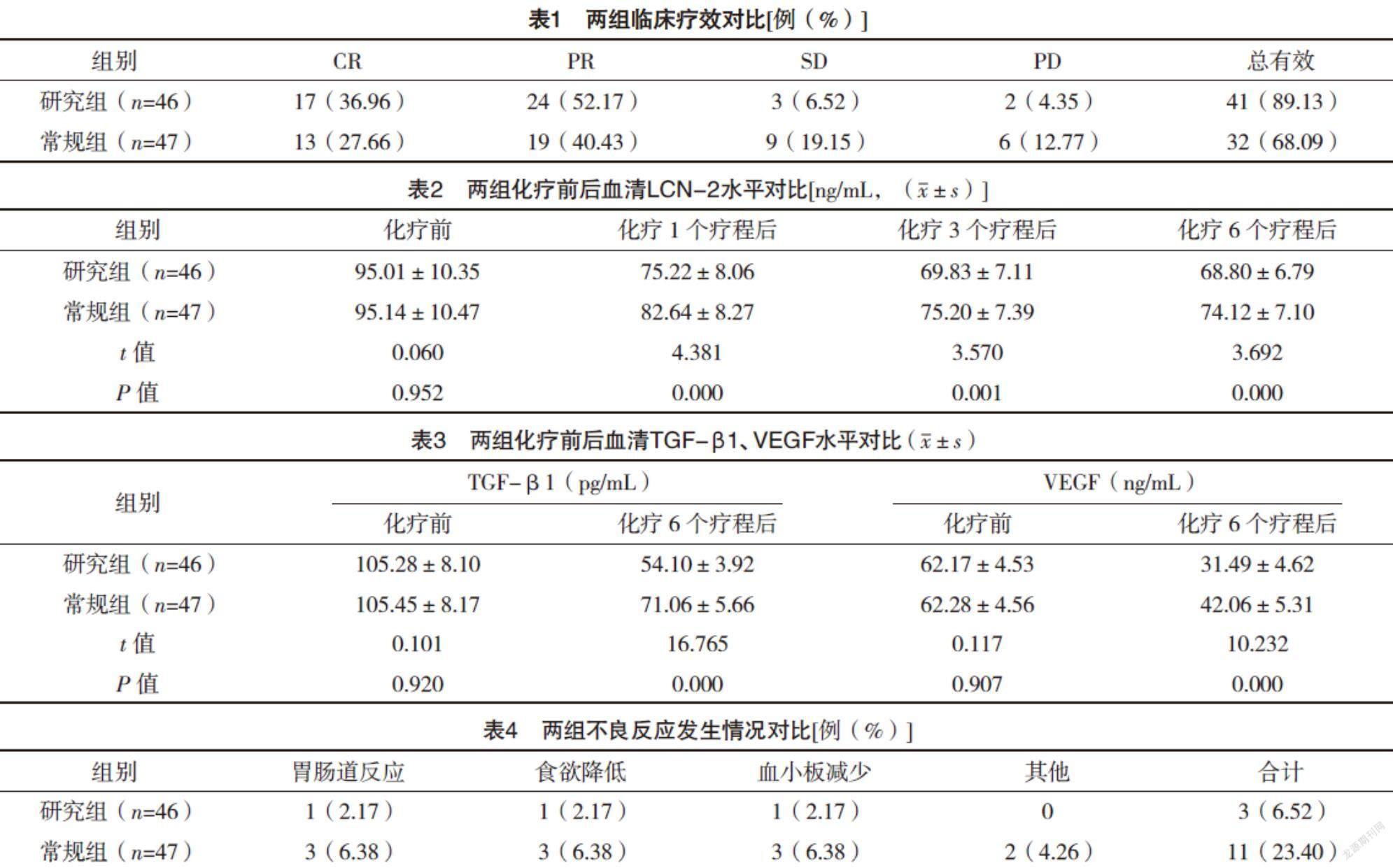
2.2 两组临床疗效对比 研究组总有效率高于常规组,差异有统计学意义(字2=6.100,P=0.014),见表1。
2.3 两组化疗前后血清LCN-2水平对比 化疗前,两组LCN-2水平对比,差异无统计学意义(P>0.05);研究组化疗1、3、6个疗程后的血清LCN-2水平均低于常规组(P<0.05)。见表2。
2.4 两组化疗前后血清TGF-β1、VEGF水平对比 化疗前,两组血清TGF-β1、VEGF水平对比,差异均无统计学意义(P>0.05);化疗6个疗程后,研究组血清TGF-β1、VEGF水平均低于常规组(P<0.05)。见表3。
2.5 两组不良反应发生情况对比 研究组不良反应发生率低于常规组(字2=5.182,P=0.023),见表4。
3 讨论
乳腺癌作为一种全身性恶性肿瘤疾病,患者早期症状表现包括乳房肿块、乳头溢液以及腋窝淋巴结肿大等,且随着病情的恶化,可能诱发器官病变,继而对患者的生命安全造成极大威胁[8-11]。手术切除是临床上治疗乳腺癌的有效方式之一,尤其是早期乳腺癌患者接受手术切除后获益匪浅。随着近年来乳腺癌早期筛查、诊断技术的飞速发展,越来越多的早期乳腺癌患者被临床检出,从而使得有机会接受手术切除治疗的病例与日俱增。然而,随着人们生活水平的逐渐升高以及健康需求的日益提升,单纯的手术切除治疗已无法满足患者需求。因此,针对乳腺癌的治疗开始从单纯手术治疗逐步发展至以手术治疗为主,化疗为辅的综合治疗[12]。其中HER2阳性乳腺癌具有细胞毒性药物的高耐药性、恶性程度高以及病情进展迅速等特点[13],患者预后普遍较差,寻求一种积极有效的治疗方案是广大医务工作者亟待解决的重要问题。
本文结果发现,研究组总有效率高于常规组。这提示了研究组治疗方案可显著提高HER2阳性早期乳腺癌患者临床疗效。究其原因,该化疗方案中的曲妥珠单抗属于人源化HER2单克隆抗体,可通过和HER2胞外结构域Ⅳ相结合,继而对HER2的异常表达起到抑制作用,同时发挥拮抗HER2家族刺激肿瘤细胞增长的作用。而多西他赛属于紫杉类抗肿瘤药物之一,可通过刺激小管聚合成稳定的微管,继而对肿瘤细胞分裂起到一定的抑制作用[14]。此外,LCN-2可通过调控E-钙黏蛋白以及纤维连接蛋白表达,继而促进上皮细胞的间质转型,发挥调节细胞增殖、分化以及凋亡的作用。其在乳腺癌组织中的过表达增加了肿瘤浸润、转移的风险,且和患者预后不良明显相关。而本研究结果显示,研究组化疗后1、3、6个疗程的血清LCN-2水平均低于常规组。究其原因,研究组化疗方案可通过对DNA合成进行抑制,继而抑制肿瘤细胞增殖分裂,且研究组方案治疗过程中患者发生耐药的概率更低,从而可更好地抑制患者病情进展[15-17]。另外,研究组化疗后血清TGF-β1以及VEGF水平均低于常规组。其中TGF-β1可发挥抑制组织上皮源性细胞的作用,其水平的升高往往反映了恶性肿瘤转移风险增高,而VEGF是血管再生因子,在促进肿瘤增殖、生长方面起着积极促进作用。研究组化疗方案中的曲妥珠单抗以及多西他赛联合应用时具有一定的协同作用,因此可控制乳腺癌病情进展,提高治疗效果。本文结果还显示了研究组不良反应发生率低于常规组。这说明了研究组治疗方案具有更好的安全性,其主要原因可能在于:该治疗方案属于全身性化疗,其中多西他赛以及曲妥珠单抗具有协同作用,可明显减少不良反应的发生[18-20]。
综上所述,TCH新辅助化疗治疗HER2阳性早期乳腺癌患者的临床效果较佳,可明显降低血清LCN-2、TGF-β1、VEGF水平,有利于减少不良反应,安全性较佳。
参考文献
[1]陈伟财,何劲松,吴恢升,等.TCH与TAC新辅助化疗在HER-2过表达乳腺癌中的疗效观察[J].中国肿瘤临床,2014,41(6):373-376.
[2]宋国红,李惠平,邸立军,等.真实世界吡咯替尼治疗HER2阳性转移性乳腺癌的疗效及安全性[J].北京大学学报(医学版),2020,52(2):254-260.
[3]辛灵,张虹,张爽,等.多西他赛+卡铂联合曲妥珠单抗方案对早期人表皮生长因子受体2阳性乳腺癌的新辅助治疗效果[J].中华外科杂志,2021,59(3):222-227.
[4]徐巧萍,朱洁瑾,刘坚,等.HER-2阳性乳腺癌患者2种新辅助化疗方案的药物经济学评价[J].中国现代应用药学,2019,36(8):985-992.
[5]刘永霞,刘飞,高莉莉,等.血清sE-cadherin、LCN-2、MMP-9联合检测在乳腺癌早期诊断中的应用[J].现代肿瘤医学,2021,29(11):1894-1898.
[6]周金妹,胡晓,张会强,等.曲妥珠单抗联合蒽环类药物对HER2阳性乳腺癌患者心脏功能影响临床观察[J].中华肿瘤防治杂志,2019,26(10):707-712.
[7]苏猛,张星.循环肿瘤细胞评估行新辅助化疗转移性乳腺癌患者人类表皮生长因子受体2表达水平与疗效及预后关系研究[J].临床军医杂志,2021,49(4):427-428.
[8]周勇,李靖,彭世軍,等.HER-2过表达乳腺癌患者接受TCH与TAC新辅助化疗后肿瘤恶性程度的评估[J].海南医学院学报,2016,22(20):2471-2474.
[9]杨文强,刘敏,唐铁雷,等.TCH新辅助化疗方案治疗HER-2阳性乳腺癌的疗效及对患者ER、PR、HER-2及Ki67表达的影响[J].海南医学,2020,31(20):2598-2601.
[10]徐玲,叶京明,朱赛楠,等.HER-2阳性早期乳腺癌TCH方案新辅助治疗疗效分析[J].中华医学杂志,2018,98(12):907-911.
[11]张进儒,祁涛,刘海明,等.曲妥珠单抗治疗失败的HER-2阳性乳腺癌患者不同后续治疗方案的疗效及影响因素分析[J].现代肿瘤医学,2021,29(1):61-65.
[12]崔志超,周立芝,马杰,等.乳腺癌患者新辅助化疗后ER、PR、HER2、Ki67表达变化及临床意义[J].现代生物医学进展,2020,20(10):1997-2000.
[13]朱晓敏,王浩楠,郭春龙,等.新辅助化疗对乳腺癌患者激素受体、人表皮生长因子受体-2及炎性指标影响研究[J].临床军医杂志,2019,47(2):196-198.
[14]王希佳,王刚.UGT2B7-161基因多态性预测接受EC-TH方案辅助化疗HER-2阳性乳腺癌患者心脏毒性风险的价值[J].临床肿瘤学杂志,2020,25(1):20-25.
[15]赵子伟,姚永强.吡咯替尼联合槐耳颗粒治疗人表皮生长因子受体2阳性晚期乳腺癌患者化疗耐药效果观察[J].临床军医杂志,2020,48(3):284-286.
[16]李思锐,杨芳,张德慧,等.曲妥珠单抗联合紫杉醇新辅助化疗人表皮生长因子受体2阳性乳腺癌的临床效果观察[J].中国医学创新,2020,17(3):5-8.
[17] HUNTER F W,BARKER H R,LIPERT B,et al.Mechanisms of resistance to trastuzumab emtansine (T-DM1) in HER2-positivebreast,cancer[J].Br J Cancer,2020,122(5):603-612.
[18] ARAB A,YAZDIAN-ROBATI R,BEHRAVAN J.HER2-Positive,Breast,Cancer,Immunotherapy: A Focus on Vaccine Development[J].Arch Immunol Ther Exp (Warsz),2020,68(1):2-4.
[19]张凯,陈然,罗智辉,等.乳腺癌患者新辅助化疗前后Ki-67、Tau表达水平与化疗效果的关系分析[J].中国医学创新,2019,16(22):63-66.
[20] EMENS L A,ESTEVA F J,BERESFORD M,et al.Trastuzumab emtansine plus atezolizumab versus trastuzumab emtansine plus placebo in previously treated, HER2-positive advanced breast cancer (KATE2): a phase 2, multicentre, randomised, double-blind trial[J].Lancet Oncol,2020,21(10):1283-1295.
(收稿日期:2021-07-29) (本文编辑:姬思雨)

