钻孔内镜下微创手术对高血压脑出血患者血清去甲肾上腺素、5-羟色胺和神经功能的影响*
薛锋,陈婷婷,李佳
(天津市南开医院1.神经外科;2.肿瘤内科,天津 300000)
高血压脑出血是自发性脑血管疾病的常见类型,发病急骤,病情进展迅速,致残率及病死率较高[1-2]。据文献[3-4]报道,脑出血急性期病死率高达35%,且多数患者会有后遗症,威胁患者生命安全及身心健康。目前,高血压脑出血首选手术治疗,及时清除血肿块,同时解除血肿对脑组织的继发性损伤,恢复患者神经功能,改善预后[5-6]。近年来,神经内镜微创手术逐渐应用于多种脑部疾病中,具有创伤小和并发症少等优势,且临床疗效好[7]。有研究[8]表明,脑出血发生后,去甲肾上腺素(norepinephrine,NE)能神经元和5-羟色胺(5-hydroxytryptamine,5-HT)能神经元等与情绪有关的神经元及其通路表达受限,可引发抑郁,不利于患者术后康复。本研究旨在分析钻孔内镜下微创手术对高血压脑出血患者血清NE、5-HT水平及术后神经功能的影响。现报道如下:
1 资料与方法
1.1 一般资料
回顾性分析2017年11月-2020年11月本院92例高血压脑出血患者的临床资料,依据治疗方案不同分为两组,各46 例。观察组中,男24 例,女22 例,平均年龄(60.14±7.52) 岁,发病至入院时间(3.25±1.41)h,出血量(37.58±3.74)mL,格拉斯哥昏迷量表(Glasgow Coma Scale, GCS) 评分(10.58±1.25)分,出血部位:基底节20例,脑叶11例,其他部位15 例。对照组中,男26 例,女20 例,平均年龄(59.54±6.78) 岁,发病至入院时间(3.39±1.28)h,出血量(38.12±3.29)mL,GCS 评分(10.24±1.06)分,出血部位:基底节22 例,脑叶14 例,其他部位10 例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
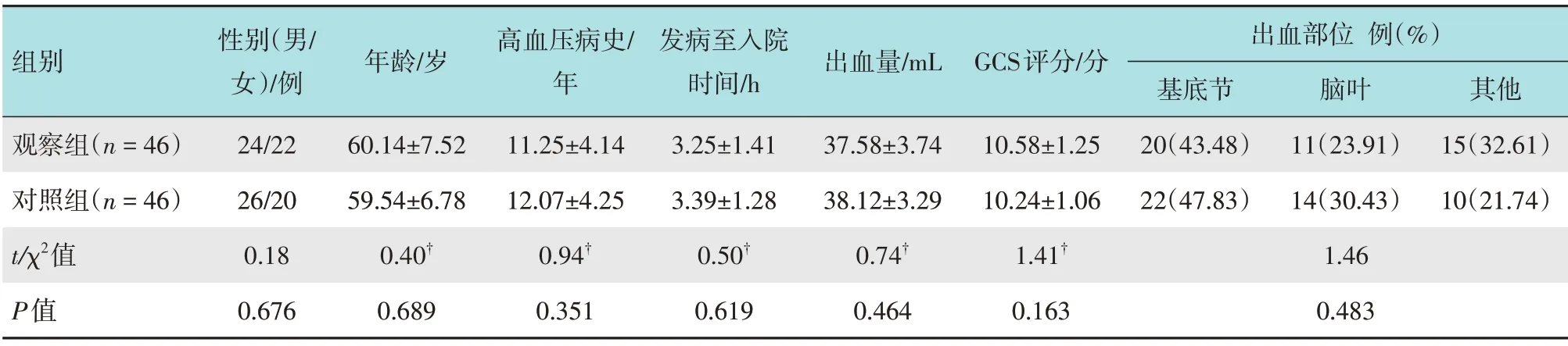
表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
纳入标准:①均符合高血压脑出血诊断标准[9],并经头颅CT 或MRI 等检查确诊;②首次发病至入院时间<7 h;③年龄45~75 岁;④GCS 评分>7 分;⑤病例资料完整。排除标准:①合并血管畸形者;②合并重要器官功能障碍者;③伴有免疫或血液系统疾病和凝血功能障碍者;④既往有脑卒中病史者;⑤长期使用抗生素、糖皮质激素或免疫抑制剂等药物治疗者;⑥伴有精神异常、恶性肿瘤者;⑦病例资料不完整。
1.2 手术方法
1.2.1 观察组气管插管全身麻醉,行钻孔内镜下微创手术。采用神经内镜定位,做一2 cm 小切口,定位血肿、钻孔(不施行小骨窗),血肿腔内注入导针,并逐步扩大,置入合适的新型透明鞘,根据血肿深度固定骨缘,经透明鞘置入神经内镜和吸引器后,将透明鞘转动至覆盖并清除血肿。术中可通过神经内镜直视术野,若发现明显动脉出血点,可用内镜专用双极电凝止血。
1.2.2 对照组气管插管全身麻醉,行软通道穿刺抽吸引流治疗。CT 下明确穿刺点,尽量避开脑功能区及重要血管,做一长2 cm 小切口,颅骨钻孔,骨窗扩大;经软通道穿刺抽吸半固体血肿块,再用无菌生理盐水冲洗后引流。术后残留血肿>50%者,予以3~5万u尿激酶管腔内注射,1或2次/d,术后3~7 d拔出引流管。
1.3 检测方法
两组患者均于空腹状态下抽取5 mL 静脉血,3 000 r/min 离心10 min,分离血清、血浆待检。以放射免疫法(试剂盒:天津阿斯尔生物科技有限公司)测定血浆肾素活性(plasma renin activity,PRA)、血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ) 和醛固酮(aldosterone,ALD)水平;以酶联免疫吸附法(试剂盒:江苏江莱生物科技有限公司)测定血清白细胞介素-6 (interleukin-6,IL-6) 和C-反应蛋白(Creactive protein,CRP)水平;高效液相电化学法(试剂盒:Sigma 公司)测定血清NE 和5-HT 水平。操作严格遵循试剂盒说明书进行。
1.4 观察指标
1.4.1 手术相关指标包括手术时间、术中出血量、血肿清除率、住院时间和并发症发生率。术后次日复查CT,计算血肿清除率;并发症包括颅内感染和坠积性肺炎等。
1.4.2 神经功能术前、术后7和30 d分别采用美国国立卫生研究院卒中量表(The National Institutes of Health Stroke Scale,NIHSS)和斯堪的纳维亚卒中量表(Scandinavia Stroke Scale,SSS)评估神经功能。NIHSS 评分越高,表明神经功能缺损越严重;SSS 评分越高,表明神经功能恢复越好[10-11]。
1.4.3 炎症因子记录术前、术后1 和7 d 血清IL-6和CRP水平。
1.4.4 肾素-血管紧张素系统记录术前、术后1和7 d PRA、Ang Ⅱ和ALD水平。
1.4.5 神经递质记录术前、术后1 和7 d 血清NE和5-HT水平。
1.4.6 预后情况术后3个月,采用格拉斯哥预后量表(Glasgow Outcome Scale,GOS)评估预后情况。Ⅰ级:病死;Ⅱ级:植物生存;Ⅲ级:重度残疾;Ⅳ级:中度残疾;Ⅴ级:恢复良好[12]。
1.5 统计学方法
选用SPSS 20.0 统计软件分析数据。计量资料以均数±标准差(±s)表示,行t检验或重复测量设计的方差分析;计数资料以构成比或率(%)表示,行χ2检验;等级资料行秩和检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者手术相关指标比较
观察组手术时间长于对照组(P<0.05),术中出血量多于对照组(P<0.05),血肿清除率高于对照组(P<0.05);两组患者住院时间及术后并发症发生率比较,差异均无统计学意义(P>0.05)。见表2。
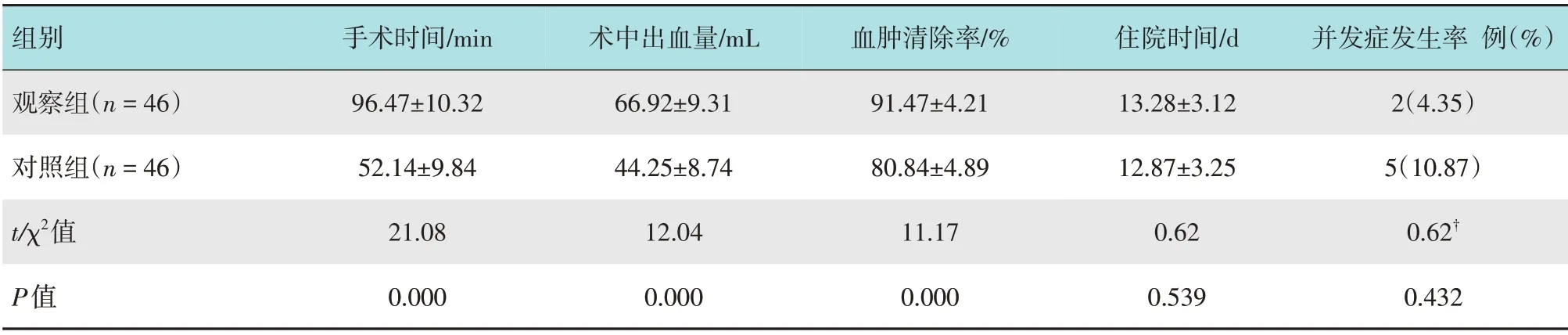
表2 两组患者手术相关指标比较Table 2 Comparison of operation related indexes between the two groups
2.2 两组患者神经功能相关指标比较
观察组与对照组术前、术后7和30 d的NIHSS评分和SSS 评分比较,采用重复测量数据的方差分析。结果显示:①不同时点的NIHSS 评分和SSS 评分比较,差异有统计学意义(F=15.24,P=0.000;F=17.84,P=0.000);②观察组与对照组NIHSS 评分和SSS 评分比较,观察组术后7 和30 d NIHSS 评分较对照组低,SSS评分较对照组高,差异有统计学意义(F=91.27,P=0.000;F=87.36,P=0.000);③观察组与对照组的NIHSS评分和SSS评分变化趋势比较,差异有统计学意义(F=15.85,P=0.000;F=14.13,P=0.000)。见表3和图1。
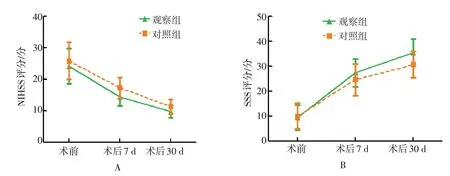
图1 两组患者神经功能比较Fig.1 Comparison of neurological function between the two groups
表3 两组患者手术前后神经功能相关指标比较 (分,±s)Table 3 Comparison of neurological function related indicators between the two groups before and after operation (points,±s)

表3 两组患者手术前后神经功能相关指标比较 (分,±s)Table 3 Comparison of neurological function related indicators between the two groups before and after operation (points,±s)
组别NIHSS评分术前24.15±5.62 25.78±5.94 91.27 0.000术后7 d 14.37±2.84 17.25±3.26观察组(n=46)对照组(n=46)F值P值术后30 d 9.73±1.94 11.28±2.31术后7 d 27.37±5.61 24.62±6.39术后30 d 35.39±5.41 30.58±5.26 SSS评分术前9.47±4.98 9.94±5.12 87.36 0.000
2.3 两组患者炎症因子比较
观察组与对照组术前、术后1 和7d 的血清IL-6和CRP 水平比较,采用重复测量数据的方差分析。结果显示:①不同时点的血清IL-6 和CRP 水平比较,差异有统计学意义(F=18.14,P=0.000;F=17.69,P=0.000);②观察组与对照组血清IL-6和CRP 水平比较,观察组术后1 d 较高,术后7 d 较低,差异有统计学意义(F=90.32,P=0.000;F=90.27,P=0.000);③观察组与对照组的血清IL-6 和CRP 水平变化趋势比较,差异有统计学意义(F=14.74,P=0.000;F=15.70,P=0.000)。见表4和图2。
表4 两组患者手术前后炎症因子相关指标比较 (±s)Table 4 Comparison of inflammatory factor related indicators between the two groups before and after operation (±s)
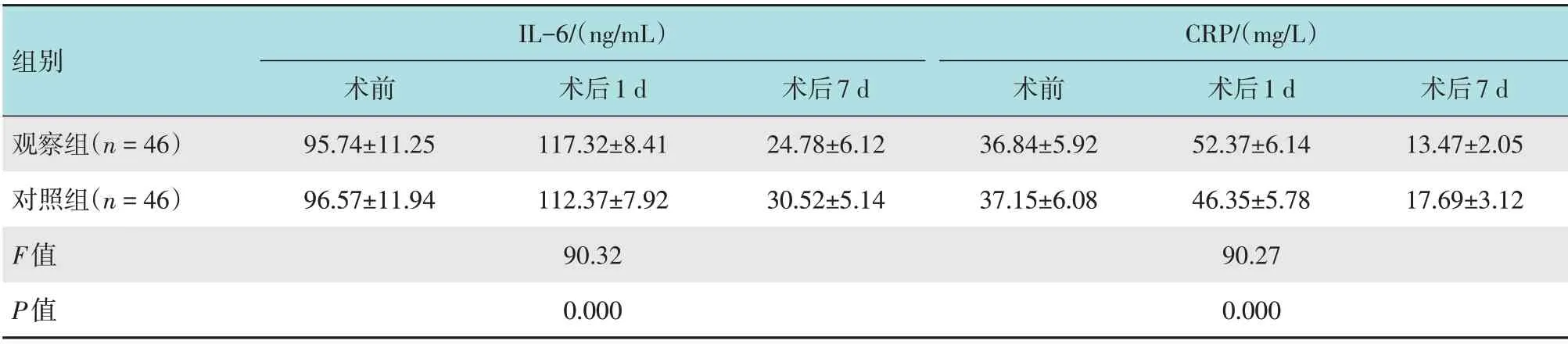
表4 两组患者手术前后炎症因子相关指标比较 (±s)Table 4 Comparison of inflammatory factor related indicators between the two groups before and after operation (±s)
组别IL-6/(ng/mL)术前95.74±11.25 96.57±11.94 90.32 0.000术后7 d 24.78±6.12 30.52±5.14观察组(n=46)对照组(n=46)F值P值术后1 d 117.32±8.41 112.37±7.92术后1 d 52.37±6.14 46.35±5.78术后7 d 13.47±2.05 17.69±3.12 CRP/(mg/L)术前36.84±5.92 37.15±6.08 90.27 0.000
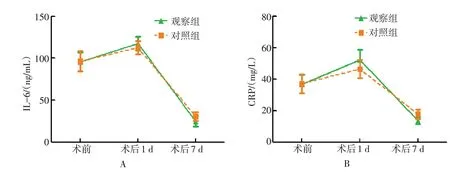
图2 两组患者炎症因子比较Fig.2 Comparison of inflammatory factor between the two groups
2.4 两组患者肾素-血管紧张素系统相关指标比较
观察组与对照组术前、术后1和7 d的PRA、AngⅡ和ALD水平比较,采用重复测量数据的方差分析。结果显示:①不同时点的PRA、Ang Ⅱ和ALD水平比较,差异有统计学意义(F=18.26,P=0.000;F=17.70,P=0.000;F=17.14,P=0.000);②观察组与对照组PRA、Ang Ⅱ和ALD水平比较,观察组术后1 d 较高,术后7 d 较低,差异有统计学意义(F=92.31,P=0.000;F=90.98,P=0.000;F=95.25,P=0.000);③观察组与对照组的PRA、Ang Ⅱ和ALD水平变化趋势比较,差异有统计学意义(F=15.12,P=0.000;F=15.74,P=0.000;F=15.74,P=0.000)。见表5和图3。

图3 两组患者肾素-血管紧张素系统比较Fig.3 Comparison of renin-angiotensin system between the two groups
表5 两组患者手术前后肾素-血管紧张素系统相关指标比较 (±s)Table 5 Comparison of renin-angiotensin system related indicators between the two groups before and after operation (±s)
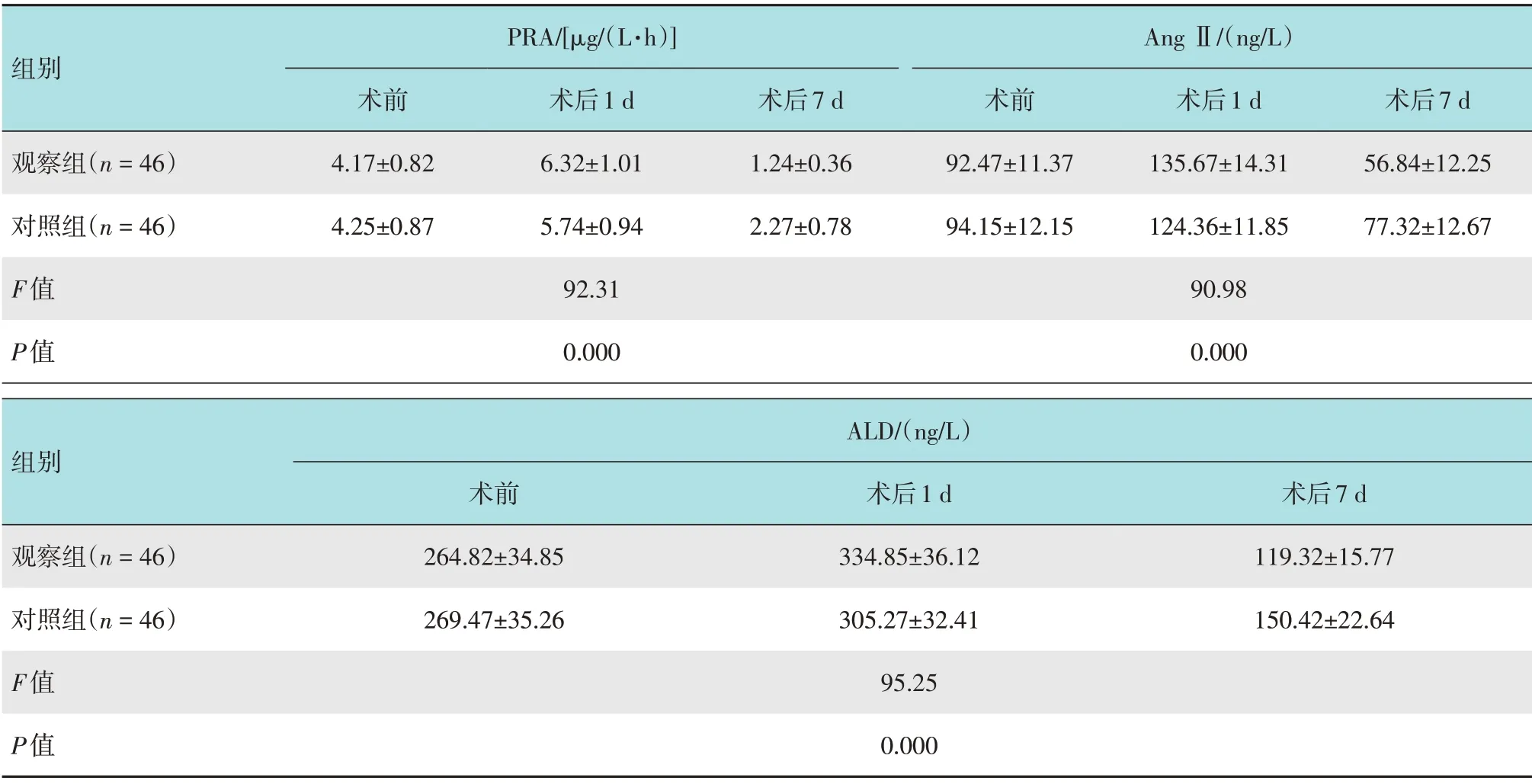
表5 两组患者手术前后肾素-血管紧张素系统相关指标比较 (±s)Table 5 Comparison of renin-angiotensin system related indicators between the two groups before and after operation (±s)
组别PRA/[μg/(L·h)]术前4.17±0.82 4.25±0.87 92.31 0.000术后7 d 1.24±0.36 2.27±0.78术后1 d 135.67±14.31 124.36±11.85术后1 d 6.32±1.01 5.74±0.94术后7 d 56.84±12.25 77.32±12.67观察组(n=46)对照组(n=46)F值P值Ang Ⅱ/(ng/L)术前92.47±11.37 94.15±12.15 90.98 0.000组别观察组(n=46)对照组(n=46)F值P值ALD/(ng/L)术前264.82±34.85 269.47±35.26 95.25 0.000术后1 d 334.85±36.12 305.27±32.41术后7 d 119.32±15.77 150.42±22.64
2.5 两组患者神经递质相关指标比较
观察组与对照组术前、术后1 d 和7d 的血清NE和5-HT水平比较,采用重复测量数据的方差分析。结果显示:①不同时点的血清NE和5-HT水平比较,差异有统计学意义(F=19.26,P=0.000;F=20.14,P=0.000);②观察组与对照组血清NE 和5-HT 水平比较,观察组术后1和7 d NE和5-HT水平较对照组高,差异有统计学意义(F=87.42,P=0.000;F=89.12,P=0.000);③观察组与对照组的血清NE和5-HT水平变化趋势比较,差异有统计学意义(F=14.51,P=0.000;F=13.24,P=0.000)。见表6和图4。
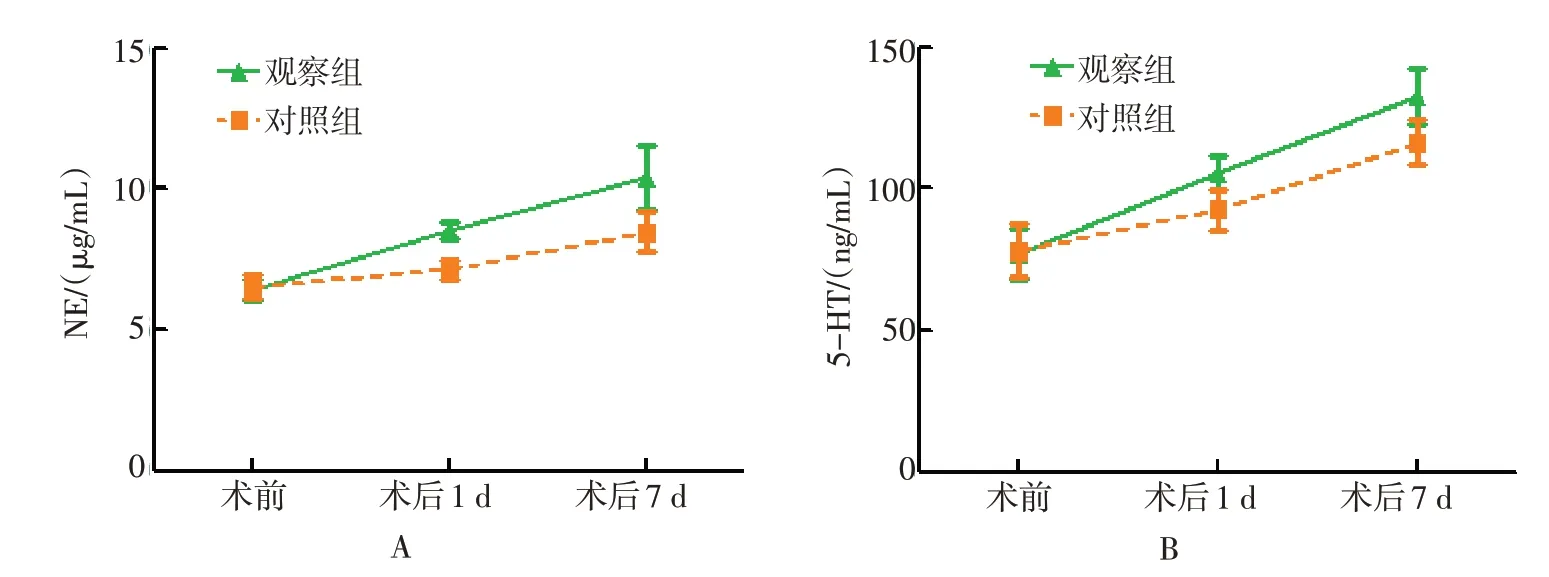
图4 两组患者神经递质比较Fig.4 Comparison of neurotransmitter between the two groups
表6 两组患者手术前后神经递质相关指标比较 (±s)Table 6 Comparison of neurotransmitter related indicators between the two groups before and after operation (±s)

表6 两组患者手术前后神经递质相关指标比较 (±s)Table 6 Comparison of neurotransmitter related indicators between the two groups before and after operation (±s)
组别NE/(μg/mL)术前6.41±0.37 6.52±0.40 87.42 0.000术后1 d 8.52±0.32 7.14±0.37术后7 d 10.41±1.12 8.46±0.72观察组(n=46)对照组(n=46)F值P值术后1 d 105.41±6.12 92.41±7.39术后7 d 132.46±9.58 116.27±8.13 5-HT/(ng/mL)术前77.06±9.14 78.12±9.72 89.12 0.000
2.6 两组患者预后情况比较
两组患者术后3个月均无死亡病例,观察组GOS明显优于对照组(P<0.05)。见表7。
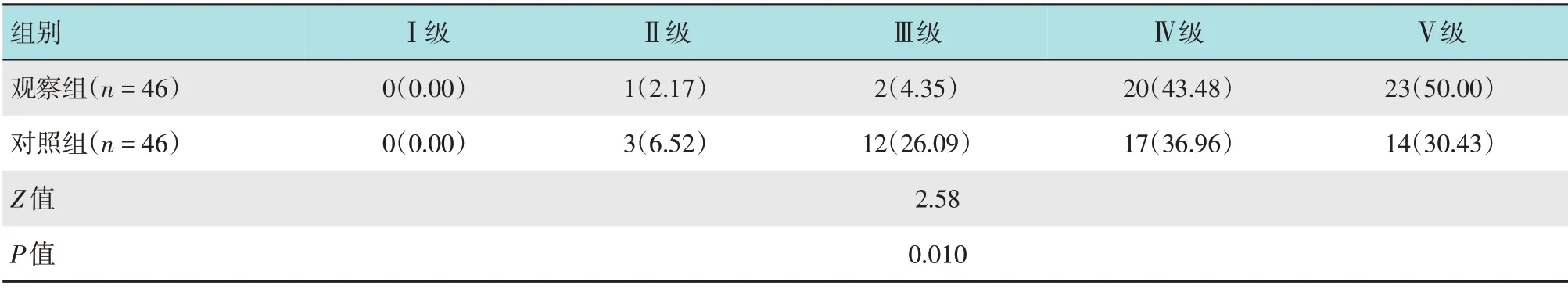
表7 两组患者GOS比较 例(%)Table 7 Comparison of GOS between the two groups n(%)
3 讨论
脑出血为高血压最严重的并发症,可导致不可逆的神经功能损伤。一方面,因脑出血后脑组织和脑神经受颅内血肿压迫,导致局部脑循环及脑代谢障碍;另一方面,血凝块释放凝血酶和红细胞代谢产物造成局部脑水肿,导致脑组织代谢紊乱,严重者甚至可导致神经细胞坏死和凋亡[13-15]。因此,治疗早期应彻底清除脑血肿,降低颅内压,尽可能保护神经功能。开颅手术清除脑血肿快速,但创伤大,医源性损伤也会损伤患者神经功能,已较少采用。目前,高血压脑出血的治疗以微创手术为主,尤其是软通道穿刺抽吸引流在临床上应用较为广泛。该方法借助术前影像学定位血肿,做头皮小切口、钻孔,骨窗扩大后,经软通道穿刺抽吸血肿块,并以尿激酶加速血肿溶解、排出,创伤较传统开颅手术大幅度减小。
钻孔内镜下微创手术是现今高血压脑出血治疗的首选方式,在透明撕开鞘保护下进行手术操作,术中吸引器局限于透明鞘内,借助血肿挤入作用行血肿清除,避免了损伤[16-17]。本研究显示,观察组血肿清除率高于对照组(P<0.05),提示:钻孔内镜下微创手术血肿清除率更高。原因在于:该术式在神经内镜直视下进行,术野清晰,可精确清除血肿。
IL-6具有介导和参与炎症反应的作用;CRP为机体常见急性时相反应蛋白,在机体感染和组织损伤时急剧增长[18]。本研究中,术后1 d,两组患者血清IL-6和CRP水平均高于术前,且观察组高于对照组,考虑原因为:钻孔内镜下微创手术操作较软通道穿刺抽吸引流术复杂,手术用时较长,患者应激反应持续时间较长。而炎症反应参与高血压脑出血发病,与病情严重程度有关[19]。本研究中,术后7 d 观察组血清IL-6 和CRP 水平低于对照组,提示:钻孔内镜下微创手术血肿清除率高,手术效果更佳。
肾素-血管紧张素系统为调节血管活动的重要体液机制之一。脑出血患者肾血管迅速收缩,增加了肾素分泌,并迅速激活该系统,从而致使血压大幅度升高,加重患者病情[20]。本研究中,观察组术后1 d PRA、Ang Ⅱ和ALD高于对照组,可能是由于手术应激反应和术后机体创伤等导致患者血压升高,从而负反馈影响肾素-血管紧张素系统,使PRA、Ang Ⅱ和ALD 水平升高;而术后7 d,患者应激反应减轻,术后机体创伤逐渐恢复,血压下降,观察组恢复更快。因此,观察组PRA、Ang Ⅱ和ALD 水平低于对照组。杨文清等[21]指出,脑出血发生后,大鼠NE和5-HT 水平较正常值明显下降,以24 h 下降最为明显,72 h 后又可回升并接近4 h 值。此外,脑出血病灶可抑制NE 和5-HT 等与情绪有关的单胺类神经递质释放,加速抑郁发生。高血压脑出血患者神经功能缺损可诱发抑郁,不利于神经功能和日常生活能力的恢复,从而导致恶性循环。本研究中,术后7 和30 d,观察组NIHSS 评分低于对照组,SSS 评分高于对照组,提示:钻孔内镜下微创手术可明显促进患者神经功能恢复,快速解除血肿对NE 和5-HT 的抑制。本研究中,观察组术后1 和7 d 血清NE 和5-HT 水平均高于对照组,充分证实了上述观点。此外,钻孔内镜下微创手术血肿清除率高,可一定程度上减少血肿对NE 和5-HT 的抑制,这也使得NE 和5-HT 水平升高。本研究中,术后随访3个月均无死亡病例,观察组预后优于对照组,提示:钻孔内镜下微创手术治疗高血压脑出血,可明显改善患者预后。
综上所述,行钻孔内镜下微创手术治疗高血压脑出血,可调节患者血清炎性因子水平,恢复肾素-血管紧张素系统,血肿清除率较高,还能减少血肿对NE和5-HT的抑制,消除相关不利影响,促进神经功能恢复,有助于改善患者预后。但本研究样本量较小,还需临床进一步行多中心、大样本量研究。

