右美托咪定联合帕瑞昔布钠对鼻内镜手术苏醒期躁动及术后早期镇痛的影响
何国尊,叶青,马欢,张春喜,史创国
(西安航天总医院麻醉科,陕西西安 710100)
慢性鼻窦炎为临床常见病,国内总患病率为8%[1],受环境污染及其他因素的影响,发病率有逐年上升的趋势[2]。功能性鼻内镜鼻窦手术是治疗鼻窦炎的主流技术[3-4],但手术创伤和术后鼻腔填塞均可能引起患者头面部胀痛不适[5]。有研究[6-7]表明,术后疼痛和气管插管是苏醒期躁动的最重要原因,而耳鼻喉手术是额外的危险因素,其躁动的发生率高达55.4%。苏醒期躁动是患者在麻醉苏醒过程中出现的一种暂时性的行为和意识分离状态,是最常见的并发症之一[8]。鼻内镜手术涉及上呼吸道,手术后,气道受血液污染,鼻气道被海绵、棉球等堵塞,可在清醒时拔管,但会加重患者躁动。苏醒期躁动可能引起创面出血和气管导管脱出,增加反流误吸甚至窒息的风险。功能性鼻内镜手术后,疼痛管理并不完善,68.9%的患者术后存在中度至重度疼痛。其中,34.4%的患者需要使用镇痛药[9-10]。在寻求良好镇痛的同时,应尽量避免呼吸抑制的发生。因此,探寻有效、安全的镇痛措施十分必要。完善围术期疼痛管理有利于减轻甚至避免苏醒期躁动的发生。阿片类药物具有呼吸抑制和导致恶心呕吐等副作用,给临床应用带来了一些困扰[11]。随着加速康复外科(enhance recovery after surgery,ERAS)中“最小用量”或“减少阿片类药物用量”等理念的推广,多模式镇痛已成为减轻术后疼痛公认的方法之一[12]。
非甾体抗炎药(nonsteroidal anti-inflammatory drug,NSAID)与阿片类药物合用可以减少阿片类药物的副作用,同时增强镇痛效果[13]。NSAID通过抑制环氧化酶(cyclooxygenase,COX)活性,产生抗炎、解热和镇痛的作用。相关研究[5,14]表明,鼻内镜手术中超前镇痛可以减轻患者的躁动程度,但样本量偏少。帕瑞昔布钠作为一种新型的NSAID 药物,是特异性COX-2 受体阻滞剂伐地昔布的前体[15],其镇痛效果确切,持续时间长,可以减少肺癌患者术后躁动的发生[16],但在鼻内镜手术中的应用罕有报道。右美托咪定(dexmedetomidine,DEX)具有镇静和镇痛效果,且无呼吸抑制的副作用,作为全身麻醉的辅助用药在临床中应用广泛。有研究[17]表明,输注DEX 可以预防苏醒期躁动的发生,但在手术结束前需提前停药,镇痛作用不足,常导致患者术后疼痛加重。因此,将帕瑞昔布钠与DEX 联合应用于鼻内镜手术,可以减少躁动,为术后镇痛提供了新的选择。本研究将帕瑞昔布钠的起效时间和DEX的停药时间相结合,观察两者联合应用对鼻内镜手术患者苏醒期躁动的影响,并评估术后的镇痛效果,以期为鼻内镜患者围手术期安全及加强术后镇痛提供一种有效的用药方案。
1 资料与方法
1.1 一般资料
选择2020年1月-2021年2月本院择期行全身麻醉下鼻内镜手术的患者104例。采用随机数表法分为实验组(DEX+帕瑞昔布钠组,DP 组)和对照组(DEX,D 组),各52 例。DP 组年龄19~63 岁,鼻窦手术30 例,鼻中隔手术22 例;D 组年龄18~64 岁,鼻窦手术37 例,鼻中隔手术15 例。两组患者性别、年龄、体重指数(body mass index,BMI)、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级、合并症和手术类型等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
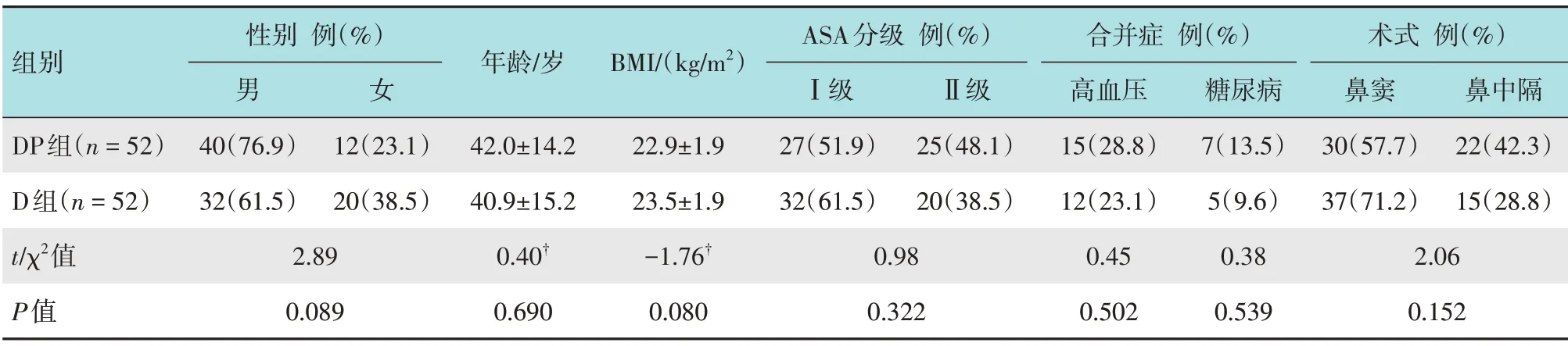
表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
1.2 纳入和排除标准
纳入标准:①年龄18~65 岁;②ASA 分级为Ⅰ级和Ⅱ级;③择期行鼻内镜手术者。排除标准:①术前心电图显示窦性心动过缓或束支传导阻滞者;②有NSAID 药过敏史者;③合并有精神类疾病者;④有长期饮酒或药物滥用史者;⑤有消化道溃疡病史或凝血功能异常者;⑥合并脑卒中或冠心病等病史者;⑦参与其他研究者。本研究经本院医学科学研究伦理委员会批准,所有纳入患者及家属均签署知情同意书。
1.3 麻醉方法
1.3.1 入室准备术前常规禁食10 h,禁饮8 h。患者入室后,建立静脉通路,常规标准监测三导联心电图、血压(blood pressure,BP)、经皮动脉血氧饱和度(percutaneous arterial oxygen saturation,SpO2)、呼气末二氧化碳分压(partial pressure of end-tidal carbon dioxide,PetCO2)和脑电双频指数(bispectral index,BIS)。两组患者麻醉诱导前,静脉输注DEX 0.5 μg/kg(生产批号:20061031,扬子江药业集团有限公司,规格:2 mL∶0.2 mg)10 min,然后持续泵注0.4 μg/(kg·h),手术结束前30 min停药。DP组在DEX 停药的同时静脉注射帕瑞昔布钠(生产批号:192101041,扬子江药业集团有限公司,规格:20 mg)40 mg。
1.3.2 麻醉诱导舒芬太尼0.3~0.5 μg/kg 静注,3 min 后静脉注射依托咪酯0.2~0.3 mg/kg,睫毛反射消失后给予罗库溴铵0.6 mg/kg,待BIS 值降至40~50,肌松完全起效(约90 s)后,将达克罗宁胶浆涂抹于气管导管前段及气囊部位,行气管插管,连接麻醉机行容量控制机械通气。
1.3.3 麻醉维持采用静吸复合麻醉七氟醚(1.5%~2.0%)吸入,瑞芬太尼0.1~0.2 μg/(kg·min)持续静脉泵注,间断静脉注射罗库溴铵0.1 mg/kg。根据手术刺激强度调整麻醉药剂量,维持BIS值在40~60(BIS 值的意义:100~85:清醒;85~65:镇静;65~40:合适的全麻深度;<40:脑电爆发性抑制)。手术结束前10 min,静脉注射昂丹司琼4 mg,预防术后恶心呕吐。麻醉过程中,患者若出现明显窦性心动过缓[心率(heart rate,HR)<50次/min],则给予阿托品0.5 mg静注;如果患者出现低血压[收缩压(systolic blood pressure,SBP)<90 mmHg 或平均动脉压(mean arterial pressure,MAP) <基础值30%],则给予麻黄碱10 mg 静注;患者出现高血压[SBP >160 mmHg 或舒张压(diastolic blood pressure,DBP)>110 mmHg或MAP >基础值30%],则给予盐酸乌拉地尔10~15 mg 静注。整个麻醉过程均由同一名高年资主治医师完成。
1.3.4 麻醉复苏手术结束后停药,待自主呼吸恢复,呼之睁眼,符合拔管条件后,拔出气短导管。面罩吸氧,出室前对患者进行Steward 评分,包括:①清醒程度:完全清醒2 分,对刺激有反应1 分,对刺激无反应0 分;②呼吸通畅度:可按医师吩咐咳嗽2分,可自主维持呼吸道通畅1分,呼吸道需予以支持0 分;③肢体活动度:肢体能做有意识的活动2 分,肢体无意识活动1分,肢体无活动0分。总评分≥4分可以出室返回病房。
1.4 观察指标
记录两组患者入室时(间隔3 min 测量3 次,取平均值,T0)、静注帕瑞昔布钠时(T1)、拔管时(T2)、拔管后5 min(T3)和出室时(Steward评分>4分,T4)的SBP、DBP、HR、PetCO2和BIS。记录手术麻醉时间、拔管时间、出室时间、术中液体出入量、舒芬太尼、七氟醚、瑞芬太尼和罗库溴铵等麻醉药用量。采用Ricker 镇静-躁动评分(Ricker sedation-agitation scale,RSAS)评估患者T2和T3时点的躁动评分,包括:不能唤醒(1分)、非常镇静(2分)、镇静(3 分)、安静合作(4 分)、躁动(5 分)、非常躁动(6分)和危险躁动(7分)。采用视觉模拟评分法(visual analogue scale,VAS)评估患者术后2、4、8、12 和24 h 的疼痛情况,标准为:0 分为无任何疼痛;1~3 分为轻度疼痛,不影响患者的睡眠质量;4~6分为中度疼痛,睡眠质量受到影响;7~10 分为重度疼痛,患者因疼痛无法入眠;10 分为剧痛。记录患者术后24 h恶心呕吐、鼻出血及胃肠不适的发生情况。各项评分及麻醉手术时间均由同一位麻醉主管护师记录。
1.5 统计学方法
选用SPSS 20.0 软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,两两比较行独立样本t检验;计数资料以例(%)表示,行χ2检验或Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者手术和麻醉相关指标比较
DP组出室时间(Steward >4分)较D组短,差异有统计学意义[(17.9±2.7) 和(19.8±2.9) min,P<0.01]。两组患者麻醉及手术时间、麻醉药用量、出血量、尿量和补液量比较,差异均无统计学意义(P>0.05)。见表2。
表2 两组患者手术和麻醉相关指标比较 (±s)Table 2 Comparison of operation and anesthesia related indexes between the two groups (±s)
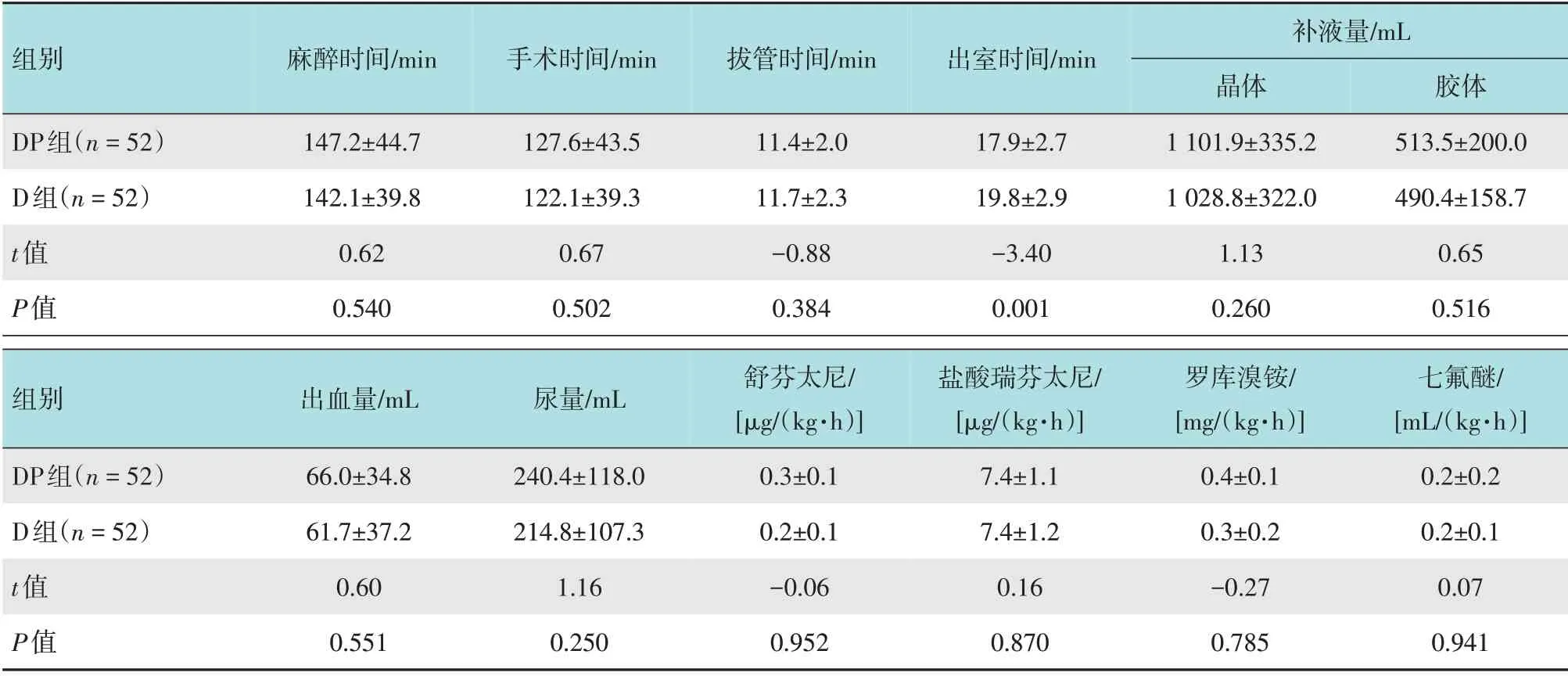
表2 两组患者手术和麻醉相关指标比较 (±s)Table 2 Comparison of operation and anesthesia related indexes between the two groups (±s)
组别麻醉时间/min 手术时间/min 拔管时间/min 出室时间/min DP组(n=52)D组(n=52)t值P值147.2±44.7 142.1±39.8 0.62 0.540 127.6±43.5 122.1±39.3 0.67 0.502 11.4±2.0 11.7±2.3-0.88 0.384 17.9±2.7 19.8±2.9-3.40 0.001补液量/mL晶体1 101.9±335.2 1 028.8±322.0 1.13 0.260胶体513.5±200.0 490.4±158.7 0.65 0.516组别出血量/mL 尿量/mL DP组(n=52)D组(n=52)t值P值66.0±34.8 61.7±37.2 0.60 0.551 240.4±118.0 214.8±107.3 1.16 0.250舒芬太尼/[μg/(kg·h)]0.3±0.1 0.2±0.1-0.06 0.952盐酸瑞芬太尼/[μg/(kg·h)]7.4±1.1 7.4±1.2 0.16 0.870罗库溴铵/[mg/(kg·h)]0.4±0.1 0.3±0.2-0.27 0.785七氟醚/[mL/(kg·h)]0.2±0.2 0.2±0.1 0.07 0.941
2.2 两组患者血流动力学指标比较
DP组T3和T4时点的SBP和HR较D组低,差异有统计学意义(P<0.05)。见表3。
表3 两组患者不同时点血流动力学指标比较 (±s)Table 3 Comparison of hemodynamic indexes at different time points between the two groups (±s)
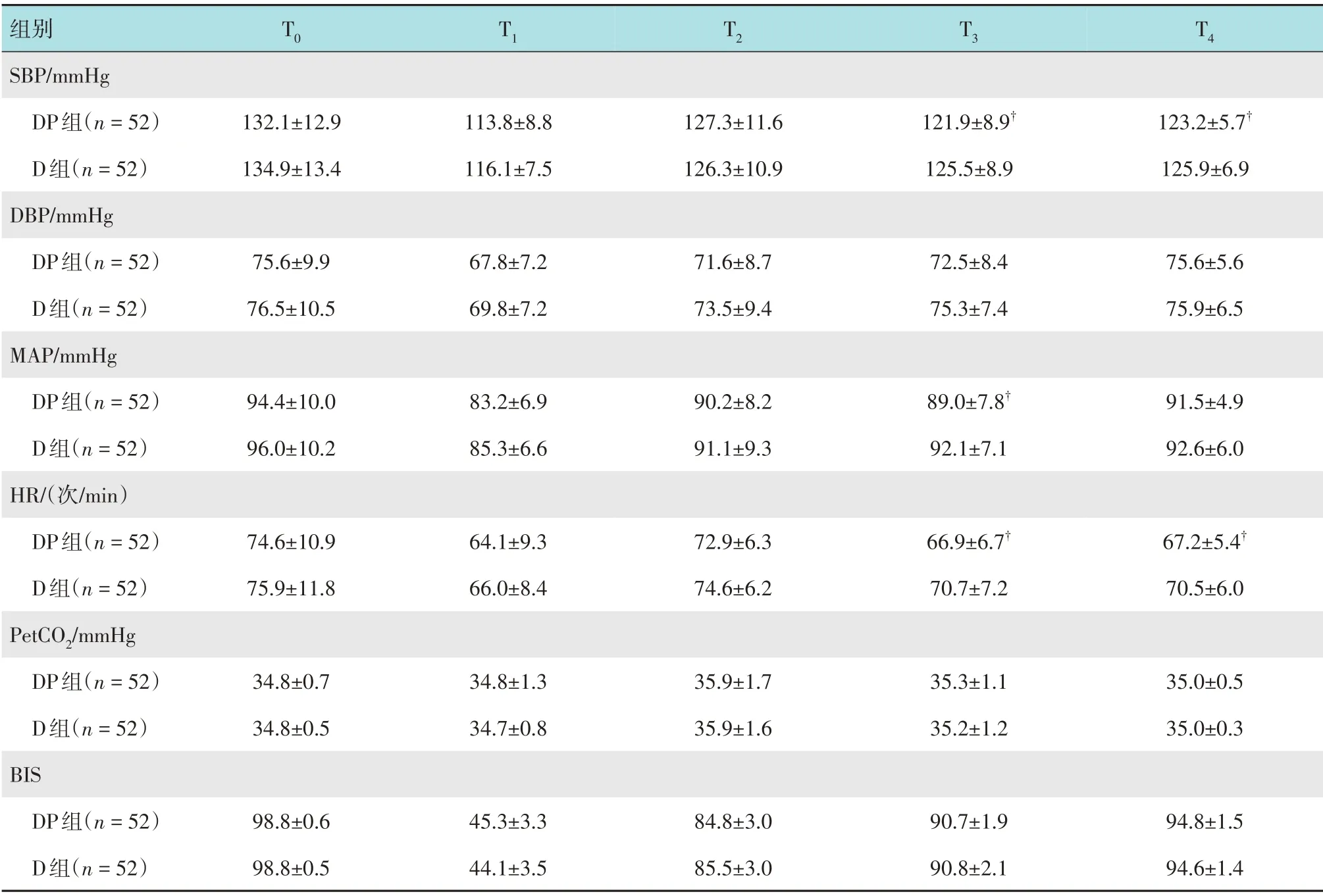
表3 两组患者不同时点血流动力学指标比较 (±s)Table 3 Comparison of hemodynamic indexes at different time points between the two groups (±s)
注:†与D组比较,差异有统计学意义(P <0.05)
组别SBP/mmHg DP组(n=52)D组(n=52)DBP/mmHg DP组(n=52)D组(n=52)MAP/mmHg DP组(n=52)D组(n=52)HR/(次/min)DP组(n=52)D组(n=52)PetCO2/mmHg DP组(n=52)D组(n=52)BIS DP组(n=52)D组(n=52)T0 T1 T2 T3 T4 132.1±12.9 134.9±13.4 113.8±8.8 116.1±7.5 127.3±11.6 126.3±10.9 121.9±8.9†125.5±8.9 123.2±5.7†125.9±6.9 75.6±9.9 76.5±10.5 67.8±7.2 69.8±7.2 71.6±8.7 73.5±9.4 72.5±8.4 75.3±7.4 75.6±5.6 75.9±6.5 94.4±10.0 96.0±10.2 83.2±6.9 85.3±6.6 90.2±8.2 91.1±9.3 89.0±7.8†92.1±7.1 91.5±4.9 92.6±6.0 74.6±10.9 75.9±11.8 64.1±9.3 66.0±8.4 72.9±6.3 74.6±6.2 66.9±6.7†70.7±7.2 67.2±5.4†70.5±6.0 34.8±0.7 34.8±0.5 34.8±1.3 34.7±0.8 35.9±1.7 35.9±1.6 35.3±1.1 35.2±1.2 35.0±0.5 35.0±0.3 94.8±1.5 94.6±1.4 98.8±0.6 98.8±0.5 45.3±3.3 44.1±3.5 84.8±3.0 85.5±3.0 90.7±1.9 90.8±2.1
2.3 两组患者RSAS和VAS比较
DP 组T2和T3时点RSAS 低于D 组[T2时点:(3.6±0.7)和(4.0±0.8)分,T3时点:(3.8±0.4)和(4.0±0.2)分],差异有统计学意义(P<0.05);DP 组术后2、4 和8 h 的VAS 明显低于D 组,差异有统计学意义(P<0.05);两组患者术后12 和24 h 的VAS比较,差异无统计学意义(P>0.05)。见表4。
表4 两组患者不同时点RSAS和VAS比较 (分,±s)Table 4 Comparison of RSAS and VAS at different time points between the two groups (points,±s)

表4 两组患者不同时点RSAS和VAS比较 (分,±s)Table 4 Comparison of RSAS and VAS at different time points between the two groups (points,±s)
RSAS VAS组别T3 DP组(n=52)D组(n=52)t值P值T2 3.6±0.7 4.0±0.8-2.34 0.021 3.8±0.4 4.0±0.2-3.56 0.001术后2 h 0.9±0.8 2.0±0.9-6.29 0.000术后4 h 2.0±0.6 3.8±0.7-13.72 0.000术后8 h 3.5±0.5 4.6±0.6-10.06 0.000术后12 h 3.9±0.6 4.0±0.7-0.60 0.550术后24 h 2.8±0.7 3.0±0.7-1.13 0.269
2.4 两组患者术后不良反应比较
两组患者术后24 h恶心、呕吐、鼻部出血和胃肠不适的发生率比较,差异均无统计学意义(P>0.05)。见表5。
3 讨论
ERAS 的目的为:减少手术创伤,减轻应激反应,降低并发症发生率,促进患者更快恢复。功能性鼻内镜手术具有创伤小和并发症少等优点,已成为慢性鼻窦炎的主要治疗方法,但鼻内镜手术涉及呼吸道,围手术期的气道安全是非常关键的问题。苏醒期躁动是全身麻醉手术后常见的并发症,躁动可能导致气管插管脱出和创面出血,增加误吸甚至窒息的风险。有研究[6]指出,术后疼痛、气管插管和耳鼻喉科手术是苏醒期躁动的危险因素。目前,鼻内镜术后的疼痛管理并不完善[9]。本研究分析鼻内镜手术中静脉注射帕瑞昔布钠联合DEX 对患者苏醒期的影响,结果显示:DP 组苏醒期RSAS 和术后8 h 内VAS 均低于D组(P<0.05)。说明:围手术期联合应用DEX和帕瑞昔布钠相较于单独给予DEX 可以减少苏醒期躁动发生,且术后早期就具有良好的镇痛效果。两组患者拔管时间、出室时间和术后不良反应的发生率比较,差异均无统计学意义。
在鼻窦手术后最初的几个小时内,疼痛最为剧烈,常需全身用药来缓解[10]。疼痛是苏醒期躁动的重要危险因素,良好的镇痛可以降低躁动发生率。鼻内镜术后疼痛可能与以下因素有关:①手术创伤引起炎症因子释放,导致疼痛阈值下调,痛觉敏化;②全身麻醉术中瑞芬太尼的使用引起停药后痛觉过敏;③鼻腔手术后填塞止血引起头痛不适[18]。因此,针对这些因素,减轻手术创伤所致的炎症反应,抑制瑞芬太尼所致的痛觉过敏,均可以减轻鼻内镜手术后的疼痛。鼻内镜术后苏醒期躁动会导致鼻腔出血,增加误吸的风险。因此,术后镇痛药物的选择必须兼顾对呼吸的影响。DEX 具有镇静和镇痛效果,且无呼吸抑制作用,可以通过抑制手术创伤所致的应激反应,减少儿茶酚胺类物质的释放,从而减轻炎症反应,还能通过抑制外周神经系统去甲肾上腺素释放与促进中枢神经系统去甲肾上腺素释放,让大脑接受的伤害性刺激信号减少,起到调节疼痛信号传导的作用[19]。DEX还可通过抑制P物质的产生来抑制疼痛信号的传导,改善瑞芬太尼所致的痛觉过敏[20]。但术中持续泵注DEX直至手术结束,可能延长拔管时间和出室时间[21],而且DEX 的半衰期约为2 h,术后镇痛作用可能不足。NSAID药物镇痛、抗炎和抑制应激作用确切,且无阿片类药物成瘾和呼吸抑制等副作用,在围手术期具有重要作用。目前,以NSAID 为基础,减少阿片类药物使用的多模式镇痛方案已成为ERAS疼痛管理中的主流趋势[22]。NSAID通过抑制COX的活性,减少前列腺素的合成与聚集,产生镇痛作用。前列腺素可促进炎症反应,敏化外周感受器,促进中枢系统对疼痛的敏感性。非选择性NSAID 对COX-1 和COX-2 均有抑制作用,而COX-1 的主要作用是保护消化道黏膜,防止血小板聚集,对维持机体自稳态有重要作用。非选择性NSAID在产生镇痛作用的同时,常伴随明显的胃肠道不适等副作用。有研究[23]表明,非选择性NSAID 在脑脊液中的浓度不到血浆浓度的1%~5%,难以直接抑制中枢敏化,而选择性NSAID具有作用时间长、胃肠道副作用小和易透过血脑屏障等优点。帕瑞昔布钠是一种特异性COX-2抑制剂,静脉注射后快速转换为具有镇痛效果的伐地昔布,可通过抑制外周和中枢COX-2表达,减少外周前列腺素的合成,从而减轻炎症,防止外周及中枢敏化,发挥镇痛作用。有研究[24]表明,围术期超前镇痛给予帕瑞昔布钠,可以明显降低短期内VAS,且不增加并发症发生率。
本研究中,DP组T2和T3时点RSAS以及T3和T4时点的SBP 和HR 均低于D 组,表明:苏醒期良好的镇痛有利于降低躁动评分,维持更稳定的血流动力学水平。患者安静配合的状态,有利于麻醉医生各项全身麻醉复苏措施的实施,降低坠床和窒息等不良事件的发生率。因此,DP 组从手术结束到出手术室(Steward 评分>4 分)的时间更短。DP 组术后8 h 内疼痛程度明显轻于D组,表明:术中提前静注帕瑞昔布钠对于术后早期镇痛具有良好的效果。两组患者术后12 和24 h 疼痛程度及术后24 h 并发症(恶心、呕吐、鼻部出血和胃肠道不适)发生率比较,差异均无统计学意义,表明:在鼻内镜手术中,单次静注帕瑞昔布钠并没有对患者的血小板及凝血功能造成影响,且不会损伤胃肠道功能。多数研究[5,18]均在手术开始前进行超前镇痛,但MØINICHE等[25]认为,在皮肤切开前先行镇痛没有优越性。帕瑞昔布钠静脉注射后,可以快速转化为具有镇痛作用的伐地昔布,在注射后0.43 h伐地昔布达到最大血药浓度,其消除半衰期为7.81 h[26]。本研究中,于手术结束前30 min 停止输注DEX,同时静脉注射帕瑞昔布钠40 mg,既保证了手术结束时帕瑞昔布钠能起到良好的镇痛效果,又缩短了拔管时间(DEX 会导致拔管时间延长)。有研究[15]表明,单次静脉注射40 mg帕瑞昔布钠,其镇痛效果优于4 mg吗啡,并且可以延长补救用药的起效时间,甚至可避免阿片类药物的使用。阿片类药发生副作用的风险高,如恶心、呕吐、头晕和呼吸抑制等。疼痛管理中减少术后阿片类药物的使用是必要的,特别是对于涉及呼吸道的手术更应该慎重。帕瑞昔布钠无阿片类药物类似的副作用。因此,在使用阿片类药物治疗的同时或之后,给予帕瑞昔布钠可能会使患者获得更多益处[13]。此外,本研究通过Steward 苏醒评分对患者出室情况进行评估,确保患者在T4时点具备良好的气道保护能力。
本研究存在一些局限性:①帕瑞昔布钠联合DEX 能够减少苏醒期躁动,但未对单独应用帕瑞昔布钠的情况进行讨论,虽然有相关研究[5]证实鼻内镜手术中应用NSAID 可以减轻躁动程度,但是帕瑞昔布钠的作用有待进一步研究;②术后镇痛仅进行了疼痛评分,未记录解决术后疼痛的补救措施,不良反应的发生可能与术后补救措施混杂有关,且本研究只随访到术后24 h,随访时间偏短。有待将来在完善对照组的情况下,延长随访时间,完善相关记录,为临床用药提供更好的参考依据。
综上所述,帕瑞昔布钠联合DEX 可以减少苏醒期躁动,在术后早期提供良好的镇痛,为鼻内镜手术苏醒期管理提供了新的参考方案。

