不同干燥方法对枸杞子药材多类型功效成分的影响及其分析评价
吴励萍,卢有媛, 2,李海洋,钱大玮,段 然,鲁学军,郭 盛,段金廒
不同干燥方法对枸杞子药材多类型功效成分的影响及其分析评价
吴励萍1,卢有媛1, 2,李海洋1,钱大玮1,段 然3,鲁学军3,郭 盛1*,段金廒1*
1. 南京中医药大学 江苏省中药资源产业化过程协同创新中心 中药资源产业化与方剂创新药物国家地方联合工程研究中心 国家中医药管理局中药资源循环利用重点研究室,江苏 南京 210023 2. 宁夏医科大学药学院,宁夏 银川 750021 3. 宁夏枸杞创新中心,宁夏 银川 750002
通过多类型功效物质的分析比较,为优化建立适宜的枸杞子干燥加工方法提供科学依据。采用不同温度烘干、红外干燥、微波干燥、真空冷冻干燥等干燥技术对枸杞子鲜果进行干燥加工,分别采用紫外分光光度法测定总酚、总黄酮、中性多糖、酸性多糖及总色素含量,HPLC法测定玉米黄素、隐黄素、胡萝卜素、玉米黄素双棕榈酸酯含量,HPLC-ELSD法测定4种单寡糖(果糖、葡萄糖、麦芽糖、蔗糖)及甜菜碱含量,UPLC-TQ/MS法测定36种核苷类及游离氨基酸类成分的组成及含量,并分析不同干燥方法对枸杞子各功效成分含量的影响。以上述多类型功效成分为评价指标,利用TOPSIS法进行综合分析评价,以客观反映经不同干燥加工方法所得枸杞子药材的品质。不同干燥方式处理后的枸杞子各种功效成分含量差异较大,其中总多糖、总酚、总黄酮、总色素、甜菜碱、总单寡糖质量分数分别为29.29~47.48、9.61~20.69、4.84~9.59、4.90~7.07、14.53~18.92、641.05~780.56 mg/g。脱蜡处理对枸杞子的影响研究结果显示,以未经脱蜡的枸杞子品质更佳;干燥温度对枸杞子中多糖、总酚、总黄酮、核苷类及氨基酸类组分含量影响较大,综合评价分析结果显示,(40+60)℃是热风干燥的最佳温度;核苷类和氨基酸类成分总量以真空冷冻干燥处理的枸杞子最高,脱蜡后40 ℃热风干燥核苷类总量最低,(40+80)℃热风干燥氨基酸类成分总量最低。通过对9种不同现代干燥方式获得的枸杞子样品进行综合评价分析,发现真空冷冻干燥法为枸杞子最佳干燥方式,其次为微波干燥和(40+60)℃热风干燥。真空冷冻干燥法最大限度地保留了枸杞子所含有的多类型功效成分,为该药材最佳干燥方式,其次为微波干燥和(40+60)℃热风干燥方法。研究结果为优化建立适宜的枸杞子干燥加工方法提供了科学依据。
枸杞子;干燥方法;药材品质;分析评价;玉米黄素;隐黄素;胡萝卜素;总多糖;总酚;总黄酮;总色素
枸杞子为茄科植物宁夏枸杞L.的干燥成熟果实,是常用的药食两用药材和食材,具有无可替代的药用价值和保健功能,以及广大的消费群体和广阔的市场潜力[1]。传统中医药理论认为枸杞子具有滋补肝肾、益精明目、滋阴润肺的功效,常用于因肝肾亏虚所致的腰膝酸软、眩晕耳鸣、视物昏花等病症[2]。现代研究表明,枸杞子主要含有枸杞多糖类、单寡糖类、甜菜碱等有机碱类,芦丁等黄酮和酚酸类,玉米黄素双棕榈酸酯等枸杞色素类,以及核苷酸类和氨基酸类等多类型化学成分,为枸杞子多元功效提供了物质基础[2-5]。现代药理与生物活性评价证实枸杞子具有确切的肝脏、肾脏等多脏器功能保护修复作用,具有机体和细胞水平的抗氧化、抗衰老、抗肿瘤、调血糖、增强免疫作用,以及保护视力、防治年龄相关性黄斑及视网膜病变、防治老年痴呆等作用[6-11]。
枸杞子鲜果为高含水和高糖分的浆果,肉质细腻易破损,故需及时干燥处理以有利于保存与流通。目前枸杞子的干燥方式多种多样,茨农常采取将采收后的鲜果置于日光下晒干的传统方式,产业化枸杞生产基地则已实现规范化规模化的机械干燥加工方式,常用干燥模式为程序升温烘干、红外干燥、微波干燥、冷冻干燥等[12-13]。但不同加工方式在干燥加工过程中存在着酶的灭活(杀青)、物质的转化以形成风味和增强药性或减弱其偏性,并将含水量控制在有利于药材的贮藏和流通等状态[14],也由此造成了因加工方式和工艺条件的差别制约着药材品质的标准化和不稳定[15]。基于此,本研究较为系统的分析评价了不同干燥加工模式下对枸杞子药材多元功效物质的影响,以期为优选和建立适宜的枸杞子现代干燥方式提供科学依据。
1 仪器与试剂
1.1 仪器
DHG-9140A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);中短波红外干燥机(江苏泰州圣泰科红外科技有限公司);隧道式微波干燥机(南京研正微波设备厂);ML204、MS105型电子分析天平(梅特勒-托利多仪器有限公司);真空冷冻干燥机(Labconco公司);G-9双光路紫外扫描仪(南京菲勒仪器有限公司);多功能酶标仪(Perkin Elmer公司);Microfuge 22R Centrifuge离心机(美国Beckman Coulter公司);HH-6数显恒温水浴锅(常州国华电器有限公司);Milli-Q Advantage超纯水系统(Millipore公司);EPED超纯水器(南京易普易达科技发展有限公司);Waters 2695高效液相色谱仪(包括Waters 2424蒸发光散射检测器(ELSD)、Empower 2色谱工作站,Waters公司)、AB SCIEX 6500 plus三重四级杆质谱仪(AB Sciex公司)。
1.2 试药
正己烷、丙酮、无水乙醚购于国药集团化学试剂有限公司;无水乙醇、氢氧化钠、无水碳酸钠购于南京化学试剂有限公司;浓硫酸、四硼酸钠购于上海凌峰化学试剂有限公司;硝酸铝、亚硝酸钠购于上海新宝精细化工厂;苯酚、咔唑、福林酚购于上海麦克林生化科技有限公司,均为分析纯;乙腈为色谱纯,购于德国默克公司;甲基叔丁基醚和甲醇为色谱纯,购于美国天地公司。对照品详细信息见表1,质量分数均大于98%。
表1 对照品基本信息
Table 1 Basic information of reference substances
编号化合物名称批号来源编号化合物名称批号来源 1玉米黄素KJ0618SA14南京森贝伽生物科技有限公司25β-隐黄素B21978上海源叶生命科技有限公司 2玉米黄素双棕榈酸酯Z08M10H82528上海源叶生命科技有限公司263′5′-环磷酸鸟苷SLBQ6711V美国Sigma公司 3葡萄糖醛酸lw17111511南京良纬生物科技有限公司27次黄嘌呤101K0022美国Sigma公司 4麦芽糖MYT20160918南京春秋生物有限公司28胞嘧啶SLBB2312V美国Sigma公司 5果糖lw161129005南京良纬生物科技有限公司29鸟苷119K15841V美国Sigma公司 6蔗糖ZT20161125南京春秋生物有限公司30腺苷A9251美国Sigma公司 7尿苷U3750美国Sigma公司31肌苷086K1243美国Sigma公司 8无水葡萄糖1122A0218北京索莱宝科技有限公司32尿嘧啶31233阿拉丁试剂公司 9β-胡萝卜素412B021北京索莱宝科技有限公司33胸苷1001182663美国Sigma公司 10芦丁1w18012501南京良纬生物科技有限公司34胞苷0001446223美国Sigma公司 11没食子酸lw17060504南京良纬生物科技有限公司35γ-氨基丁酸BCBD3661V美国Sigma公司 122′-脱氧肌苷L1224040阿拉丁试剂公司36谷氨酰胺BCBC6452V美国Sigma公司 13天冬酰胺021M5416V美国 Sigma 公司372′-脱氧尿苷101144695美国Sigma公司 14甲硫氨酸C11385354上海麦克林生化科技有限公司38酪氨酸20120204中国惠兴生化试剂有限公司 15亮氨酸C11495324上海麦克林生化科技有限公司39苯丙氨酸20090316中国惠兴生化试剂有限公司 16色氨酸20090310中国惠兴生化试剂有限公司40脯氨酸20080616中国惠兴生化试剂有限公司 17缬氨酸20090318中国惠兴生化试剂有限公司41谷氨酸20090316中国惠兴生化试剂有限公司 18赖氨酸C10914803上海麦克林生化科技有限公司42精氨酸110626中国惠兴生化试剂有限公司 19羟脯氨酸150826中国惠兴生化试剂有限公司43苏氨酸20080616中国惠兴生化试剂有限公司 20丝氨酸20080219中国惠兴生化试剂有限公司44瓜氨酸BCBC7694美国Sigma公司 21天冬酰胺C11656840上海麦克林生化科技有限公司45腺嘌呤A8626美国Sigma公司 22鸟嘌呤Y09M8C30835上海源叶生命科技有限公司462′-脱氧胞苷ZJ0620WA14上海源叶生命科技有限公司 23异亮氨酸C11435950上海麦克林生化科技有限公司472′-脱氧鸟苷N07AW12580上海源叶生命科技有限公司 24谷氨酰胺BCBC6452V美国 Sigma 公司48γ-氨基丁酸BCBD3661V美国Sigma公司
1.3 材料
枸杞子鲜果于2019年8月1日采于宁夏回族自治区中卫市中宁县,经南京中医药大学段金廒教授鉴定为茄科植物宁夏枸杞L.的成熟果实。
2 方法与结果
2.1 干燥加工
随机取枸杞子鲜果约2.0 kg,清水冲洗后随机分为9份,采用热风干燥法(N1~N3)进行干燥加工,待水分低于13.0%,终止干燥。每个处理平行做3份样品。
枸杞子鲜果约4.0 kg,经3% Na2CO3漂洗,随机分为18份,分别采用热风干燥(N4~N6)、红外干燥(N7)、微波干燥(N8)和真空冷冻干燥法(N9)干燥至水分低于13%。每个处理平行做3份样品。
N1~N9干燥加工方法见表2。
2.2 多糖类组分的分析
2.2.1 对照品溶液的制备 精密称定葡萄糖、葡萄糖醛酸对照品22.05、11.34 mg于100 mL量瓶中,加入适量纯水溶解,定容至刻度线,摇匀,分别得到质量浓度为0.220 5 mg/mL和0.113 4 mg/mL的葡萄糖和葡萄糖醛酸对照品溶液。
2.2.2 标准曲线的绘制 葡萄糖标准曲线的绘制:参照《中国药典》方法[16],采用苯酚-浓硫酸法,于紫外分光光度计490 nm波长处测定吸光度。以吸光度为纵坐标(),无水葡萄糖浓度为横坐标(),得到标准曲线,回归方程为=7.31+0.055,2=0.998 8,在质量浓度为0~0.110 3 mg/mL内线性良好。
表2 枸杞子加工干燥方法
Table 2 Different drying methods of Lycii Fructus samples
编号名称干燥加工方法 N140 ℃热风干燥热风干燥,温度40 ℃ N2(40+60)℃热风干燥热风干燥,温度40 ℃至枸杞子表皮皱缩后升温至60 ℃ N3(40+80)℃热风干燥热风干燥,温度40 ℃至枸杞子表皮皱缩后升温至80 ℃ N4脱蜡后40 ℃热风干燥热风干燥,温度40 ℃ N5脱蜡后(40+60)℃热风干燥热风干燥,温度40 ℃至枸杞子表皮皱缩后升温至60 ℃ N6脱蜡后(40+80)℃热风干燥热风干燥,温度40 ℃至枸杞子表皮皱缩后升温至80 ℃ N7红外干燥中短波红外干燥,温度40 ℃至枸杞子表皮皱缩后升温至60 ℃ N8微波干燥微波干燥,温度40 ℃至枸杞子表皮皱缩后升温至60 ℃ N9真空冷冻干燥真空冷冻干燥,温度−80 ℃,真空度−0.08 MPa
葡萄糖醛酸标准曲线的绘制:参照文献方法[17],采用咔唑-硫酸法,于紫外分光光度计512 nm波长处测定吸光度。以吸光度为纵坐标(),葡萄糖醛酸浓度为横坐标(),得到标准曲线,回归方程为=5.89+0.056,2=0.998 3,在质量浓度为0~0.113 4 mg/mL内线性良好。
2.2.3 测定方法 参照文献中多糖提取、测定方法[17],取各样品粉末约0.5 g,精密称定,置于100 mL锥形瓶中,加入乙醚40 mL,静置20 min后超声(40 kHz)提取60 min,小心弃去乙醚液,再置于水浴上将乙醚挥尽。加入80%乙醇20 mL,超声(40 kHz)提取60 min,趁热滤过。用80%乙醇洗涤滤渣和锥形瓶,将滤渣连同滤纸置于锥形瓶中,精密加入纯水50 mL,水浴2 h后取出,80 ℃超声(40 kHz)提取60 min。取出后离心(8000 r/min、6 min),取上清液,即得供试品溶液。
中性多糖测定:精密量取供试品溶液0.5 mL,置于2 mL量瓶中,加纯水至刻度,摇匀,照葡萄糖标准曲线制备项下的方法,依法测定吸光度,中性多糖含量以葡萄糖计。
酸性多糖测定:精密量取供试品溶液0.8 mL,置于2 mL量瓶中,加纯水至刻度,摇匀,照酸性多糖标准曲线的制备的方法,依法测定吸光度。酸性多糖以葡萄糖醛酸计。
2.2.4 总多糖含量分析结果 不同干燥加工处理后枸杞子中中性多糖、酸性多糖及总多糖含量见图1。方差分析结果显示,不同干燥加工后枸杞子中总多糖、中性多糖和酸性多糖含量存在显著差异(<0.05)。总多糖质量分数为29.29~47.48 mg/g,其中红外干燥(N7)后的枸杞子总多糖含量为最高,达47.48 mg/g。(40+60)℃热风干燥组(N2)总多糖最低,仅为29.29 mg/g。枸杞子中中性多糖含量高于酸性多糖,分别为2.16%~3.57%和0.77%~1.81%,其中中性多糖以红外干燥(N7)最高(35.68 mg/g),酸性多糖以脱蜡后40 ℃热风干燥(N4)为最高(18.05 mg/g)。烘干、微波、红外干燥等方法干燥后多糖含量较真空冷冻干燥处理组高,其原因可能是在适宜温度条件下促进了淀粉等转换为多糖及单糖的聚合。比较未脱蜡热风干燥(N1~N3)和脱蜡后热风干燥(N4~N6)对枸杞子中多糖含量影响,结果显示,脱蜡后40 ℃(N4)、(40+60)℃热风干燥组(N5)多糖类含量均高于同温度未脱蜡组。枸杞子多糖含量的变化可能与干燥温度、时间相关,在较低温度(40、60 ℃)下,脱蜡处理明显缩短了干燥时间,减少了多糖成分的损失,故其多糖含量高于未脱蜡组。枸杞子多糖具有抗氧化、降血糖、调血脂、免疫调节等作用,是枸杞子发挥药效的重要物质基础[18-19],而(40+60)℃不脱蜡组(N2)中性多糖和酸性多糖含量均为最低,为保障药材品质,建议适度使用脱蜡剂,以提高干燥效率,提高药材品质。
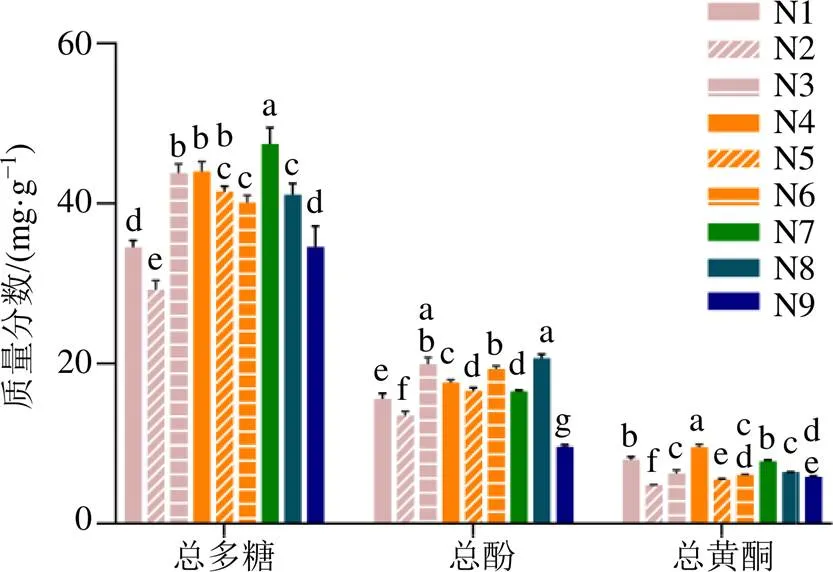
Duncan′s 多重比较,同一化学成分相同的字母代表不存在显著差异(P<0.05),下同
2.3 总酚的分析
2.3.1 对照品溶液的制备 取没食子酸对照品适量于量瓶中,加80%乙醇溶解并定容,配制得到质量浓度为1.070 mg/mL的没食子酸对照品溶液,备用。
2.3.2 标准曲线的制备 参照文献方法[17],采用福林酚法,采用紫外分光光度计,于760 nm处测定吸光度。以没食子酸质量浓度为横坐标(),吸光度为纵坐标(),得到标准曲线回归方程为=3.34+0.059,2=0.996 5,在质量浓度为0~0.267 5 mg/mL内线性良好。
2.3.3 测定方法 参照文献方法[17],取样品粉末0.3 g,精密称定,置具塞锥形瓶中,精密加入80%乙醇25 mL,静置30 min,50 ℃超声(40 kHz)处理40 min,离心,取上清液,即得供试品溶液。精密量取供试品溶液0.1 mL,加水0.9 mL后照“2.3.2”项下的方法,自“各加入福林酚溶液0.1 mL”起,依法测定吸光度。
2.3.4 总酚含量分析结果 不同干燥加工处理后枸杞子中总酚含量见图1。以微波干燥组(N8)、40+80 ℃热风干燥组(N3)和脱蜡后(40+60)℃热风干燥组(N5)含量较高,分别为20.69、19.91和19.30 mg/g;真空冷冻干燥组(N9)含量最低,仅为9.61 mg/g。
比较脱蜡和未脱蜡处理及不同温度对枸杞子干燥后总酚含量影响,结果显示:在较低干燥温度[40 ℃、(40+60)℃]脱蜡处理后枸杞子中总酚含量显著高于未脱蜡处理组(<0.05),在较高温度(40+80)℃条件下,2种处理方法对枸杞子中总酚含量无显著影响,且均高于低温处理组。其可能原因为,脱蜡剂的使用更利于枸杞子中水分的挥发,减少了酚类成分的降解;较高温度对蜡被具有一定的破坏作用,且可以使部分酶失活,从而降低酚类成分的降解。
2.4 总黄酮的分析
2.4.1 对照品溶液的制备 称取芦丁对照品10.0 mg精密称定,置于5 mL量瓶中,加入80%乙醇适量溶解,定容至刻度,即得2.000 mg/mL芦丁对照品溶液。
2.4.2 标准曲线的绘制 参照文献方法[17],采用NaNO2-Al(NO3)3-NaOH显色法,采用紫外分光光度计法,在510 nm处测定吸光度。以吸光度为纵坐标(),芦丁质量浓度为横坐标(),计算标准曲线回归方程为=3.79+0.045,2=0.997 4,在质量浓度为0~0.200 0 mg/mL内线性良好。
2.4.3 测定方法 参照文献方法[17],精密量取供试品溶液2.0 mL,照芦丁标准曲线绘制方法,依法测定吸光度。
2.4.4 总黄酮含量分析结果 不同干燥加工处理后枸杞子中总黄酮量见图1。脱蜡后40 ℃热风干燥组(N4)质量分数最高,为9.59 mg/g;40 ℃热风干燥组(N1)和红外干燥组(N7)次之;真空冷冻干燥组总黄酮量较低,为5.86 mg/g。
比较脱蜡处理和未脱蜡处理对枸杞子中总黄酮含量的影响,其结果与总酚变化趋势一致,均表现为较低温条件下40 ℃和(40+60)℃脱蜡处理黄酮含量显著高于未脱蜡处理(<0.05),高温条件(40+80)℃下二者无显著差异。
对比不同温度对枸杞子中总黄酮含量的影响,脱蜡组和未脱蜡组均呈现为低温条件(40 ℃)枸杞子中总黄酮含量较高,提示烘干时适度降低温度更利于黄酮类成分的保留。
2.5 色素类成分的分析
2.5.1 总色素测定
(1)对照品溶液的制备:取β-胡萝卜素对照品适量,精密称定,置于量瓶中,加入丙酮适量溶解,定容,摇匀,即得质量浓度为0.184 1 mg/mL β-胡萝卜素对照品溶液,逐级稀释,配制不同质量浓度的混合对照品溶液,备用。
(2)标准曲线的绘制:以吸光度为纵坐标(),β-胡萝卜素质量浓度为横坐标(),得到标准曲线回归方程为=121.14+0.007 6,2=0.999 9,在质量浓度为2.453~6.133 μg/mL内线性良好。
(3)测定方法:参照文献方法[17],取各样品粉末约0.5 g,精密称定,精密加入正己烷-乙醇-丙酮(2∶2∶1)的混合溶液40 mL,30 ℃超声(40 kHz)提取40 min,离心浓缩(35 ℃)至干,精密加入甲基叔丁基醚-丙酮(1∶1)混合溶液3 mL溶解,即得。取供试品溶液,稀释50~150倍后在紫外分光光度计450 nm下测定吸光度。
2.5.2 类胡萝卜素类成分含量分析
(1)色谱条件:参照文献色谱条件[17],色谱柱YMC HPLC C30(150 mm×4.6 mm,3 μm,日本YMC公司),流动相为甲醇-甲基叔丁基醚-水(81∶15∶4,A)与甲醇-甲基叔丁基醚-水(16∶80∶4,B),梯度洗脱,0~7 min,20%~50% B;7~19 min,50%~78% B;19~22 min,78% B;22~37 min,78%~100% B;柱温25 ℃;体积流量0.4 mL/min;进样量2.0 μL和10.0 μL,检测波长450 nm。
(2)标准曲线的制备:配制玉米黄素、β-胡萝卜素、玉米黄素双棕榈酸酯、β-隐黄素质量浓度分别为0.028 29、0.018 40、0.591 4、0.008 571 mg/mL混合标准溶液,采用HPLC法测定,得到玉米黄素标准曲线回归方程为=9.84×104+13 465,2=0.999 2,在质量浓度为0.883 9~28.29 μg/mL内线性良好;β-胡萝卜素标准曲线回归方程为=1.09×105+1.43×104,2=0.999 3,在质量浓度为0.143 8~9.200 μg/mL内线性良好;玉米黄素双棕榈酸酯标准曲线回归方程为=1.18×105+9.43×105,2=0.999 4,在质量浓度为9.241~591.4 μg/mL内线性良好;β-隐黄素标准曲线回归方程为=1.52×105+451.92,2=0.999 3,在质量浓度为0.066 96~1.071 μg/mL内线性良。。
(3)测定方法:取“2.4.1”项下供试品溶液,注入HPLC-DAD测定,得出各样品中玉米黄素、β-胡萝卜素、玉米黄素双棕榈酸酯、β-隐黄素含量。
2.5.3 色素类成分分析结果 不同干燥加工处理后枸杞子中类胡萝卜素类含量见图2。总类胡萝卜素含量(40+60)℃热风干燥组(N2)显著高于其他组(<0.05),达7.07 mg/g;脱蜡处理组(N4~N6)、红外干燥组(N7)、微波干燥组(N8)和40 ℃热风干燥组(N1)次之。
不同干燥加工处理后各组间类胡萝卜素单体含量变化趋势存在差异。玉米黄素以红外干燥最高(N7,0.39 mg/g),真空冷冻干燥(N9)最低(0.09 mg/g);隐黄素以脱蜡后(40+80)℃热风干燥(N6)最高,为0.005 1 mg/g,真空冷冻干燥组(N9)最低,为0.001 4 mg/g;β-胡萝卜素含量以真空冷冻干燥(N9)最高(0.060 mg/g),微波干燥(N8)最低(0.028 mg/g);玉米黄素双棕榈酸酯含量以微波干燥(N8)最高(3.49 mg/g),真空冷冻干燥(N9)最低(1.55 mg/g)。

图2 不同干燥方式枸杞子中色素类成分含量测定结果
比较脱蜡剂和干燥温度对枸杞中类胡萝卜素类含量的影响,结果显示,脱蜡组(N4~N6)总类胡萝卜素含量受温度影响较小,不同温度处理组间无显著差异,且含量仅次于未脱蜡组(40+60)℃干燥组(N2);玉米黄素双棕榈酸酯随干燥温度升高呈增加趋势,其余单体成分含量因温度不同而存在差异。未脱蜡组(N1~N3)各组间总类胡萝卜素含量存在显著差异(<0.05);玉米黄素、β-隐黄素和β-胡萝卜素随温度升高呈降低趋势,玉米黄素双棕榈酸酯则表现出随温度升高呈升高趋势。其可能原因为蜡被的存在影响枸杞子各部位受热均匀度,进而影响其类胡萝卜素含量。
2.6 单寡糖类及甜菜碱的分析
2.6.1 色谱条件 参照文献色谱条件[20],色谱柱Prevail Carbohydrate ES(250 mm×4.6 mm,5 μm),流动相水(A)-乙腈(B),梯度洗脱,0~12 min,85%~70% B;12~20 min,70%~50% B;柱温30 ℃;体积流量1.0 mL/min;进样量10.0 μL。ELSD检测器条件:漂移管温度50 ℃,气体体积流量2.7 L/min。
2.6.2 标准曲线的制备 配制5.120 mg/mL葡萄糖、4.985 mg/mL果糖、0.556 8 mg/mL麦芽糖、0.561 9 mg/mL蔗糖、0.358 2 mg/mL甜菜碱混合对照品溶液,逐级稀释,采用HPLC-ELSD测定。以葡萄糖、果糖、麦芽糖、蔗糖浓度对数值为横坐标(),其峰面积对数值为纵坐标(),绘制标准曲线。得到葡萄糖标准曲线回归方程为=1.68+1.99,2=0.999 9,在质量浓度为436.4~5 120 μg/mL内线性良好;果糖标准曲线回归方程为=1.70+2.33,2=0.999 9,在质量浓度为566.5~4 985 μg/mL内线性良好;麦芽糖标准曲线回归方程为=1.47+6.01,2=0.998 0,在质量浓度为34.80~556.8 μg/mL内线性良好;蔗糖标准曲线回归方程为=1.60+5.89,2=0.999 4,在质量浓度为35.12~561.9 μg/mL内线性良好;甜菜碱标准曲线回归方程为=1.68+5.70,2=0.999 8,在质量浓度为22.39~358.2 μg/mL内线性良好。
2.6.3 测定方法 参照课题组前期研究及文献方法[20],称取样品粉末约0.5 g,精密称定。精密加入纯水30 mL,密塞,称定质量,50 ℃超声(40 kHz)处理60 min,放冷,再称定质量,用纯水补足减失的质量,离心(1300 r/min,10 min)后取上清液,即得供试品溶液。采用HPLC-ELSD测定,计算各供试品溶液中单寡糖、甜菜碱浓度,得出各样品中葡萄糖、果糖、蔗糖、麦芽糖、甜菜碱含量。
2.6.4 甜菜碱含量分析结果 不同干燥加工处理后枸杞子中甜菜碱含量见图3。(40+80)℃热风干燥(N3)处理后枸杞子中甜菜碱含量显著高于其余组(<0.05),达到18.92 mg/g。微波干燥(N8)、真空冷冻干燥(N9)后枸杞子中甜菜碱含量较低,分别为16.85 mg/g和14.53 mg/g。说明微波干燥和真空冷冻干燥不利于甜菜碱类成分的保留。
比较脱蜡和未脱蜡处理及干燥温度对枸杞子中甜菜碱含量影响,结果显示,脱蜡处理后各温度处理对枸杞子中甜菜碱含量影响较小,其含量相对稳定,仅次于未脱蜡处理(40+80)℃热风干燥组。未脱蜡不同温度处理组间甜菜碱含量差异较大,随温度升高呈递增趋势。

图3 不同干燥方式枸杞子中单寡糖类及甜菜碱成分含量测定结果
2.6.5 单寡糖类成分含量分析结果 不同干燥加工处理后枸杞子中单寡糖含量见图3。枸杞子中单寡糖成分主要为果糖、葡萄糖、麦芽糖、蔗糖,其中果糖、葡萄糖含量远高于麦芽糖和蔗糖,两者约占总单寡糖的95%。不同方法干燥后枸杞子总单寡糖质量分数为641.05~780.56 mg/g,其中葡萄糖含量差异较大,质量分数范围为266.67~383.60 mg/g,而果糖(346.20~383.92 mg/g)、蔗糖(17.39~23.48 mg/g)、麦芽糖(6.29~8.19 mg/g)质量分数差异较小。比较不同温度及脱蜡处理的结果,发现脱蜡与温度对单寡糖类成分的影响较小,未见明显变化。
2.7 核苷、氨基酸类成分含量分析
2.7.1 色谱条件 参照文献色谱条件[21-22],Waters Acquity UPLC系统,采用ACQUITY UPLC BEH Amide色谱柱(100 mm×2.1 mm,1.7 μm),流动相A为含0.15%甲酸和10 mmol/L甲酸铵的水溶液,B为含0.05%甲酸和2 mmol/L甲酸铵的乙腈溶液,梯度洗脱(0~3 min,10% A;3~9 min,10%~18% A;9~15 min,18%~20% A;15~16 min,20%~46% A;16~18 min,46% A);体积流量0.4 mL/min,进样量1 μL,柱温30 ℃。
2.7.2 质谱条件 参照文献质谱方法[21-22],采用AB SCIEX 6500 plus三重四级杆质谱仪,电喷雾离子源(ESI)正离子扫描模式,多反应监测(MRM)检测。毛细管电压3.0 kV,离子源温度120 ℃,脱溶剂气温度550 ℃;脱溶剂气流量1000 L/h;锥孔气流量50 L/h;碰撞气流量0.15 mL/min。具体质谱检测参数参照文献方法[22]设置。
2.7.3 对照品溶液制备 精密称取核苷酸及氨基酸对照品适量,加超纯水定容,配成质量浓度分别尿苷(0.125 mg/mL)、次黄嘌呤(0.126 mg/mL)、胞嘧啶(0.103 mg/mL)、鸟苷(0.113 mg/mL)、腺苷(0.105 mg/mL)、肌苷(0.085 mg/mL)、尿嘧啶(0.094 mg/mL)、胸苷(0.090 mg/mL)、胞苷(0.105 mg/mL)、腺嘌呤(0.111 mg/mL)、鸟嘌呤(0.098 mg/mL)、黄嘌呤(0.082 mg/mL)、2′-脱氧腺苷(0.094 mg/mL)、2′-脱氧鸟苷(0.088 mg/mL)、2′-脱氧尿苷(0.127 mg/mL)、2′-脱氧胞苷(0.118 mg/mL)、3′5′-环磷酸鸟苷(0.105 mg/mL)、γ-氨基丁酸(0.114 mg/mL)、谷氨酰胺(0.083 mg/mL)、天冬酰胺(0.143 mg/mL);甲硫氨酸(0.102 mg/mL)、酪氨酸(0.092 mg/mL)、亮氨酸(0.095 mg/mL)、苯丙氨酸(0.092 mg/mL)、色氨酸(0.095 mg/mL)、脯氨酸(0.111 mg/mL)、缬氨酸(0.103 mg/mL)、谷氨酸(0.094 mg/mL)、赖氨酸(0.111 mg/mL)、精氨酸(0.097 mg/mL)、羟脯氨酸(0.126 mg/mL)、苏氨酸(0.104 mg/mL)、丝氨酸(0.093 mg/mL)、瓜氨酸(0.104 mg/mL)、天冬氨酸(0.093 mg/mL)的混合对照品溶液。
2.7.4 供试品溶液制备 参照文献方法[20],取本品粉末约0.5 g,精密称定,置于50 mL锥形瓶中,精密加入纯水20 mL,称定质量,浸泡1 h,超声(40 kHz)处理45 min,再称定质量,用纯水补足减失的质量,摇匀,离心,取上清液即得供试品溶液。
2.7.5 标准曲线的绘制 取各对照品溶液以质量浓度为横坐标(),以峰面积为纵坐标(),绘制标准曲线,结果见表3。
表3 对照品线性关系
Table 3 Linear relation of reference substances
对照品标准曲线回归方程R2线性范围/(μg·mL−1)对照品标准曲线回归方程R2线性范围/(μg·mL−1) 天冬氨酸Y=7.02×104 X+198.08 0.994 43.88~93.00异亮氨基酸Y=2.97×106 X+2.90×1050.999 70.94~15.00 尿苷Y=3.62×105 X+31 296 0.999 31.30~20.83次黄嘌呤Y=8.74×106 X+5.41×1030.999 60.000 38~0.002 40 胞嘧啶Y=1.36×105 X+212.96 0.999 50.033~0.540鸟苷Y=5.53×106 X-20 0020.999 40.015~0.470 腺苷Y=1.66×107 X+1.09×1050.999 70.000 21~1.090 00肌苷Y=9.09×106 X+52990.999 90.014~0.440 尿嘧啶Y=2.10×104 X+1.04×1030.999 70.034~0.540胸苷Y=2.02×106 X-12 6300.999 90.029~0.940 胞苷Y=6.96×106 X-1.71×1050.999 70.27~8.75腺嘌呤Y=2.14×105 X+1.81×1040.999 60.58~9.25 鸟嘌呤Y=3.45×106 X+3.26×1050.999 40.016~16.330黄嘌呤Y=6.56×104 X+1.0×1030.999 30.021~2.730 2′-脱氧腺苷Y=2.31×107 X+6.98×1050.998 60.001 9~3.920 02′-脱氧鸟苷Y=8.17×106 X-2.15×1040.999 40.003 6~0.460 0 2′-脱氧尿苷Y=3.12×105 X+1.04×1030.999 30.002 6~0.330 02′-脱氧胞苷Y=1.48×107 X+3.38×1040.999 90.002 4~0.610 0 3′5′-环磷酸鸟苷Y=2.43×106 X+4.65×103 0.999 20.034~0.550γ-氨基丁酸Y=1.97×105 X+1.78×1040.999 50.15~9.50 谷氨酰胺Y=4.38×105 X-1.63×1050.998 80.43~27.67天冬酰胺Y=1.24×105 X-1.76×1050.999 32.98~143.00 甲硫氨酸Y=1.30×106 X+1.83×1040.999 70.066~2.130酪氨酸Y=1.61×106 X+1.51×1050.999 90.48~15.33 亮氨酸Y=2.77×106 X+8.57×1050.999 00.94~15.00苯丙氨酸Y=8.11×106 X+2.22×1060.998 50.48~15.33 色氨酸Y=2.77×106 X+8.57×1050.999 00.12~31.67脯氨酸Y=1.78×106 X+6.99×1060.999 79.25~111.00 缬氨酸Y=1.40×106 X+2.33×1050.998 90.54~17.17谷氨酸Y=2.37×105 X-1.07×1050.998 60.98~31.33 赖氨酸Y=1.42×105 X-5.89×1040.999 40.58~37.00精氨酸Y=3.50×105 X-2.33×1060.998 88.08~97.00 羟脯氨酸Y=4.33×105 X+4.64×1030.999 30.041~1.310苏氨酸Y=2.99×105 X-1.48×1050.999 91.08~104.00 丝氨酸Y=1.01×105 X+80 652 0.999 81.94~93.00瓜氨酸Y=5.61×105 X-7.96×1050.998 60.54~104.00
2.7.6 样品分析及结果 取经不同干燥方法处理的样品适量,分别按“2.6.4”项下方法制备供试品溶液,按“2.6.1”“2.6.2”项下色谱质谱条件进样测定,记录各待测成分的峰面积。
比较不同干燥方法对枸杞子药材核苷氨基酸的影响,发现各组间核苷类总量及氨基酸类总量差异较大(表4)。测定的枸杞子19种氨基酸中精氨酸(1.06~9.18)mg/g、天冬酰胺(1.18~14.63)mg/g含量差异较大,17种核苷类成分中腺苷(0~29.72)μg/g、2′-脱氧腺苷(0.24~15.38)μg/g和黄嘌呤(0.80~13.46)μg/g含量变化较大。
真空冷冻干燥(N9)较好地保留了枸杞子中氨基酸及核苷成分,其总氨基酸、总核苷质量分数均为最高,总氨基酸量达60.49 mg/g,是脱蜡后(40+80)℃热风干燥(N6,8.599 mg/g)的7.03倍。真空冷冻干燥后除脯氨酸外的18种氨基酸含量均为组间最高,总核苷量达0.75 mg/g,其中鸟苷(9.99 μg/g)、胞苷(0.17 mg/g)、黄嘌呤(13.46 μg/g)等3种核苷酸含量均为最高。热风干燥则容易破坏枸杞子中氨基酸及核苷成分,其中脱蜡后(40+80)℃热风干燥(N6)氨基酸总量为组间最低,仅8.60 mg/g,脱蜡后40 ℃热风干燥(N4)核苷总量为最低,仅0.47 mg/g。
表4 枸杞不同干燥方法核苷氨基酸成分含量(, n = 3)
Table 4 Nucleoside amino acid content in Lycii Fructus with different drying methods (, n = 3)
成分质量分数/(μg·g−1) N1N2N3N4N5 谷氨酸 487.58±32.70582.74±8.72 188.54±4.33 403.89±13.61589.51±15.22 羟脯氨酸 6.70±0.30 5.50±0.46 5.42±0.43 6.37±0.266.93±0.13 赖氨酸 146.08±12.37 243.08±12.12 67.36±2.17108.85±1.22158.26±2.18 谷氨酰胺 931.33±12.891 479.49±78.56 399.75±17.24 870.19±26.181 168.17±8.67 丝氨酸1 300.17±85.172 045.77±73.02 516.86±12.00 987.97±14.921 495.78±52.40 瓜氨酸 328.95±10.27493.58±6.82 141.73±1.51286.68±2.90407.19±16.51 精氨酸 2 440.03±55.533 393.90±52.331 236.12±11.62 2 016.54±168.482 742.96±164.09 天冬酰胺 3 384.83±110.01 5 390.82±115.861 454.42±9.802 858.57±46.294 178.04±169.78 天冬氨酸 1 629.00±60.631 950.11±21.68 998.72±2.201 734.32±31.871 776.51±42.86 γ-氨基丁酸 87.33±4.77 126.83±5.01 19.02±0.83 48.52±3.30109.57±6.01 甲硫氨酸 12.96±0.66 17.98±0.43 6.15±0.06 9.60±0.4912.20±0.50 苯丙氨酸 70.78±6.21 142.23±5.23 55.16±0.67 56.32±1.50104.86±1.06 脯氨酸 5 375.87±122.91 5 118.76±71.904 408.51±43.68 5 188.33±39.055 169.71±252.36 苏氨酸 322.81±13.90 480.06±6.46 190.13±3.16 291.48±1.94359.23±10.19 色氨酸 27.77±1.37 45.04±2.21 13.55±0.22 36.45±1.5753.18±5.68 缬氨酸 152.74±6.74 255.13±5.91 111.60±2.90 140.51±0.60196.99±6.40 亮氨酸 270.92±13.29 483.59±9.36 151.14±4.67 225.94±2.71380.79±6.37 异亮氨酸 49.74±4.85 102.74±2.93 34.44±0.64 43.28±1.1172.27±1.41 酪氨酸 86.20±2.59 163.00±5.74 54.20±2.35 88.20±3.02144.12±7.25 总氨基酸 17 112±385d 22 520±193b10 053±56f 15 402±174e19 126±416c 尿嘧啶 126.83±31.87 141.77±11.01 167.13±8.28 95.86±4.62158.25±15.67 鸟苷 2.74±0.14 4.55±0.08 2.15±0.06 2.75±0.034.01±0.18 2′-脱氧尿苷 1.10±0.16 0.87±0.06 1.36±0.11 0.75±0.071.52±0.15 2′-脱氧腺苷 0.90±0.05 3.68±0.58 2.87±0.33 0.62±0.073.50±0.25 2′-脱氧胞苷 8.99±0.76 17.87±1.18 14.89±0.59 2.68±0.047.90±0.76 2′-脱氧鸟苷 6.84±0.41 11.33±0.73 6.86±0.20 3.19±0.097.56±0.50 腺苷 0.15±0.0026 0.22±0.01 0.94±0.23 0.15±0.010.39±0.03 3′,5′-环磷酸鸟苷 5.78±0.81 5.15±0.32 4.69±0.12 7.38±0.304.17±0.15 腺嘌呤 125.48±5.90 163.71±6.40 105.75±1.26 124.70±6.60151.14±6.01 胞苷 49.33±2.71 71.71±1.95 54.53±1.33 32.06±1.2059.66±1.82 胞嘧啶 11.79±0.83 9.84±0.28 10.67±0.24 10.28±0.408.51±0.43 肌苷 2.61±0.17 1.71±0.04 1.74±0.09 3.12±0.081.77±0.11 胸苷 14.06±1.25 19.95±1.58 17.23±0.83 7.32±0.3322.88±0.40 鸟嘌呤 82.35±5.85 82.04±3.02 64.94±3.54 60.17±1.5072.77±1.48 尿苷 123.98±4.46 190.52±3.69 208.67±30.67 115.40±3.12238.53±6.74 次黄嘌呤 0.40±0.02 0.28±0.01 0.22±0.03 0.80±0.090.36±0.04 黄嘌呤 6.30±0.40 5.42±0.39 3.94±0.22 5.21±0.033.92±0.20 总核苷 569.62±44.09d 730.63±21.84ab 668.58±35.94bc 472.44±11.40e746.85±11.58a 成分质量分数/(μg·g−1) N6N7N8N9 谷氨酸174.99±6.08515.53±11.22268.60±6.821 949.61±142.36 羟脯氨酸3.83±0.086.74±0.26 3.07±0.17 7.67±0.21 赖氨酸 60.32±2.52147.37±7.84 90.09±5.17 1 470.49±175.29 谷氨酰胺 327.23±21.921 212.26±42.97712.73±4.4611 633.36±508.50 丝氨酸 398.68±13.451 202.58±27.33 802.70±19.10 4 459.95±185.70 瓜氨酸 123.05±0.84 344.70±3.43207.64±3.29 2 603.06±31.57 精氨酸 1 061.82±19.69 2 691.59±11.821 862.42±42.97 9 175.81±151.47 天冬酰胺 1 181.11±12.75 3 351.74±141.262 227.94±20.14 14 633.16±611.14 天冬氨酸 793.14±29.39 1 514.31±31.48 912.90±20.61 3 042.52±101.45 γ-氨基丁酸 13.74±0.39 77.58±5.03 33.92±1.18 335.30±4.96 甲硫氨酸 4.38±0.45 11.00±0.69 5.38±0.45 99.28±7.09 苯丙氨酸 52.79±0.85 84.41±7.71 80.64±1.76 497.08±4.89 脯氨酸3 930.99±56.76 4 965.26±123.763 030.56±68.25 5 034.04±92.11 苏氨酸148.29±4.82 325.70±10.21 245.49±2.74 2 431.82±62.46 色氨酸 20.49±0.81 57.89±6.35 47.90±2.09 439.52±16.72
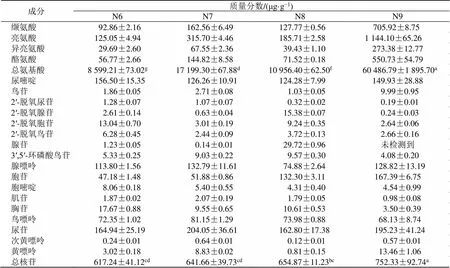
续表4
不同字母代表存在显著差异(<0.05)
Different letter means significantly different (< 0.05)
脱蜡后总氨基酸、总核苷含量总体呈下降趋势。40 ℃热风干燥时脱蜡对其氨基酸及核苷含量影响较大,未脱蜡组(N1)总氨基酸含量为17.11 mg/g,脱蜡组(N4)为15.40 mg/g。未脱蜡组(N1)总核苷含量为569.62 μg/g,脱蜡组(N4)为472.44 μg/g。其中2′-脱氧胞苷差异较大,N1为8.99 μg/g,N4仅为2.68 μg/g。
不同温度下热风干燥的枸杞子总氨基酸含量(40+60)℃>40 ℃>(40+80)℃,总核苷酸含量(40+60)℃>(40+80)℃>40 ℃。结果表明,热风干燥在(40+60)℃温度下,其总氨基酸、总核苷含量达到最高。其原因可能为40 ℃温度下干燥时间较长,氨基酸及核苷成分在干燥过程中大量损失,而高温条件(80 ℃)下又促进氨基类成分美拉德反应,产生褐变,使得氨基酸类成分急剧下降,而60 ℃介于两者之间,既能缩短干燥时间,又不至于大量产生褐变,能较好地保留枸杞子中氨基酸及核苷成分,是氨基酸及核苷成分含量累积较为适宜的温度。
2.8 逼近理想值排序法(TOPSIS)综合评价
不同干燥方法加工处理后枸杞子中各类成分分析结果显示,干燥加工方法不同程度的影响枸杞子中各类成分含量,且变化趋势不尽相同。为综合评价干燥方法对枸杞子化学成分的影响,筛选最佳干燥工艺,本研究采用DPS对9批次样品中50种指标性成分含量结果进行TOPSIS分析,结果见表5。
TOPSIS评价结果显示,上述9种不同干燥加工方案由优至劣依次排序为:真空冷冻干燥,微波干燥,(40+60)℃热风干燥,脱蜡后(40+60)℃热风干燥,红外干燥,40 ℃热风干燥,脱蜡后40 ℃热风干燥,(40+80)℃热风干燥,脱蜡后(40+80)℃热风干燥。基于上述多类型成分筛选出枸杞子的最佳干燥方法为真空冷冻干燥,使用此方法的枸杞子药材品质最佳。其次为微波干燥、(40+60)℃热风干燥,以上3种方法是枸杞子产地加工较为适宜的干燥方法。另外,TOPSIS综合评价结果显示,采用脱蜡处理后枸杞子品质略有下降,不同温度热风干燥中以(40+60)℃热风干燥品质最佳。
表5 TOPSIS综合评价结果
Table 5 TOPSIS comprehensive evaluation
样本D+D−指标Ci名次 N13.426 91.048 90.234 36 N23.079 01.352 10.305 13 N33.704 10.942 00.202 88 N43.570 11.042 90.226 17 N53.269 91.152 70.260 64 N63.757 60.867 00.187 59 N73.394 01.122 60.248 55 N83.489 91.555 50.308 32 N91.874 53.545 30.654 11
3 讨论
通过对上述不同干燥方法处理后枸杞子中各化学成分含量分析发现,不同干燥方法对枸杞子中总多糖、总酚、总黄酮、甜菜碱、果糖、葡萄糖和核苷氨基酸成分影响较为显著,而对总色素、蔗糖、麦芽糖含量的影响较小。真空冷冻干燥总多糖、总酚和总黄酮类物质含量低于微波干燥和红外干燥,这与文献中不同干燥方法对芡实多糖、总酚和总黄酮含量影响结果一致[23]。其原因可能为,在真空冷冻干燥过程中,虽然分解多糖、多酚及黄酮的氧化酶的活性受到一定程度的抑制,但低温下酶失活是可逆的,待冻干结束后回温过程中酶活性得以恢复,从而造成枸杞子总多糖、总酚和总黄酮类物质的分解损失。而微波干燥和红外干燥中高温环境对酶造成不可逆的灭活,从而使枸杞子中总多糖、总酚及总黄酮类物质氧化减少,含量得到累积,以及干燥过程中,植物细胞结构被破坏,细胞内结合型酚酸类成分大量游离释放[24]。
脱蜡研究结果表明,使用脱蜡剂后枸杞子单寡糖及核苷氨基酸类成分含量较未脱蜡组降低,品质下降。但脱蜡组的总多糖、总酚、总黄酮高于未脱蜡组,这可能与碱性条件下也会破坏酶的结构,使各类氧化酶不可逆失活有关。由此看来,碱性脱蜡剂的使用有利于总多糖、总酚和总黄酮类物质的积累。另外,实验结果显示,脱蜡处理后枸杞子中色素类成分含量变化不大,结合文献研究[25]发现碱性环境对色素的稳定性无明显影响。
干燥温度研究结果显示,不同干燥温度对枸杞子中多糖、总酚、总黄酮、核苷类及氨基酸类含量影响较大,干燥温度过高,会破坏枸杞子中黄酮类、核苷类、氨基酸类热敏性成分[26]。(40+80)℃下烘干,枸杞子中总黄酮、核苷类和氨基酸类含量明显下降。并且,高温促进美拉德反应,在(40+80)℃下烘干其还原糖(葡萄糖)和氨基酸总量在一定程度上损失。但高温(80 ℃)下却更有利于酚酸类成分的累积,这可能与高温及干燥胁迫下产生大量活性氧,引起氧化应激损伤,继而激发植物细胞产生酚酸等具有抗氧化作用的次生代谢产物有关[24]。
基于多类型功效成分的TOPSIS综合评价分析显示,真空冷冻干燥、微波干燥、(40+60)℃热风干燥3种方法是枸杞子产地加工较为适宜的干燥方法。现对这3种干燥方法的实用性进行探讨,真空冷冻干燥得到的枸杞子综合品质最佳,其含有较高的β-胡萝卜素和单寡糖类成分,并能有效保留枸杞子中氨基酸及核苷类成分。这是由于真空冷冻干燥法使干燥在低温、真空环境中进行,避免了高温破坏热敏性成分,既减少枸杞子在干燥过程中的损坏,又可保持物料色泽、形状和品质。但从经济效益角度考量,真空冷冻干燥设备昂贵,且冻干制品质地松泡,易吸潮,对包装和储藏条件有特殊要求[27],不适用于枸杞子药材大规模产地加工。
微波干燥后的枸杞子总酚、玉米黄素双棕榈酸酯、总色素成分含量较高,并且干燥速率快,可以大幅缩短枸杞子干燥周期,适用于枸杞子的产地加工。但在干燥过程中要注意干燥温度和时间,否则容易出现干燥不均匀,鲜果破裂、焦黑等现象。为了解决微波干燥容易导致药材焦黑的问题,有学者提出采用微波组合干燥工艺,并进行了热风微波联合间歇干燥[28]、真空微波干燥[29]工艺优化,得到的枸杞子干制品品质优良,证明微波优化工艺切实可行,具有良好的实践参考价值。运用现代仪器连用技术,不断优化微波干燥参数,微波干燥将有望成为枸杞子产业加工的发展方向。
热风干燥法干燥时间较长,但操作简便,设备成本低,适宜用于枸杞子产地加工,也是目前枸杞子产地加工方法最常见的干燥方法。本实验考察了不同预处理(脱蜡、不脱蜡)和不同温度[40 ℃、(40+60)℃、(40+80)℃]热风干燥对枸杞子干制品的影响。不同预处理研究结果表明,使用脱蜡剂后枸杞子的干燥时间缩短,TOPSIS得分虽略有下降,但与未脱蜡组排名靠近,综合实际生产情况考虑,Na2CO3前处理能使枸杞果实表皮蜡质层变薄、断裂,形成水分通道,进而缩短枸杞干燥时间[30],可以适度进行脱蜡预处理以提高枸杞子干燥、生产效率。实验结果显示,脱蜡处理对枸杞子中总多糖、总酚含量影响较大,但不同脱蜡剂对枸杞子药材品质的影响有待进一步考察。不同干燥温度研究结果表明,在(40+60)℃下热风干燥药材品质最佳,能较好地保留其总色素、葡萄糖、总单寡糖、氨基酸类及核苷类成分,而脱蜡后(40+80)℃热风干燥后枸杞子中多糖类、黄酮类、玉米黄素、玉米黄素双棕榈酸酯、甜菜碱、葡萄糖成分损失较大,不建议使用80 ℃及以上高温对枸杞子进行烘干。
利益冲突 所有作者均声明不存在利益冲突
[1] 苏国辉, 米雪松. 中药材枸杞子药食同源的机理 [J]. 生命科学, 2015, 27(8): 1070-1075.
[2] 段金廒. 中药资源化学: 理论基础与资源循环利用 [M]. 北京: 科学出版社, 2015: 263.
[3] 冯美玲, 王书芳, 张兴贤. 枸杞子的化学成分研究 [J]. 中草药, 2013, 44(3): 265-268.
[4] 肖佳, 高昊, 周正群, 等. 枸杞属中枸杞红素类成分研究进展 [J]. 科学通报, 2017, 62(16): 1691-1698.
[5] Yang J, Wei Y Q, Ding J B,. Research and application ofin medicinal field [J]., 2018, 10(4) 339-352.
[6] Amagase H, Farnsworth N R. A review of botanical characteristics, phytochemistry, clinical relevance in efficacy and safety offruit (Goji) [J]., 2011, 44(7): 1702-1717.
[7] 周正群. 枸杞子抗阿尔茨海默病活性成分研究 [D]. 广州: 暨南大学, 2016.
[8] 郑慧丽, 曹程, 王颖异, 等. 基于“成分-靶点-通路”的枸杞子调控年龄相关性黄斑变性作用机制研究 [J]. 中草药, 2021, 52(4): 1039-1048.
[9] Manthey A L, Chiu K, So K F. Effects ofon the visual system [J]., 2017, 135: 1-27.
[10] 魏芬芬, 王文娟, 贺青华, 等. 枸杞多糖对小鼠酒精性肝损伤的保护作用及机制研究[J]. 药物评价研究, 2019, 42(5): 852-857.
[11] Xing X W, Liu F Y, Xiao J,. Neuro-protective mechanisms of[J]., 2016, 18(3): 253-263.
[12] 段金廒, 宿树兰, 吕洁丽, 等. 药材产地加工传统经验与现代科学认识 [J]. 中国中药杂志, 2009, 34(24): 3151-3157.
[13] 卢有媛, 郭盛, 张芳, 等. 枸杞属药用植物资源系统利用与产业化开发 [J]. 中国现代中药, 2019, 21(1): 29-36.
[14] 段金廒, 宿树兰, 严辉, 等. 药材初加工“杀青”环节与药材品质形成的探讨 [J]. 中药材, 2011, 34(1): 1-4.
[15] 曲云卿, 张同刚, 刘敦华. 不同干燥方式枸杞挥发性风味成分的比较及主成分分析 [J]. 食品工业科技, 2015, 36(11): 296-300.
[16] 中国药典 [S]. 一部. 2020: 260.
[17] Lu Y Y, Guo S, Zhang F,. Comparison of functional components and antioxidant activity ofL. fruits from different regions in China [J]., 2019, 24(12): E2228.
[18] 魏雪松, 王海洋, 孙智轩, 等. 宁夏枸杞化学成分及其药理活性研究进展 [J]. 中成药, 2018, 40(11): 2513-2520.
[19] 如克亚·加帕尔, 孙玉敬, 钟烈州, 等. 枸杞植物化学成分及其生物活性的研究进展 [J]. 中国食品学报, 2013, 13(8): 161-172.
[20] Lu Y Y, Guo S, Zhang F,. Nutritional components characterization of Goji berries from different regions in China [J]., 2021, 195: 113859.
[21] Guo S, Duan J A, Li Y Q,. Comparison of the bioactive components in two seeds ofspecies by different analytical approaches combined with chemometrics [J]., 2017, 8: 609.
[22] 赵雪琴, 郭盛, 卢有媛, 等. 宁夏枸杞叶水溶性营养成分分析及产地差异研究 [J]. 中国中药杂志, 2021, 46(8): 2084-2093.
[23] 王红, 吴启南, 蒋征, 等. 干燥方式对芡实功能性成分含量及抗氧化活性的影响[J]. 食品科学, 2015, 36(7): 19-25.
[24] 朱邵晴, 郭盛, 钱大玮, 等. 基于多元功效成分的当归药材产地现代干燥加工方法研究 [J]. 中国中药杂志, 2017, 42(2): 264-273.
[25] 冯小叶, 周慧, 李琴, 等. 玫瑰花渣废水回收所得色素的稳定性研究 [J]. 食品研究与开发, 2021, 42(2): 73-78.
[26] 张黄琴, 刘培, 钱大玮, 等. 基于多元功效成分的瓜蒌皮药材产地现代干燥加工方法研究 [J]. 中草药, 2020, 51(4): 950-964.
[27] 王鹤, 慕松, 李天聪, 等. 基于响应面法的枸杞热风微波联合间歇干燥工艺探究 [J]. 现代食品科技, 2018, 34(2): 134-140, 109.
[28] 刘军, 段月, 张喜康, 等. 模糊数学评价结合响应面法优化枸杞真空微波干燥工艺 [J]. 食品与发酵工业, 2019, 45(15): 127-135.
[29] 刘勇, 徐娜, 陈骏飞, 等. 不同干燥方法对三七药材外观性状与内在结构及其品质的影响 [J]. 中草药, 2019, 50(23): 5714-5723.
[30] 宋慧慧, 陈芹芹, 毕金峰, 等. 干燥方式及碱液处理对鲜枸杞干燥特性和品质的影响 [J]. 食品科学, 2018, 39(15): 197-206.
Analysis and evaluation of different drying methods forbased on multi-type functional components
WU Li-ping1, LU You-yuan1, 2, LI Hai-yang1, QIAN Da-wei1, DUAN Ran3, LU Xue-jun3, GUO Sheng1, DUAN Jin-ao1
1. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Key Laboratory of Chinese Medicinal Resources Recycling Utilization of National Administration of Traditional Chinese Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. School of Pharmacy, Ningxia Medical University, Yinchuan 750021, China 3. Ningxia Innovation Center of Goji, Yinchuan 750002, China
The aim of this paper was to clarify the influence of different drying methods on the quality of Gouqizi () by analysis and comparison of multi-type functional substances oftreated with different drying methods.The fresh fruits ofwas dried with different methods including hot air at different temperatures, infrared drying, microwave drying and vacuum freeze drying. Total phenols, total flavonoids, neutral polysaccharides, acid polysaccharides and total pigments content were detected by UV spectrophotometry. HPLC was applied to determine the contents of zeaxanthine, kryptoxanthin, carotene. HPLC-ELSD was applied to determine the contents of four monooligosaccharides (fructose, glucose, maltose, sucrose) and betaine. The contents of 36 nucleotides and free amino acids were detected by UPLC-TQ/MS. TOPSIS method was adopted to analyze and evaluate the quality ofwith different drying methods based on the above multi-type functional components.The different functional components ofwere greatly varied with different drying methods. In general, total polysaccharides, total phenols, total flavonoids, total pigments, betaine, total monooligosaccharides were 29.2—47.48 9.61—20.69, 4.84—9.59, 4.90—7.07, 14.53—18.92 and 641.05—780.56 mg/g, respectively. The total polysaccharides and total phenols were significantly affected by dewaxing treatment, and the quality ofwithout dewaxing was better based on the multi-type functional components analysis. The contents of total polysaccharides, total phenols, total flavonoids, nucleotides and amino acids were significantly affected by drying temperature. Meanwhile, the result showed that (40 + 60) ℃ was the best temperature of hot air drying for. Furthermore, the vacuum freeze-drying sample had the highest total nucleosides and amino acids contents. Dewaxing combined with 40 ℃ hot air drying obtained the lowest total nucleosides; However, the (40 + 80) ℃ hot air drying group obtained the lowest amino acids. According to the TOPSIS analysis results about the nine different drying methods fortreatment, vacuum freeze-drying was the best, followed by microwave drying and (40 + 60) ℃ hot air drying.Vacuum freeze-drying method was the best drying method forowing to it preserving the functional components, followed by microwave drying and (40 + 60) ℃ hot air drying. This experimental research provides a scientific basis for optimizing and establishing a suitable drying method for.
L.; drying methods; medicinal material quality; analysis and evaluation; zeaxanthine; kryptoxanthin; carotene; total polysaccharides; total phenols; total flavonoids; total pigments
R286.2
A
0253 - 2670(2022)07 - 2125 - 12
10.7501/j.issn.0253-2670.2022.07.023
2021-08-09
国家自然科学基金项目(U21A20408);宁夏重点研发计划重点项目(2021BEF02009,2021BEF02010)
吴励萍,女,硕士研究生,主要从事中药化学与分析研究。E-mail: 20190334@njucm.edu.cn
段金廒,教授,研究方向为中药资源化学与资源循环利用。E-mail: dja@njucm.edu.cn
郭 盛,副研究员,研究方向为中药资源化学与资源循环利用。E-mail: guosheng@njucm.edu.cn
[责任编辑 时圣明]

