5,7-二取代-[1,2,4]三唑[1,5-a]嘧啶衍生物的合成及其抗癫痫活性
宋明霞,程沐春,曾希文,邓先清
5,7-二取代-[1,2,4]三唑[1,5-a]嘧啶衍生物的合成及其抗癫痫活性
宋明霞1,2,程沐春1,曾希文1,*邓先清1,2
(1.井冈山大学医学部,江西,吉安 343009;2.井冈山大学中药资源和功能分子研究中心,江西,吉安 343009)
通过合成一系列5,7-二取代- [1,2,4]三唑[1,5-a]嘧啶衍生物,对其体内抗癫痫活性进行研究。各种查尔酮和3-氨基-1,2,4-三氮唑在二甲基甲酰胺中加热反应分别得到5,7-二取代-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶(2a-2e)和它们的脱氢产物5,7-二取代-[1,2,4]三唑[1,5-a]嘧啶(3a-3e)。通过核磁共振氢谱、碳谱和质谱进行化合物结构确证;采用最大电休克发作(MES)模型和皮下戊四唑(Sc-PTZ)模型评价化合物的抗癫痫活性,旋转棒法评价目标化合物的神经毒性。我们合成了5个5,7-二取代-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶衍生物和其脱氢产物。在MES模型中,化合物2a-2e均没有显示出抗癫痫活性,而化合物3a-3e则显示出不同程度的保护作用,说明脱氢后的产物活性高于未脱氢产物。在Sc-PTZ模型中,所有化合物在100 mg/kg剂量下都对戊四唑诱导的小鼠惊厥显示出保护作用。因此本研究报道的三唑[1,5-a]嘧啶衍生物具有较好的抗癫痫活性,进一步丰富了三唑类化合物的抗癫痫构效关系,为研究大发作和失神发作类癫痫的治疗药物提供了一定的基础。
三氮唑;嘧啶;抗癫痫;最大电休克发作;皮下戊四唑
癫痫是最常见的慢性脑部疾病之一,是由多种因素引起大脑神经元异常同步放电,导致反复的发作性和短暂性的中枢神经系统功能异常。全球约有6000万癫痫患者, 其中80%患者在发展中国家,大约70%的癫痫患者可以通过适当的治疗得到控制,剩下的30%则会发展成为难治性癫痫[1]。癫痫反复发作会造成患者中枢神经系统的损伤,影响患者的认知、智力、发育及生活质量等方面,甚至可致残或危及生命[2-3]。癫痫给患者、社会都带来了巨大的医疗负担[4-5]。
癫痫治疗方法主要有食物疗法、手术治疗和药物治疗,其中药物治疗仍然是绝大多数癫痫患者的首选方案。自1857年应用溴化钾揭开了现代抗癫痫药物发展的序幕以来,迄今已有20余种抗癫痫药物应用于临床[6-7]。但现有的抗癫痫药物仍不能满足临床需求,药物有效性的缺乏和大量严重的不良反应,使得新的抗癫痫药物的研发依然是癫痫治疗的重点[8]。
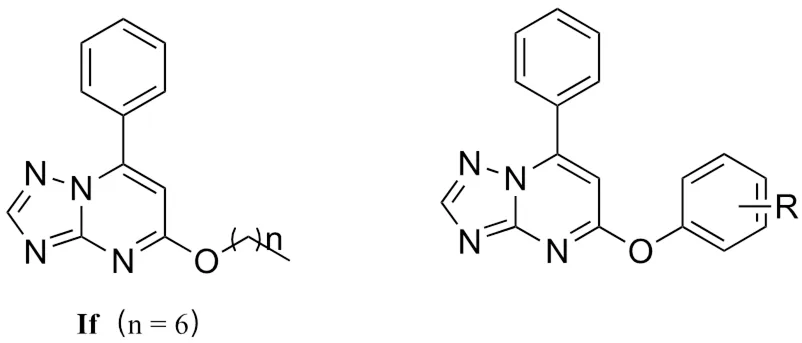
图1 7-取代-5-苯基-[1,2,4]三唑[1,5-a]嘧啶衍生物
三氮唑是药物设计领域中的一个重要的活性片段,它的芳香性和富电子性质使其易于与各种不同的酶和受体结合[9],从而赋予其广泛的生物活性,如抗菌、抗肿瘤、抗病毒等活性[10-12]。自20世纪后期三唑仑和艾普唑仑作为抗癫痫药物上市以来,药物化学家们开始设计、合成了大量的三氮唑衍生物,用于筛选其抗癫痫活性,从而发现新的抗癫痫药物[13-14]。在之前的研究工作中,我们合成了大量三唑类化合物并评价了它们的抗癫痫活性[9, 15-16],其中7-取代-5-苯基-[1,2,4]三唑[1,5-a]嘧啶衍生物表现出了有趣的活性结果[15]。当7-位取代为烷氧基时,化合物具有明显的抗癫痫活性,其中化合物If活性最好,ED50= 84.9 mg/kg;但当7-位取代为苯氧基时,所有化合物在100 mg/kg下均未显示出抗癫痫活性(结构见图1)。为了进一步阐明三唑并嘧啶类衍生物的抗癫痫活性构效关系,本研究设计了一系列5,7-双苯基取代的三唑并嘧啶衍生物,并采用最大电惊厥和皮下戊四唑模型初步评价了目标化合物的抗癫痫活性。
1 材料与方法
1.1 仪器与试剂
核磁共振分析采用BURKER AV-300 型核磁共振仪,四甲基硅(TMS)为内标,溶剂用DMSO-d(Bruker, Switzerland);高分辨质谱采用UltrafleXtreme MALDI-TOF/TOF 质谱仪 (Bruker Daltonik GmbH, Leipzig, Germany)测定;熔点采用毛细管法测定(温度计未经校正)。实验所用试剂包括1,2,4-三氮唑 (99%,阿拉丁试剂公司)、各种取代查尔酮(98%,麦克林试剂公司)和其他常规溶剂(分析纯,国药基团化工试剂有限公司)。
1.2 化合物合成
1.2.1 化合物2a-2e的合成
以化合物2a的合成为例:称取化合物1a(1.00 g, 0.0045 mol)和3-氨基-1,2,4-三氮唑(0.45 g,0.0054 mol)加入装有3 mL DMF的50 mL圆底烧瓶中,在130℃下搅拌反应12 h。用薄层色谱法TLC(展开剂为石油醚:乙酸乙酯=2:1)检测反应是否完全。当确定反应完全后停止反应,向反应液中加入20 mL水后抽滤得滤饼,干燥后进行柱层析纯化得到化合物2a。化合物2b-2e合成方法同上。
1.2.2 化合物3a-3e的合成
以化合物3a的合成为例:称取化合物1a (1.00 g,0.0045 mol)和3-氨基-1,2,4-三氮唑(0.45 g, 0.0054 mol)加入装有3 mL DMF的50 mL圆底烧瓶中,在160℃下搅拌反应24 h。用薄层色谱法TLC(展开剂为石油醚:乙酸乙酯=2:1)检测反应是否完全。当确定反应完全后停止反应,向反应液中加入20 mL水后抽滤得滤饼,干燥后进行柱层析纯化得到化合物3a。化合物3b-3e合成方法同上。目标化合物的熔点、产率和波谱数据如下:
5-苯基-7-对甲苯基-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶(2a)
Mp 193.0-195.1℃, yield 74%.1H-NMR (DMSO-6, 300MHz):2.28 (s, 3H, CH3), 5.16 (d, 1H,= 3.6 Hz, CH=C), 6.15 (d, 1H,= 3.6 Hz, CH-N), 7.16 (s, 4H, Ph-H), 7.39-7.43 (m, 2H, Ph-H), 7.59-7.63 (m, 3H, Ph-H, Triazole-H), 9.79 (s, 1H, NH).13C-NMR (DMSO-6,75MHz):149.53, 149.37, 139.15, 137.21, 135.05, 134.20, 129.09, 128.87, 128.49, 126.81, 125.82, 97.17, 59.34, 20.65. ESI-HRMS calcd for C18H17N4+([M + H]+): 289.1448; found: 289.1441。
5,7-二对甲苯基-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶(2b)
Mp 190.0-192.3℃, yield 65%.1H-NMR (DMSO-6, 300MHz):2.28 (s, 3H, CH3), 2.32 (s, 3H, CH3), 5.11 (d, 1H,= 3.6 Hz, CH=C), 6.13 (d, 1H,= 3.6 Hz, N-CH), 7.15 (s, 4H, Ph-H), 7.21 (d, 2H,= 8.1 Hz, Ph-H), 7.50 (d, 2H,= 8.1 Hz, Ph-H), 7.58 (s, 1H, Triazole-H), 9.74 (s, 1H, NH).13C-NMR (DMSO-6,75MHz):149.29, 149.23, 138.98, 138.09, 136.88, 134.84, 131.20, 128.79, 128.73, 126.50, 125.44, 96.21, 59.14,20.41, 20.34.. ESI-HRMS calcd for C19H19N4+([M + H]+): 303.1604; found: 303.1601。
5-(4-氟苯基)-7-对甲苯基-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶(2c)
Mp 186.9-188.2℃,yield 63%.1H-NMR (DMSO-6,300MHz):2.28 (s, 3H, CH3), 5.13 (d, 1H,= 3.7 Hz, CH=C), 6.14 (d, 1H,= 3.7 Hz, N-CH), 7.16 (s, 4H, Ph-H), 7.19-7.25(m, 2H, Ph-H), 7.59 (s, 1H, Triazole-H), 7.63-7.68 (m, 2H, Ph-H), 9.82 (s, 1H, NH).13C-NMR (DMSO-6,75MHz):162.155 (d,1c-f= 245.29 Hz), 149.27, 149.14, 138.81,135.51 (d,1c-f= 217.51 Hz),130.52 (d,4c-f= 3 Hz), 128.80, 127.91, 127.80, 126.53,115.02 (d,2c-f= 21.75 Hz),97.00, 59.11, 20.33. ESI-HRMS calcd for C18H16FN4+([M + H]+): 307.1354; found: 307.1347。
5-(4-氯苯基)-7-对甲苯基-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶(2d)
Mp 205.2-206.9℃, yield 61%.1H-NMR (DMSO-6, 300MHz):2.28 (s, 3H, CH3), 5.20 (d, 1H,= 3.7 Hz, CH=C), 6.15 (d, 1H,= 3.7 Hz, CH-N), 7.15 (s, 4H, Ph-H), 7.46 (d, 2H,= 8.0 Hz, Ph-H), 7.59 (s, 1H, Triazole-H), 7.63 (d, 2H,= 8.0 Hz, Ph-H), 9.85 (s, 1H, NH).13C-NMR (DMSO-6,75MHz):149.30, 149.11, 138.71, 136.98, 133.93, 133.24, 132.85, 128.82, 128.18, 127.45, 126.53, 97.56, 59.10, 20.35. ESI-HRMS calcd for C18H16ClN4+([M + H]+): 323.1058; found: 323.1055。
5-(4-溴苯基)-7-对甲苯基-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶(2e)
Mp 209.3-210.2℃, yield 60%.1H-NMR (DMSO-6, 300MHz):2.28 (s, 3H, CH3), 5.21 (d, 1H,= 3.8 Hz, CH=C), 6.15 (d, 1H,= 3.8 Hz, CH-N), 7.16 (s, 4H, Ph-H), 7.55-7.62 (m, 4H, Ph-H, Triazole-H), 9.86 (s, 1H, NH).13C-NMR (DMSO-6,75MHz):149.31, 149.10, 138.68, 136.99, 134.00, 133.23, 131.12, 128.82, 127.72, 126.52, 121.77, 97.57, 59.11, 20.35.. ESI-HRMS calcd for C18H16BrN4+([M + H]+): 367.0553; found: 367.0549。
5-苯基-7-对甲苯基-[1,2,4]三唑[1,5-a]嘧啶(3a)
Mp 129.2-130.7℃, yield 62%.1H-NMR (DMSO-6, 300MHz):2.44 (s, 3H, CH3), 7.45 (d, 2H,= 8.1 Hz, Ph-H), 7.57-7.60 (m, 3H, Ph-H), 8.11 (s, 1H, CH=C), 8.23 (d,= 8.1 Hz, Ph-H), 8.37-8.40 (m, 2H, Ph-H), 8.70 (s, 1H, Triazole-H).13C NMR (DMSO-6,75MHz) δ 160.48, 155.96, 155.86, 147.36, 141.84, 136.15, 131.21, 129.69, 129.05, 128.92, 127.77, 126.89, 106.20, 21.11. ESI-HRMS calcd for C18H15N4+([M +H]+):287.1291; found:287.1284。
5,7-二对甲苯基-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶(3b)
Mp 166.0-167.5℃, yield 70%.1H-NMR (DMSO-6, 300MHz):2.42 s, 3H, CH3), 2.45 s, 3H, CH3), 7.41 (d, 2H,= 8.1 Hz, Ph-H), 7.47 (d, 2H,= 8.6 Hz, Ph-H), 8.09 (s, 1H, CH=C), 8.24 (d, 2H,= 8.1 Hz, Ph-H), 8.31 (d, 2H,= 8.6 Hz, Ph-H), 8.69 (s, 1H, Triazole-H).13C-NMR (DMSO-6,75MHz):160.41, 155.82, 155.77, 147.22, 141.68, 141.22, 133.36, 129.58, 129.45, 128.98, 127.62, 126.91, 105.86,21.00, 20.87.ESI-HRMS calcd for C19H17N4+([M + H]+): 301.1448; found: 301.1441。
5-(4-氟苯基)-7-对甲苯基-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶(3c)
Mp178.6-180.2℃, yield 65%.1H-NMR (DMSO-6, 300MHz):2.45 (s, 3H, CH3), 7.40-7.48 (m, 4H, Ph-H), 8.14 (s, 1H, CH=C), 8.20-8.25 (m, 2H, Ph-H), 8.45-8.50 (m, 2H, Ph-H), 8.71 (s, 1H, Triazole-H).13C NMR (DMSO-6,75MHz)164.11 (d,1c-f= 247.5 Hz), 159.40, 155.97, 155.78, 147.43, 141.90, 132.64 (4c-f= 2.9 Hz), 130.31 (3c-f= 7.7 Hz), 129.72, 129.06, 126.85, 115.895 (2c-f= 21.75 Hz), 106.03, 21.11. ESI-HRMS calcd for C18H14FN4+([M +H]+):305.1197; found:305.1193。
5-(4-氯苯基)-7-对甲苯基-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶(3d)
Mp 200.4-201.8℃, yield 63%.1H-NMR (DMSO-6, 300MHz):2.45 (s, 3H, CH3), 7.47 (d, 2H,= 8.0 Hz, Ph-H), 7.67 (d, 2H,= 8.7 Hz, Ph-H), 8.16 (s, 1H, CH=C), 8.25 (d, 2H,= 8.0 Hz, Ph-H), 8.44 (d, 2H,= 8.7 Hz, Ph-H), 8.72 (s, 1H, Triazole-H).13C NMR (DMSO-6,75MHz) δ 159.37, 156.13, 155.86, 147.71, 142.00, 136.27, 135.09, 129.79, 129.65, 129.14, 129.05, 126.93, 106.22, 21.13. ESI-HRMS calcd for C18H14ClN4+([M +H]+): 321.0902; found:321.0901。
5-(4-溴苯基)-7-对甲苯基-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶(3e)
Mp 190.6-192.8℃, yield 66%.1H-NMR (DMSO-6, 300MHz):2.45 (s, 3H, CH3), 7.48 (d, 2H,= 8.0 Hz, Ph-H), 7.81 (d, 2H,= 8.7 Hz, Ph-H), 8.16 (s, 1H, CH=C), 8.25 (d, 2H,= 8.0 Hz, Ph-H), 8.37 (d, 2H,= 8.7 Hz, Ph-H), 8.73 (s, 1H, Triazole-H).13C-NMR (DMSO-6,75MHz):159.37, 156.10, 155.82, 147.61, 141.96, 135.38, 131.93, 129.77, 129.09, 129.75, 126.86, 125.18, 106.07, 21.12. ESI-HRMS calcd for C18H14BrN4+([M + H]+): 365.0396; found: 365.0388。
1.3 化合物抗癫痫活性及神经毒性评价
按照美国国立卫生院的抗癫痫药物开发方案,本实验采用了最大电惊厥模型和皮下戊四唑模型来评价目标化合物的抗惊厥活性,采用了旋转棒法评价目标化合物的神经毒性[17-18]。实验动物采用昆明种小鼠(长沙市天勤生物技术有限公司提供,许可证号:SCXK(湘)2019-0014),体重(20-24) g,雌雄各半、实验前3天饲养于20 ~ 25 ℃、相对湿度45% ~ 65% 的实验室中,可以自由采食和饮水。目标化合物溶于二甲基亚砜中以0.05 mL/20g容积腹腔注射。首先初步评价化合物在100 mg/kg剂量下的抗癫痫活性活性和神经毒性,每组小鼠数为3只。然后选取实验中活性最好的化合物,测定其抗癫痫活性半数有效剂量(ED50)和半数神经毒性剂量(TD50),以定量评价其活性和神经毒性。定量实验中,每个测试药物分不同梯度剂量的4个组,每个组5只小鼠,以获得不同剂量下的保护百分率,最后用改良寇式法获得ED50和TD50。
最大电休克发作实验(MES):在最大电休克发作实验中,使用110V,60 Hz的交流电,小鼠耳电极通电0.3 s,出现后肢强直的视为惊厥。正式实验前一天预筛小鼠,出现惊厥的小鼠用于正式实验。给药后0.5 h对小鼠进行电刺激,观察药物的抗电诱导惊厥活性。在该模型中,化合物表现出抗惊厥活性即认为具有抗癫痫活性。
皮下戊四唑实验(Sc-PTZ):小鼠给药后0.5 h皮下给予85 mg/kg的戊四唑(该剂量可以使97%以上的小鼠产生连续5 s的阵挛性惊厥),小鼠单独放置在鼠笼中观察30 min,以没有出现连续5 s以上的阵挛性惊厥为有效,认为该药物可以对抗由戊四唑诱导的惊厥。在该模型中,化合物表现出抗惊厥活性即认为具有抗癫痫活性。
神经毒性实验:神经毒性实验采用旋转棒法, 于给药0.5 h后将小鼠置于直径1英寸、转速为 6 r/min的木棒上,在连续3次的测试中小鼠均不能在木棒保持1 min而掉下视为有神经毒性,反之则为无为神经毒性。
2 结果与讨论
2.1 合成部分
本实验探索了一种非常简便的三唑并嘧啶衍生物的制备方法。该方法以各种查尔酮和3-氨基-1,2,4-三唑为原料,在DMF溶剂中进行缩合关环反应,得到目标化合物(如图2)。当反应物在130 ℃以下反应时,产物主要是5,7-二取代-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶化合物,而当升温到160℃,并持续反应24 h时,反应的主要产物变成其脱氢产物5,7-二取代-[1,2,4]三唑[1,5-a]嘧啶化合物。目标化合物2a-2e和3a-3e的结构采用核磁共振氢谱、碳谱和高分辨质谱进行了确证。2a-2e系列化合物的结构解析以化合物2a为例:在1H-NMR 中,2.28处的单峰为苯环上甲基的吸收峰,5.16 , 6.15处的两个二重峰为二氢嘧啶环上两个次甲基的吸收峰,这两个碳由于没有共轭因此耦合常数偏低(为3.6 Hz),7.16处的单峰为对位取代苯上的四个氢的吸收峰,7.39-7.63处的多重峰是另一个苯环上五个质子和三氮唑上质子的吸收峰,9.79位置的单峰则为吡啶中NH质子的吸收峰。13C NMR谱也准确的给出了该化合物结构的各种信息,恰好是14种不同化学环境的碳。高分辨质谱分析中,化合物2a理论分子量为289.1448,实际测定值为289.1441,相差小于4 ppm,结合氢谱和碳谱可以确证其分子结构。
3a-3e系列化合物的结构解析以化合物3a为例:在1H-NMR 中,2.44处的单峰为苯环上甲基的吸收峰,7.45和8.23两处的二重峰为二对位取代苯上质子的吸收峰,7.57-7.60和8.37-8.40两处的多重峰为另一个苯环上五个质子的吸收峰,8.11处的单峰是嘧啶环上的质子峰,8.70处的单峰为三氮唑上质子的吸收峰。13C NMR谱也准确的给出了该化合物结构的各种信息,给出了14种不同化学环境的碳。高分辨质谱分析中,化合物3a理论分子量为:287.1291,实际测定值为:287.1284,相差小于4 ppm,结合氢谱和碳谱可以确证其分子结构。
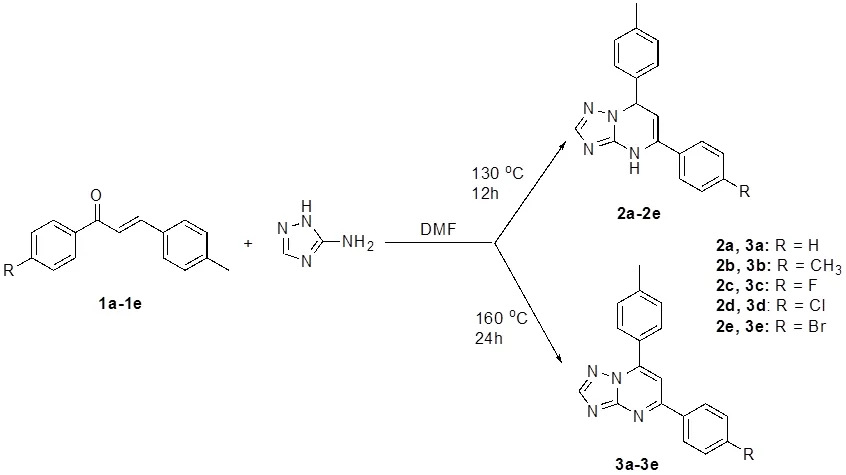
图2 目标化合物2a-e和3a-e的合成路线
2.2 药理实验部分
本实验采用了MES和Sc-PTZ 模型来评价目标化合物的抗癫痫活性。这两个模型均被美国国立卫生研究院(NIH)推荐为主要的抗癫痫药物筛选模型[17],它是当前抗癫痫药物筛选的首要选择。其中MES 模型用于筛选能对抗全身强直阵挛性发作的候选药[18],而Sc-PTZ 模型则用来筛选失神发作的候选药物[19]。
表1 化合物2a-2e和3a-3e抗癫痫活性及神经毒性
Table 1 Anticonvulsant activity and neurotoxicity of compounds 2a-2e and 3a-3e administered intraperitoneally to mice
Compd.i.p. in mice a (100mg/kg) MES b scPTZ c NT d 2a0/3 2/3 - 2b0/3 3/3 - 2c0/3 1/3 - 2d0/3 2/3 - 2e0/3 1/3 - 3a3/3 3/3 - 3b1/3 2/3 - 3c2/3 2/3 - 3d1/3 3/3 - 3e2/3 2/3 -
a:小鼠腹腔注射给药,每组动物数3只,给药30 min后测定活性,表中的数据代表每组动物中受保护或者显示毒性的动物数;b:最大电休克发作模型;c:皮下戊四唑模型;d:神经毒性评价(转棒法)
本实验首先对目标化合物2a-2e和3a-3e进行了100 mg/kg剂量下的抗癫痫活性和神经毒性初步评价,其结果见表1。在MES模型中,化合物2a-2e均没有显示出抗癫痫活性,而化合物3a-3e则显示出不同程度的保护作用。在Sc-PTZ模型中,所有化合物在100 mg/kg剂量下都对戊四唑诱导的小鼠惊厥显示出保护作用。在旋转棒法中,所有化合物在100 mg/kg剂量下均未显示出神经毒性。
为了更为准确的评价合成化合物的活性大小,选择了初筛结果最好的化合物3a进行定量活性和神经毒性评价,并将其与化合物If及临床药物丙戊酸钠和卡马西平进行比较。如表2所示,化合物3a 在MES模型中的半数有效剂量(ED50)为54.2 mg/Kg,显示出比卡马西平(ED50= 9.8 mg/Kg)弱,但强于丙戊酸钠(ED50= 264 mg/Kg)的活性,并且与化合物If(ED50= 84.9 mg/Kg)相比,其活性也明显提高。在Sc-PTZ模型中,化合物3a的ED50为44.6 mg/Kg,活性高于丙戊酸钠(ED50= 149 mg/Kg)和卡马西平(ED50>100 mg/Kg)。
表2 化合物3a, If, 卡马西平和丙戊酸钠的定量抗癫痫活性及神经毒性
Table 2 Quantitative anticonvulsant activity and neurotoxicity date of 3a, If, CBZ, and VPA
Compd.ED50TD50cPI MESPTZMESPTZ 3a54.244.6485.49.010.9 If84.9-509.26.0- CBZ9.8>10044.04.9<0.44 VPA2641494181.62.8
从活性结果来看,3a-3e系列化合物的抗MES活性要优于2a-2e系列化合物。这可能是由于3a-3e化合物的共轭性更高,使得芳环上的电子可以更好的离域到三氮唑环,从而提高了其与受体的亲和力。而两个系列化合物在戊四唑模型中活性没有明显差别,说明分子的抗戊四唑诱导惊厥活性更多来自于分子立体结构的影响。与之前报道的7-烷/芳氧基-5-苯基-[1,2,4]三唑[1,5-a]嘧啶衍生物相比,本研究中的5,7-二苯基-[1,2,4]三唑[1,5-a]嘧啶衍生物表现出更好的抗癫痫活性。总的来说,本研究发现了具有广谱抗癫痫活性的5,7-二取代-[1,2,4]三唑[1,5-a]嘧啶衍生物,其在MES 和Sc-PTZ 模型中均表现出保护活性,说明其对强直性发和失神发作均有效,并且它们均表现出较低的神经毒性。
3 小结
本研究合成了一系列5,7-二取代-4,7-二氢-[1,2,4]三唑[1,5-a]嘧啶(2a-2e)和它们的脱氢产物5,7-二取代-[1,2,4]三唑[1,5-a]嘧啶,其结构经过光谱方法确证。体内抗癫痫活性评价表明,脱氢化合物对MES模型和Sc-PTZ 模型均有效,使得该类化合物具有广谱的抗癫痫潜能。化合物3a在两个模型中的抗癫痫活性均要优于临床药物丙戊酸钠,这为研究大发作和失神发作类癫痫的治疗药物提供了一定的基础。
[1] The World Health Organization, Epilepsy, 20201. https://www.who.int/health-topics/epilepsy#tab=tab_1 (accessed: May 9).
[2] 孔令军,肖瑞林,朱秋根.成人癫痫患者生活质量的研究[J]. 井冈山学院学报,2007, 28(3): 108-110.
[3] 李聃,秦利芬,李惠英. 抗癫痫药物所致不良反应的研究进展[J]. 临床合理用药杂志, 2020, 13(24): 175-176.
[4] Rahim F, Azizimalamiri R, Sayyah M, et al. Experimental therapeutic strategies in epilepsies using anti-seizure medications[J]. J Exp Pharmacol, 2021, 13: 265-290.
[5] Song P, Liu Y, Yu X, et al. Prevalence of epilepsy in China between 1990 and 2015: A systematic review and meta-analysis[J]. J Glob Health, 2017, 7(2):020706
[6] 肖波,龙泓羽.浅谈抗癫痫药物应用现状与前景展望[J].中华神经科杂志, 2021, 54(1): 5-8.
[7] Bialer M, Johannessen S I, Koepp M J, et al. Progress report on new antiepileptic drugs: A summary of the fifteenth eilat conference on new antiepileptic drugs and devices (EILAT XV). II. Drugs in more advanced clinical development[J].Epilepsia, 2020, 61(11): 2365-2385.
[8] Ding D, Zhou D, Sander JW, et al. Epilepsy in China: major progress in the past two decades[J]. Lancet Neurol, 2021, 20(4):316-326.
[9] 陈士龙,郭东福,喻圣旺,等.1-(3-苯氧基丙基)-1H-1,2,4-三氮唑衍生物的合成及其抗惊厥活性[J]. 井冈山大学学报:自然科学版, 2019, 40(1): 88-93, 98.
[10] 栗娜,辛景超,马启胜,等. 1,2,3-三氮唑[4,5-d]嘧啶衍生物的合成及抗肿瘤活性评价[J].有机化学, 2018, 38(3): 665-671.
[11] 孙大柠. 新的三氮唑类广谱抗真菌药Voriconazole[J]. 药学进展, 1996(4): 230-231.
[12] 文逸宁,袁伟媛,吴勇巍,等. 1,2,3-三氮唑类化合物的合成及抗病毒活性[J].中国药物化学杂志,2016(1):18-23.
[13] Kamboj V K, Verma P K, Dhanda A, et al. 1,2,4-Triazole derivatives as potential scaffold for anticonvulsant activity[J]. Cent Nerv Syst Agents Med Chem, 2015, 15(1): 17-22.
[14] Ayati A, Emami S, Foroumadi A. The importance of triazole scaffold in the development of anticonvulsant agents[J]. Eur J Med Chem, 2016, 109(13): 380-92.
[15] Song M X, Deng X Q. Recent developments on triazole nucleus in anticonvulsant compounds: a review[J]. Journal of Enzyme Inhibition & Medicinal Chemistry, 2018, 33(1): 453.
[16] Jiang N, Deng X Q, Li F N, et al. Synthesis of novel 7-substituted-5-phenyl-[1,2,4]triazolo[1,5-a] Pyrimidines with Anticonvulsant activity[J]. Iranian Journal of Pharmaceutical Research, 2012, 11(3): 799-806.
[17] White H S. Preclinical development of antiepileptic drugs: past, present, and future directions[J]. Epilepsia, 2003, 44(7): 2-8.
[18] Smith M, Wilcox K S, White H S. Discovery of antiepileptic drugs[J]. Neurotherapeutics, 2007, 4(1): 12-17.
[19] White H S. Clinical significance of animal seizure models and mechanism of action studies of potential antiepileptic drugs[J]. Epilepsia, 1997, 38(1):9-17.
SYNTHESIS OF 5, 7-DISUBSTITUTED-[1, 2, 4]TRIAZOLO[1, 5-a] PYRIMIDINES AND THEIR ANTICONVULSANT ACTIVITIES
SONG Ming-xia1,2, CHENG Mu-chun1, ZENG Xi-wen1,*DENG Xian-qing1,2
(1. School of Medicine, Jinggangshan University, Ji’an, Jiangxi 343009, China; 2. Research Center of Chinese Medicinal Resources and Functional Molecules of Jinggangshan University, Ji’an, Jiangxi 343009, China)
To synthesize a series of 5, 7-disubstituted-[1, 2, 4]triazolo[1, 5-a]pyrimidine derivatives (3a-3e) and investigate their anticonvulsant effects. Chalcones and 3-amino-1, 2, 4-triazole were reacted in dimethylformamide in sequential order to provide 5, 7-disubstituted-[1, 2, 4]triazolo[1, 5-a]pyrimidine (2a-2e) and their dehydrogenation products (3a-3e). The structure of these compounds was confirmed by1H-NMR,13C-NMR, and MS spectrum. Their anticonvulsant activities were evaluated by using maximal electroshock shock (MES) and subcutaneous pentylenetetrazole (scPTZ) seizure models in mice. The neurotoxicity was evaluated with rotarod test. Five [1, 2, 4]triazolo[1, 5-a]pyrimidines and their dehydrogenation products were synthesized. In the MES model, compounds 2a-2e did not show anticonvulsant activity, while compounds 3a-3e showed different degrees of protection, which indicated that the dehydrogenation products exhibited the higher activity. In Sc-PTZ model, all compounds showed protective effects on convulsion induced by pentetrazol in 100 mg/kg. The triazolo[1, 5-a] pyrimidines reported in this study have good anticonvulsant activity. This found enriches the antiepileptic structure-activity relationships of triazole compounds, and provides some foundations to the research and development of new drugs of the absence seizure and grand mal epilepsy.
triazole; pyrimidine; anticonvulsant; maximal electroshock shock; Sc-PTZ
1674-8085(2022)02-0028-07
R914.3
A
10.3969/j.issn.1674-8085.2022.02.005
2021-08-17;
2021-10-15
国家自然科学基金项目(21562028);江西省自然科学基金项目(20202BABL206154)
宋明霞(1983-),女,山西介休人,副教授,博士,主要从事抗菌与抗肿瘤药物研究(E-mail: freexiaoxiao83@aliyun.com);
*邓先清(1984-),男,湖南衡阳人,副教授,博士,主要从事抗癫痫先导物的发现与优化工作(E-mail: dengxianqing1121@126.com).

