锌镍铁三元水滑石的制备及其对铀的吸附性能研究
许婉冰,唐东山*,牛 洁,王 扬,李存增
(1.南华大学 资源环境与安全工程学院,湖南 衡阳 421001;2.核工业北京化工冶金研究院,北京 101149)
0 引 言
铀作为一种重要的核原料,由于其具有放射性高化学毒性、高迁移性、生物积累性和致癌性[1-2],是最重要的危险放射性核素之一。近年来,随着科学与技术的提高,核工业发展迅速。截至2019年12月底,我国共有18座核电厂和19座民用研究堆(临界装置)[3]。目前,在18座核电厂中分布了62台核电机组,其中包括47台商业运行核电机组和15台在建核电机组,分别比2018年同比增长了6.82%和25%。但是,随着放射性核素铀的开采与应用,核电在造福人类的同时,也将大量放射性核素释放到环境中,对生态环境多样性和人类的健康造成了严重威胁[4]。作为重要的能源矿产,世界的铀矿资源分布极不均匀,我国已探明的铀矿储量居于第10位之后[5],无法满足我国开展核电和核能利用的长远发展。低浓度含铀废水和海水中铀的浓度虽然低,但可富集利用的铀总量很大[6]。高效可行地回收利用低浓度废水中的铀,既可以解决含铀废水给环境带来的污染问题,又可以完善我国的天然铀资源保障体系。因此,从环境保护的角度和可持续发展的要求出发,对自然环境中核素铀的分离与富集进行深入研究至关重要。目前低浓度含铀废水的处理方法主要包括化学沉淀法[7]、离子交换法[8]、溶剂萃取法[9]、膜分离法[10]、吸附法[11-12]等。其中,吸附法因操作简便、成本较低、去除效率高、不引入二次污染和可控可调等优点广泛应用于放射性废水的处理,其关键是高稳定性、高选择性和高吸附容量吸附剂的制备。
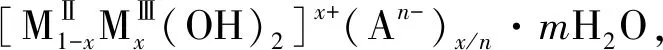
1 材料与方法
1.1 ZnNiFe-LDH的制备
本实验采用水热法一步制备ZnNiFe-LDH,具体步骤如下:准确称取0.91 g ZnCl2、1.59 g NiCl2·6H2O和2.70 g FeCl3·6H2O置于烧杯中,向其中加入50 mL去离子水,磁力搅拌至完全溶解;然后将12.00 g尿素缓慢加入到混合溶液中,持续磁力搅拌30 min形成均一溶液;将均一溶液转移至聚四氟乙烯不锈钢反应釜中,在100 ℃恒温条件下陈化反应6 h。静置冷却至室温后抽滤,用去离子水和无水乙醇交替洗涤样品多次,得到的固体在100 ℃干燥12 h,得到砖红色固体ZnNiFe-LDH,碾磨,装袋保存于硅胶干燥器中备用。
1.2 ZnNiFe-LDH吸附铀的性能测试
通过振荡吸附实验,考察溶液pH值、吸附时间和温度、吸附剂的投加量、铀初始质量浓度等因素对ZnNiFe-LDH吸附铀的影响及ZnNiFe-LDH对低浓度铀的吸附性能。
实验结果测定使用偶氮胂III显色法:利用可见分光光度计在波长为652 nm下测定滤出液的吸光度,所有实验重复3次,并取平均值计算滤出液中U(Ⅵ)的质量浓度以减小误差。根据公式(1)和(2)计算ZnNiFe-LDH对U(Ⅵ)的去除效率。
(1)
(2)
式中:η为三元水滑石对U(Ⅵ)的去除率,%;qe为三元水滑石的吸附量,mg/g;C0、Ce分别代表吸附前铀的初始质量浓度和吸附达到平衡后溶液中铀的质量浓度,mg/L;V为溶液体积,L;m为三元水滑石的质量,g。
1.3 样品表征
使用傅里叶红外光谱仪Nicolet iS 5型分析ZnNiFe-LDH的官能团,测试范围为400~4 000 cm-1,使用扫描电子显微镜Nova Nano SEM 450型和能谱仪X-Max-20型分析吸附前后材料的微观形貌和表面元素含量变化,使用X射线衍射仪D/max2550VB/PC型分析吸附前后材料的晶相结构变化,使用X射线光电子能谱仪ESCALABXi+型分析ZnNiFe-LDH吸附前后样品元素组成和原子价态。
1.4 吸附动力学
为了更准确地探讨ZnNiFe-LDH材料对于U(Ⅵ)去除的动力学特征,采用常用的准一级动力学模型和准二级动力学模型对吸附过程进行拟合,两种动力学模型如公式(3)和(4)所示。
1)准一级动力学模型:
ln(qe-qt)=lnqe-k1t
(3)
2)准二级动力学模型:
(4)
式中:t为吸附反应进行的时间,min;qt为吸附反应进行到t时刻时ZnNiFe-LDH对铀的吸附量,mg/g;k1为准一级吸附速率常数,min-1;k2为准二级吸附速率常数,g/(mg·min)。
1.5 ZnNiFe-LDH吸附等温线
吸附等温线是指在一定温度下,吸附达到平衡后溶质分子在固/液两相中的浓度关系曲线,对研究吸附过程和吸附机理有一定的指导意义。采用Langmuir和Freundlich等温吸附方程对实验结果进行拟合,两种等温吸附模型如公式(5)和公式(6)所示,
1)Langmuir等温吸附模型:
(5)
2)Freundlich等温吸附模型:
(6)
式中:qm为吸附剂的最大吸附量,mg/g;KL为Langmuir等温吸附平衡常数,mg/L;KF为Freundlich等温吸附平衡常数,mg1-n·Ln/g;n为与吸附强度有关的系数。
1.6 ZnNiFe-LDH吸附热力学分析
吸附热力学参数是表征吸附反应可行性和稳定性的重要指标之一,标准吉布斯自由能ΔG0(kJ/mol)、标准焓变ΔH0(kJ/mol)以及标准熵变ΔS0(kJ/mol)通过公式(7)、(8)和(9)计算可得。
式中:R为理想气体常数,8.314 J/(mol·K);T为反应温度,K;Kd为溶液的分散系数;lnK0可通过做lnKd与Ce的线性图外推截距得出。
2 结果与讨论
2.1 溶液pH对ZnNiFe-LDH吸附铀的影响
溶液pH对于吸附剂电荷状态与U(Ⅵ)离子存在形态都有较大的影响[25-26]。准确称取7份制备的ZnNiFe-LDH 0.01 g于250 mL的锥形瓶中,分别向其中加入pH为3、4、5、6、7、8、9的10 mg/L铀溶液100 mL,保持固液比0.1 g/L样品在25 ℃、260 r/min的转速下振荡反应60 min。取出样品过滤,用分光光度法分析滤出液的铀质量浓度。比较溶液的pH对ZnNiFe-LDH吸附U(Ⅵ)的影响,实验结果如图1所示。
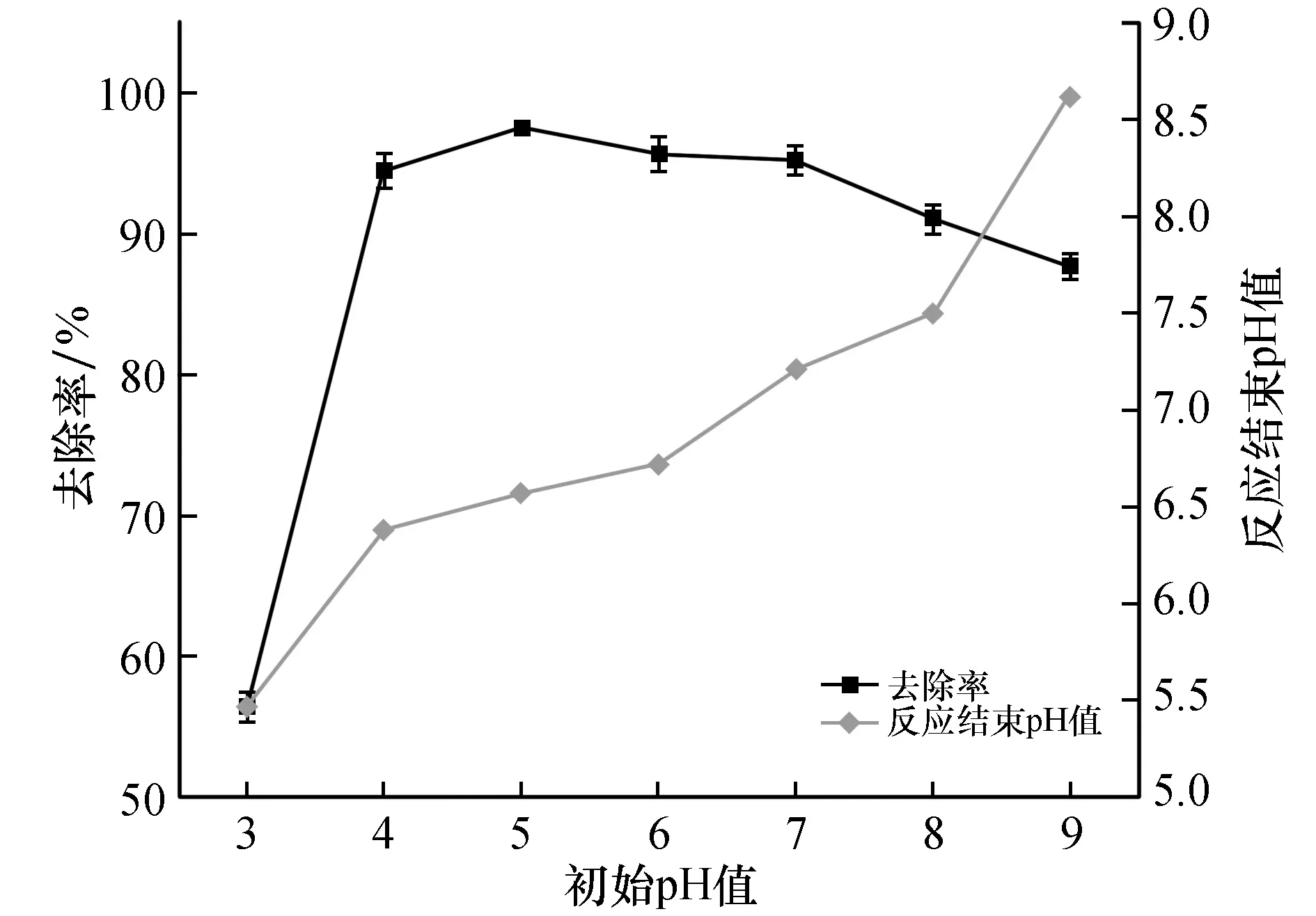
图1 溶液pH对ZnNiFe-LDH吸附U(Ⅵ)的影响Fig.1 The effect of solution pH on the adsorption of U(Ⅵ)by ZnNiFe-LDH
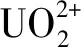
2.2 吸附剂的投加量对ZnNiFe-LDH吸附铀的影响
准确称取0.001、0.002、0.005、0.010、0.020、0.050、0.10 g ZnNiFe-LDH投入到250 mL的锥形瓶中,向其中加入10 mg/L的模拟U溶液100 mL,模拟铀溶液的初始pH为5.0,在25 ℃,260 r/min转速下振荡120 min,取出样品过滤,分析滤出液的铀质量浓度,确定固液比对ZnNiFe-LDH吸附U(Ⅵ)的影响,实验结果见图2。

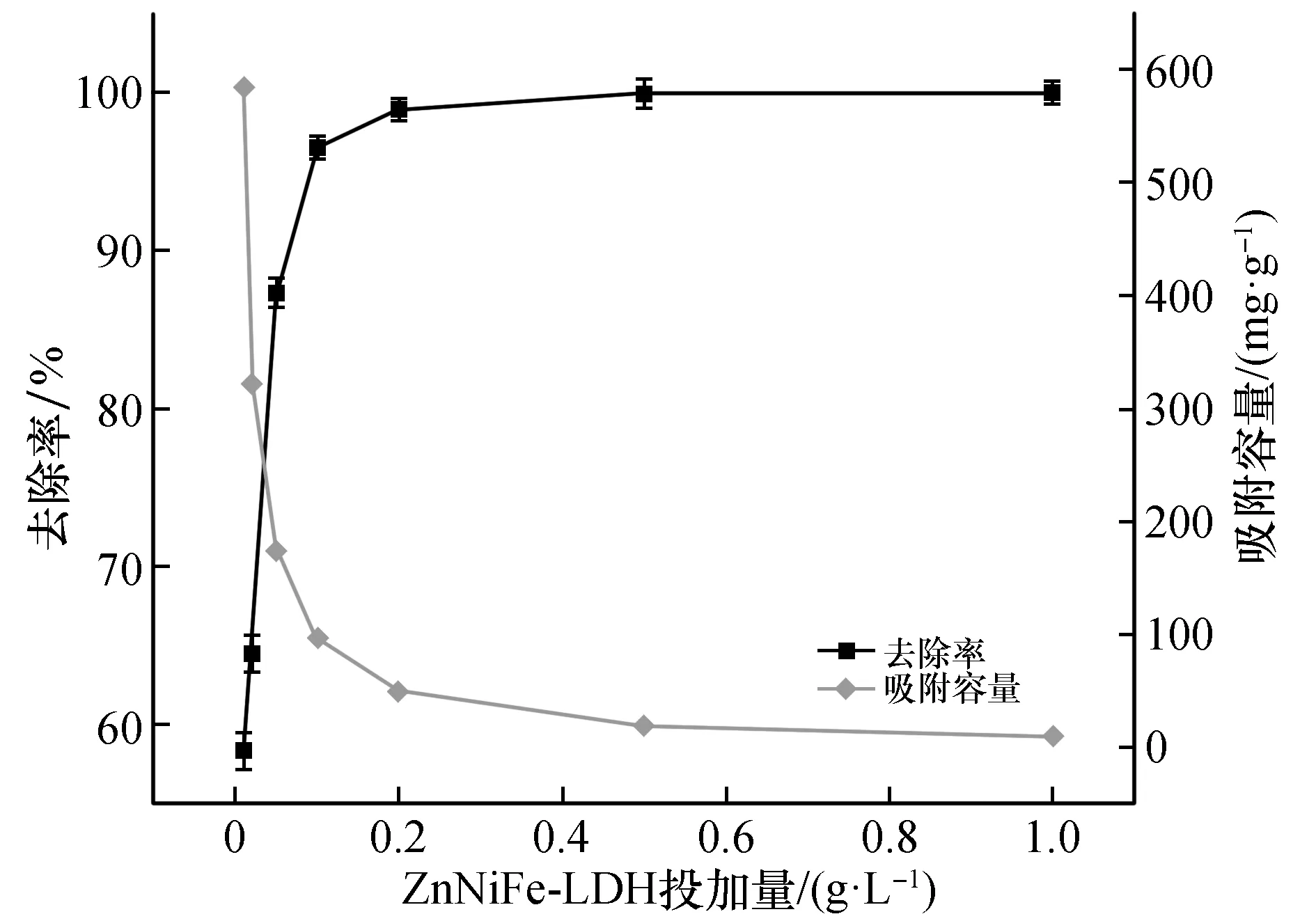
图2 吸附剂投加量对ZnNiFe-LDH吸附铀的影响Fig.2 The effect ofadsorbent dosage on the adsorption of uranium by ZnNiFe-LDH
2.3 U初始质量浓度对ZnNiFe-LDH吸附的影响
准确称取10份0.010 g ZnNiFe-LDH投入到不同250 mL的锥形瓶中,分别向其中加入pH=5的2、5、10、25、50、100、125、150、200、250 mg/L的U溶液100 mL,在25 ℃,260 r/min转速下振荡120 min,取出样品过滤,用分光光度法测量滤出液的铀质量浓度,分析U初始质量浓度对ZnNiFe-LDH吸附U效果的影响。实验结果见图3。


图3 U(Ⅵ)初始质量浓度对ZnNiFe-LDH吸附铀的影响Fig.3 The effect of the initial mass concentration of U(Ⅵ)on the adsorption of uranium by ZnNiFe-LDH
2.4 反应时间对ZnNiFe-LDH吸附铀的影响及其吸附动力学分析
准确称取0.010 g ZnNiFe-LDH投入到250 mL的锥形瓶中,向其中加入100 mL 10 mg/L的模拟U溶液,模拟铀溶液的初始pH为5.0,分别在温度为25 ℃、35 ℃、45 ℃,260 r/min转速下振荡5、10、20、30、40、50、60、90、120和150 min,取出样品过滤,分析滤出液的铀质量浓度,分析不同温度下接触时间对ZnNiFe-LDH吸附U(Ⅵ)效果的影响。
由图4可知,在反应初期(0~20 min),铀在ZnNiFe-LDH的吸附效率随着反应时间的增加而迅速升高,这是由于在反应刚开始,溶液中U(Ⅵ)浓度最高,反应推动力最大且ZnNiFe-LDH上具有大量可用吸附位点,故吸附效率迅速升高;随着反应时间的增加(20~120 min),溶液中U(Ⅵ)浓度下降,ZnNiFe-LDH可用的吸附位点减少,同时,已经负载在吸附位点上的U(Ⅵ)会阻碍其他的U(Ⅵ)在吸附剂上的扩散和吸附[27],吸附效率缓慢增加,最后保持稳定,吸附反应趋于平衡。对比不同温度下的3条曲线可知,温度越高,吸附平衡时间越短,反应效果越好,表明该反应是吸热反应,升温有利于反应的进行。
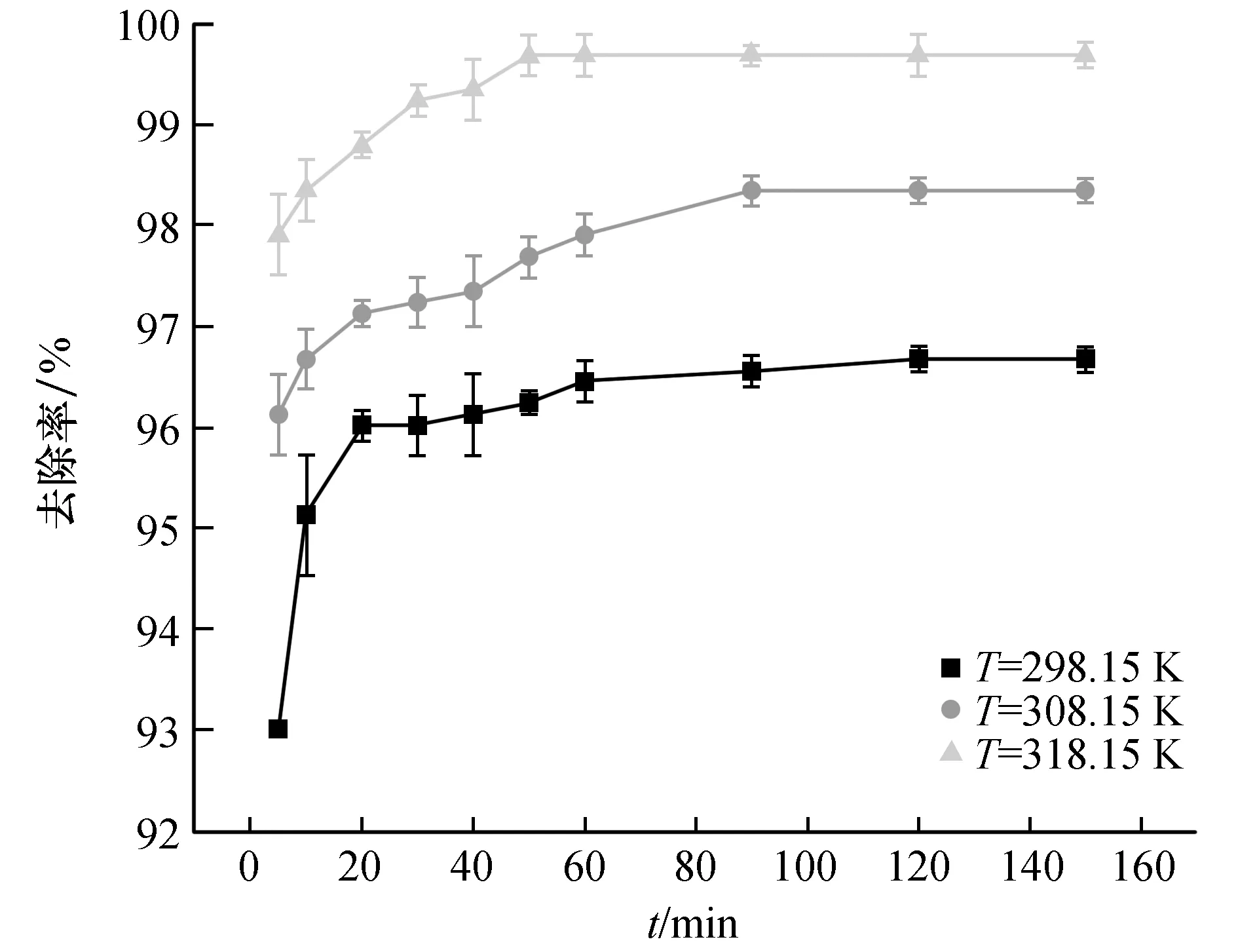
图4 反应时间对ZnNiFe-LDH吸附铀的影响Fig.4 The effect of reaction time on the adsorption of uranium by ZnNiFe-LDH
分别用准一级动力学模型和准二级动力学模型对ZnNiFe-LDH吸附铀的过程进行拟合,拟合曲线如图5所示,相关拟合参数见表1。由图5和表1可知,准二级动力学方程能更好地描述ZnNiFe-LDH对U(Ⅵ)的吸附动力学过程,三个温度的相关系数R2均接近1,且实验平衡吸附量qe,exp与理论平衡吸附量qe,cal非常接近,表明ZnNiFe-LDH吸附U(Ⅵ)的过程以化学吸附为主。
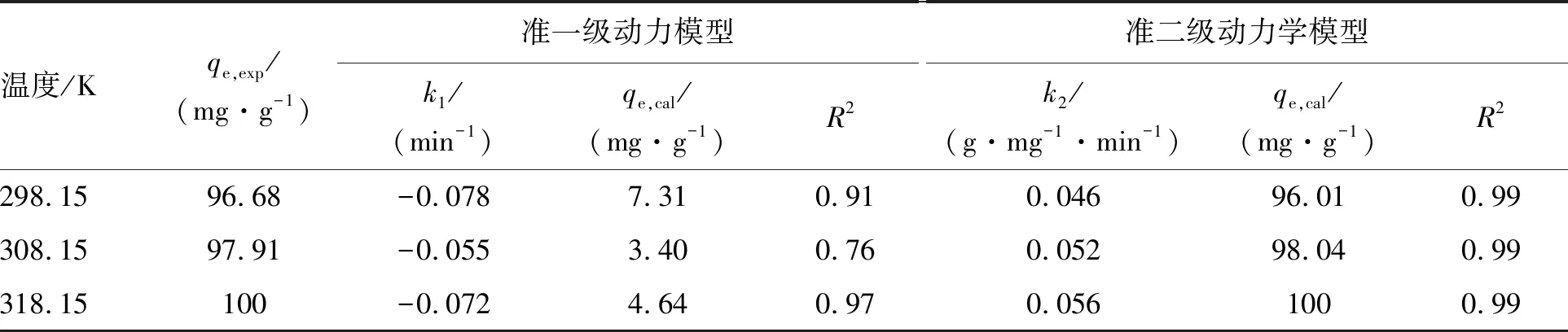
表1 ZnNiFe-LDH对U(Ⅵ)吸附动力学拟合参数Table 1 Fitting parameters of the adsorption kinetics of ZnNiFe-LDH to U(Ⅵ)

图5 ZnNiFe-LDH对U(Ⅵ)吸附动力学分析Fig.5 Kinetic analysis of U(Ⅵ)adsorption by ZnNiFe-LDH
2.5 反应温度对ZnNiFe-LDH吸附铀的影响及其吸附等温模型和热力学分析
准确称取0.010 g ZnNiFe-LDH投入到250 mL的锥形瓶中,向其中加入10、25、50、100、125、150、200、250 mg/L的模拟U溶液100 mL,模拟铀溶液的初始pH为5.0,分别在温度为25 ℃、35 ℃、45 ℃,260 r/min转速下振荡120 min,取出样品过滤,测量滤出液的铀质量浓度。分析不同温度下ZnNiFe-LDH吸附U(Ⅵ)效果的影响。实验结果如图6所示。
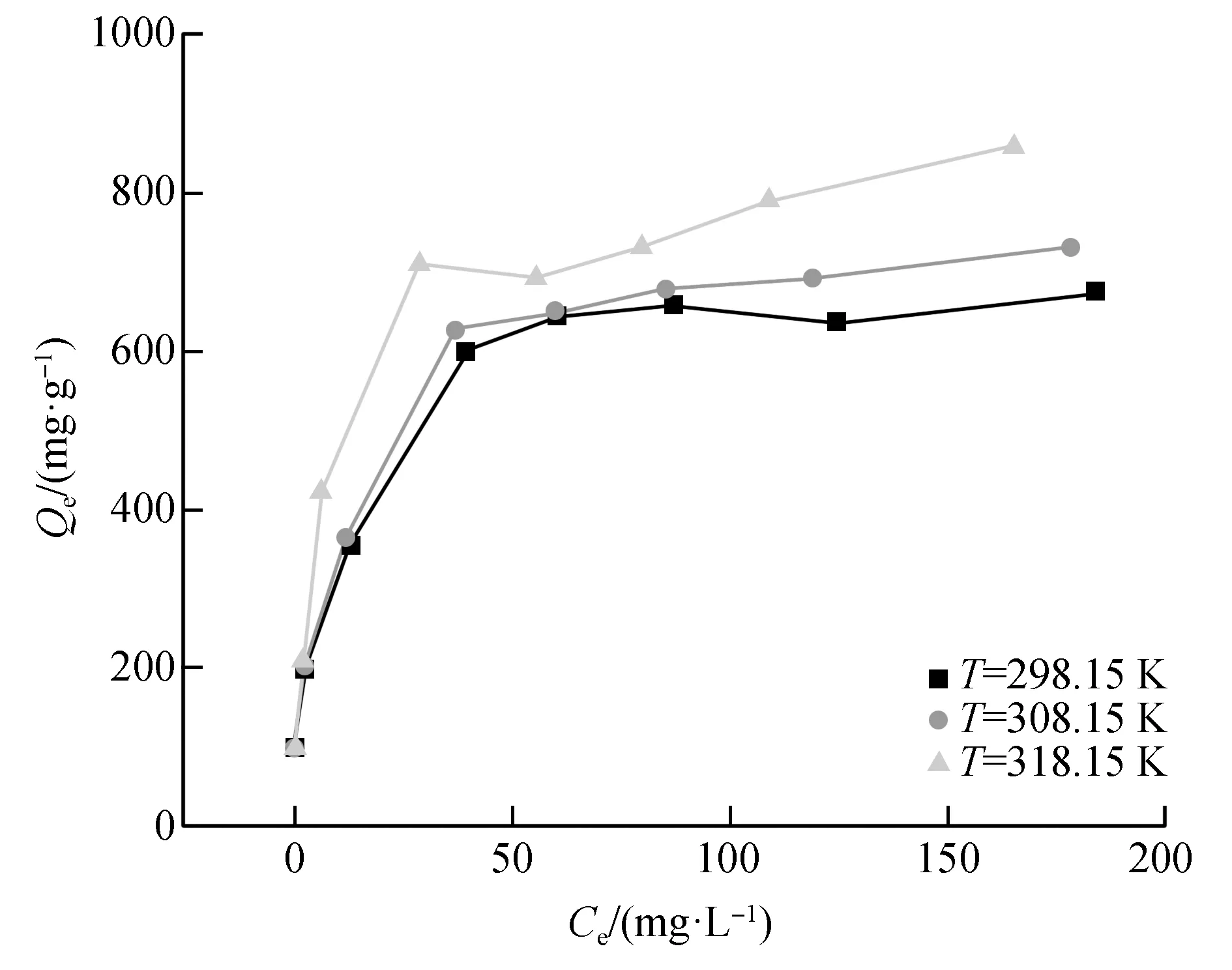
图6 反应温度对ZnNiFe-LDH吸附铀效果的影响Fig.6 The effect of reaction temperature on the adsorption of uranium by ZnNiFe-LDH
由图6可知,随着铀初始质量浓度的增加,平衡时体系中U(Ⅵ)的含量增加,但是ZnNiFe-LDH对铀的吸附量不断增加,提高温度有利于反应的进行。这可能是由于温度越高,分子间作用力越强,更有利于铀与结合位点的结合[28]。
为进一步揭示ZnNiFe-LDH对吸附U(Ⅵ)的机理,研究详细的吸附过程,分别用Langmuir和Freundlich等温吸附模型对吸附数据进行拟合,拟合曲线如图7所示,相关拟合参数见表2。
由图7和表2可知,Langmuir等温吸附模型能更好地描述ZnNiFe-LDH对铀的吸附,相关系数R2>0.99,说明ZnNiFe-LDH在溶液中分散均匀,吸附反应为单分子层吸附,Freundlich等温吸附模型中的1/n在0.1~0.5之间,表明ZnNiFe-LDH对U(Ⅵ)吸附较容易进行。在25 ℃时,Langmuir等温吸附模型拟合的最大吸附容量为689.66 mg/g,说明ZnNiFe-LDH在处理含铀废水方面有很大的潜力。
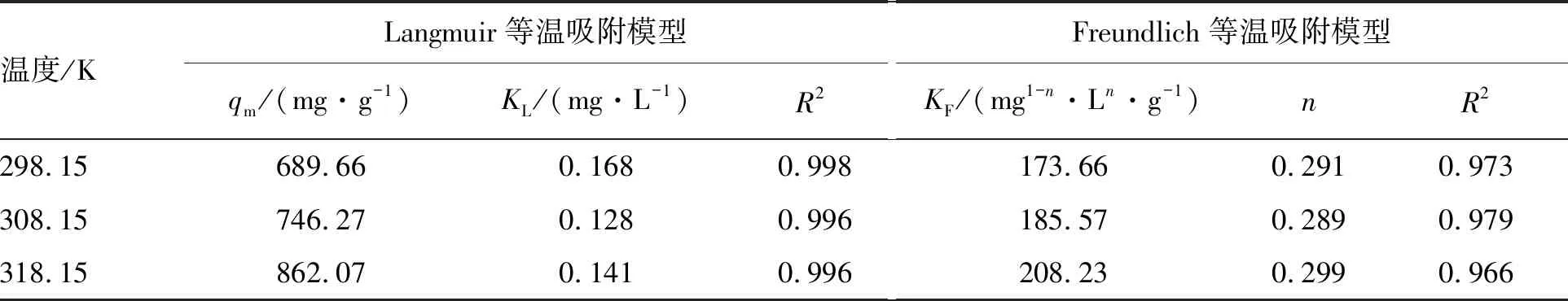
表2 ZnNiFe-LDH对于U(Ⅵ)吸附等温线拟合参数Table 2 Fitting parameters of adsorption isotherms of ZnNiFe-LDH to U(Ⅵ)
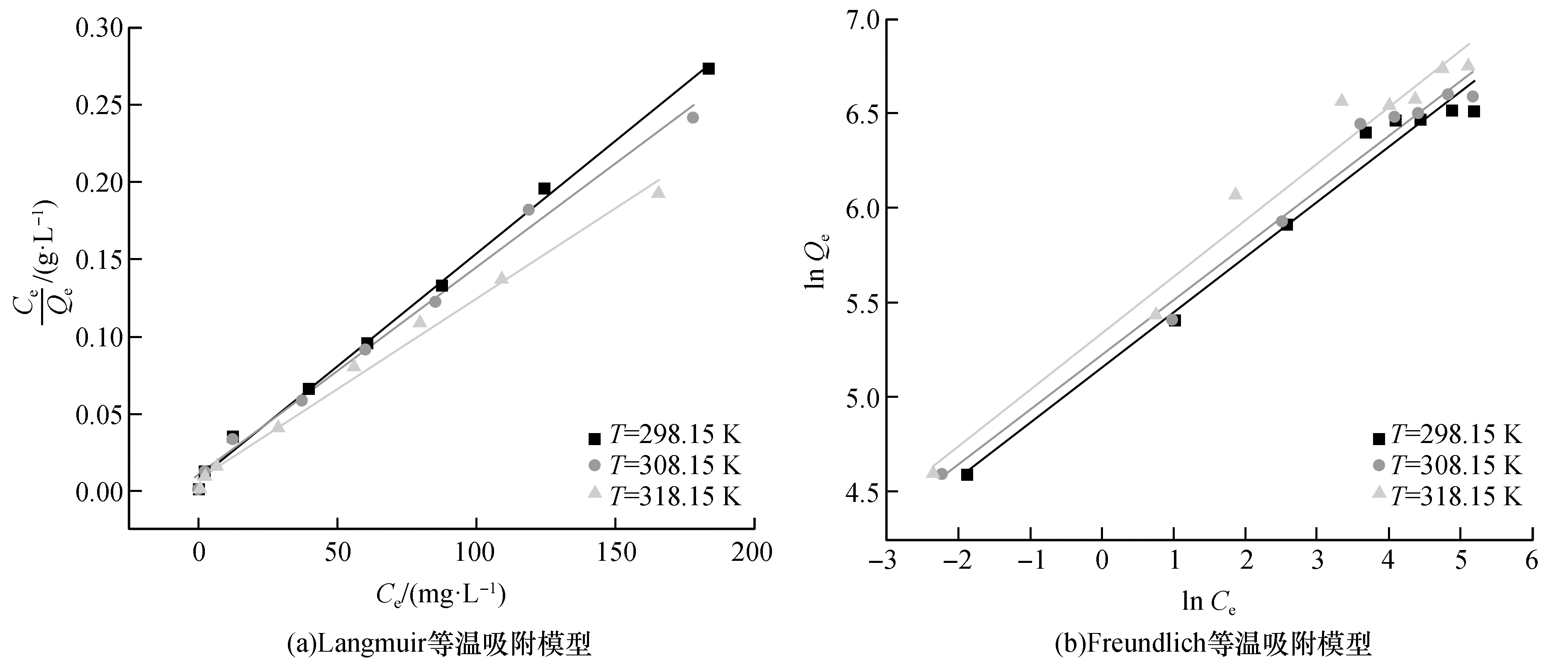
图7 ZnNiFe-LDH对U(Ⅵ)吸附等温线分析Fig.7 Analysis of Adsorption Isotherm of ZnNiFe-LDH to U(Ⅵ)
为了进一步研究反应温度对ZnNiFe-LDH吸附U(Ⅵ)效果的影响,根据公式计算该反应的热力学参数,lnKd-Ce的线性图和lnK0-1/T线性图见图8,标准吉布斯自由能ΔG0、标准焓变ΔH0以及标准熵变ΔS0等热力学参数的计算结果表3。
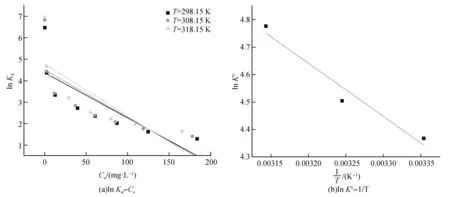
图8 ZnNiFe-LDH对U(Ⅵ)吸附热力学分析Fig.8 Thermodynamic analysis of U(Ⅵ)adsorption by ZnNiFe-LDH
由表3可知,在整个吸附温度范围内,吉布斯自由能ΔG0均小于0,表明ZnNiFe-LDH对于U(Ⅵ)吸附过程是自发进行的,且随着温度越高,ΔG0的绝对值增大,说明升温有利于反应的进行。吸附反应的焓变ΔH0>0,说明整个吸附过程吸热反应占主导地位,整个反应过程需要能量的进入,提高温度有利于反应的进行。整个反应的熵变ΔS0>0,表明吸附过程中整个吸附体系固液界面混乱度增加,即系统的自由度升高。

表3 ZnNiFe-LDH对于U(Ⅵ)吸附热力学拟合参数Table 3 Fitting parameters of adsorption thermodynamics of ZnNiFe-LDH for U(Ⅵ)
2.6 表征分析
2.6.1 SEM-EDS分析
ZnNiFe-LDH吸附铀前后的SEM-EDS表征结果见图9和图10。

图9 ZnNiFe-LDH的扫描电镜图Fig.9 Scanning electron micrograph of ZnNiFe-LDH
由图9中的(a)、(c)和(e)可知,本实验制备的ZnNiFe-LDH呈现三维立体蜂窝孔状,ZnNiFe-LDH的立体孔状结构增加了吸附材料的比表面积,更有利于吸附反应的进行。当ZnNiFe-LDH吸附铀后,水滑石的形貌结构发生了一定程度的变化,水滑石表面的蜂窝孔状结构发生了一点坍塌,结合ZnNiFe-LDH吸附铀前后的EDS能谱图(图10),表明铀酰离子被成功吸附在ZnNiFe-LDH的蜂窝表面。
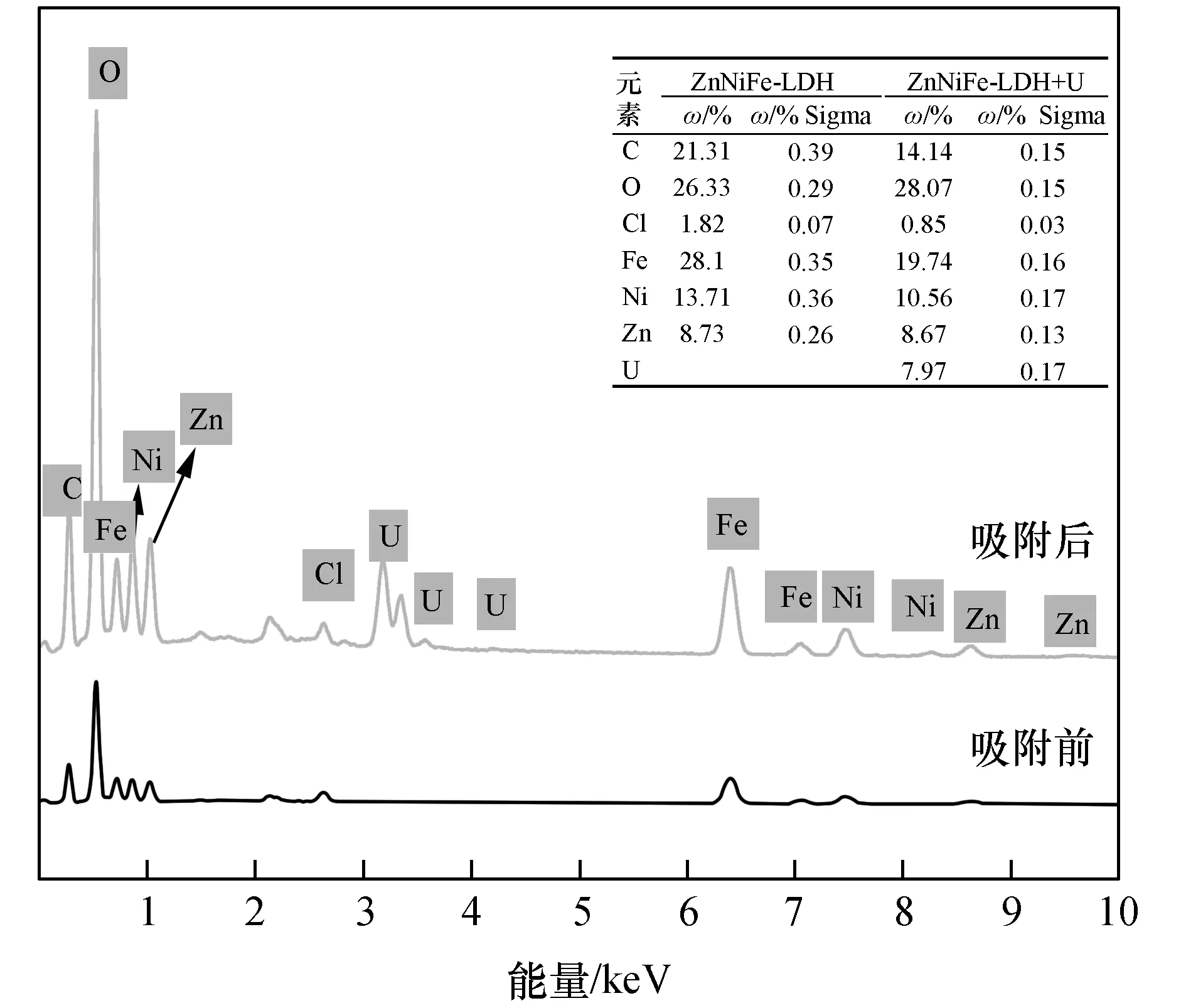
图10 ZnNiFe-LDH吸附前后的EDS能谱图Fig.10 EDS spectra ofZnNiFe-LDH before and after uranium adsorption
2.6.2 FI-IR分析
为了深入探索ZnNiFe-LDH对U(Ⅵ)的吸附机理,利用FI-IR表征分析了材料可能存在的官能团,实验结果见图11。
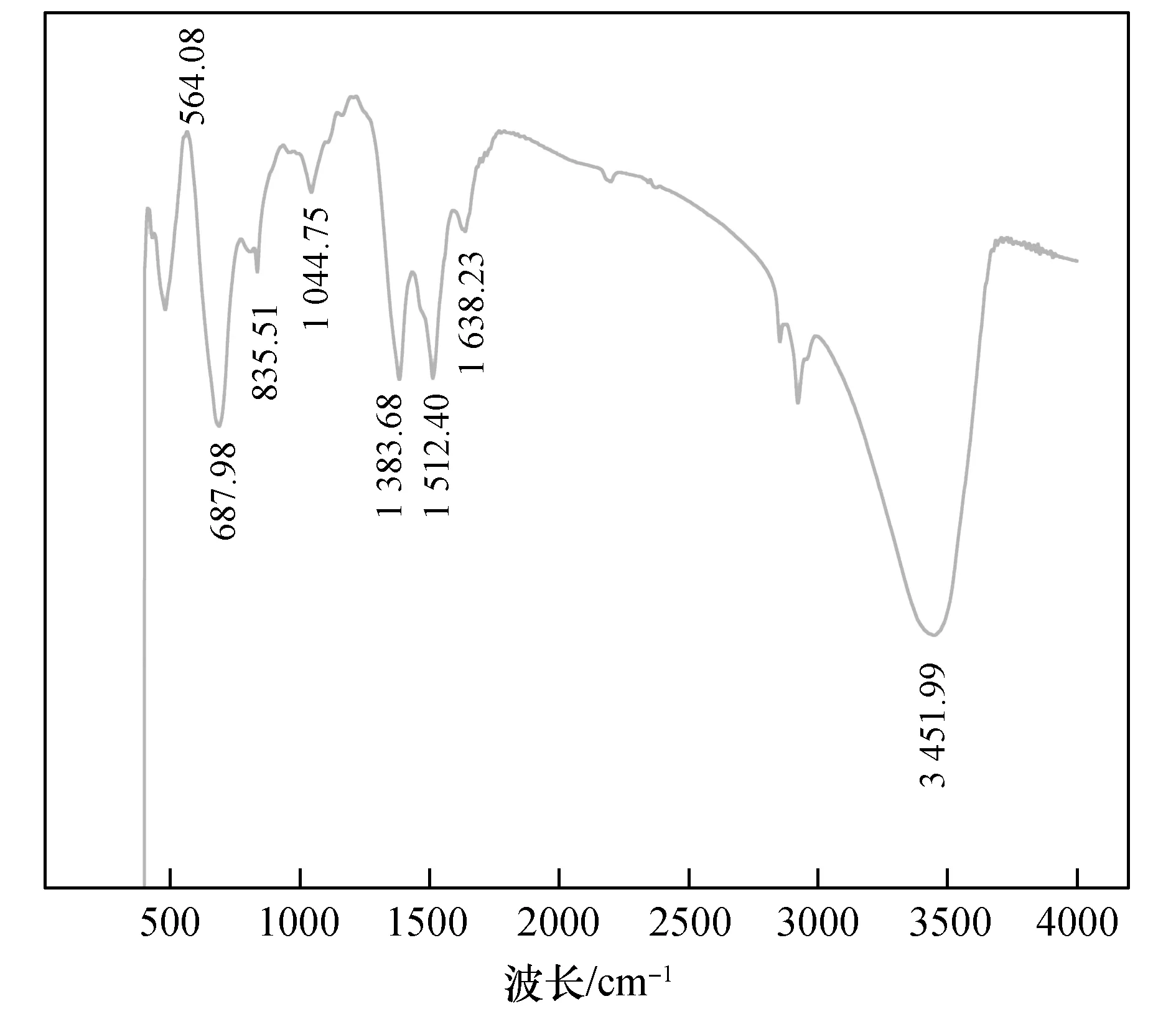
图11 ZnNiFe-LDH的FI-IR红外光谱Fig.11 FI-IR infrared spectrum of ZnNiFe-LDH
2.6.3 XRD分析
为了进一步研究ZnNiFe-LDH在吸附过程中的体相变化,对吸附前后的进行XRD分析,实验结果见图12。
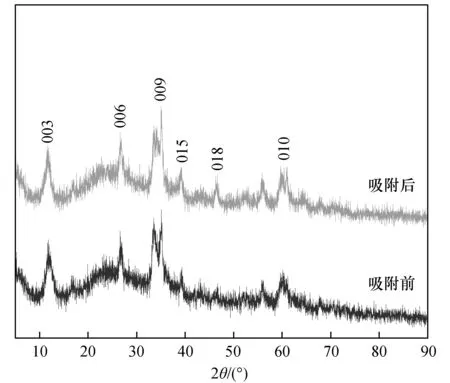
图12 吸附前后ZnNiFe-LDH的XRD图Fig.12 XRD patterns of ZnNiFe-LDH before and after uranium adsorption
由图12可知,在2θ=11.65°、23.42°、35.45°、39.44°、46.92°、60.74°时出现了水滑石特有的晶面衍射峰(003)、(006)、(009)、(015)、(018)、(110)[19,37],衍射强度较高,且晶面特征峰清晰无杂峰,说明成功制备了结晶度高的ZnNiFe-LDH。ZnNiFe-LDH在吸附铀后(015)特征峰发生了轻微偏移,(009)的特征峰强度减弱,说明水滑石的晶型结构在吸附铀后遭受到了一定程度的破坏。吸附铀后,未增加新的衍射峰,表明吸附的铀未形成新的结晶[28]。
2.6.4 XPS分析
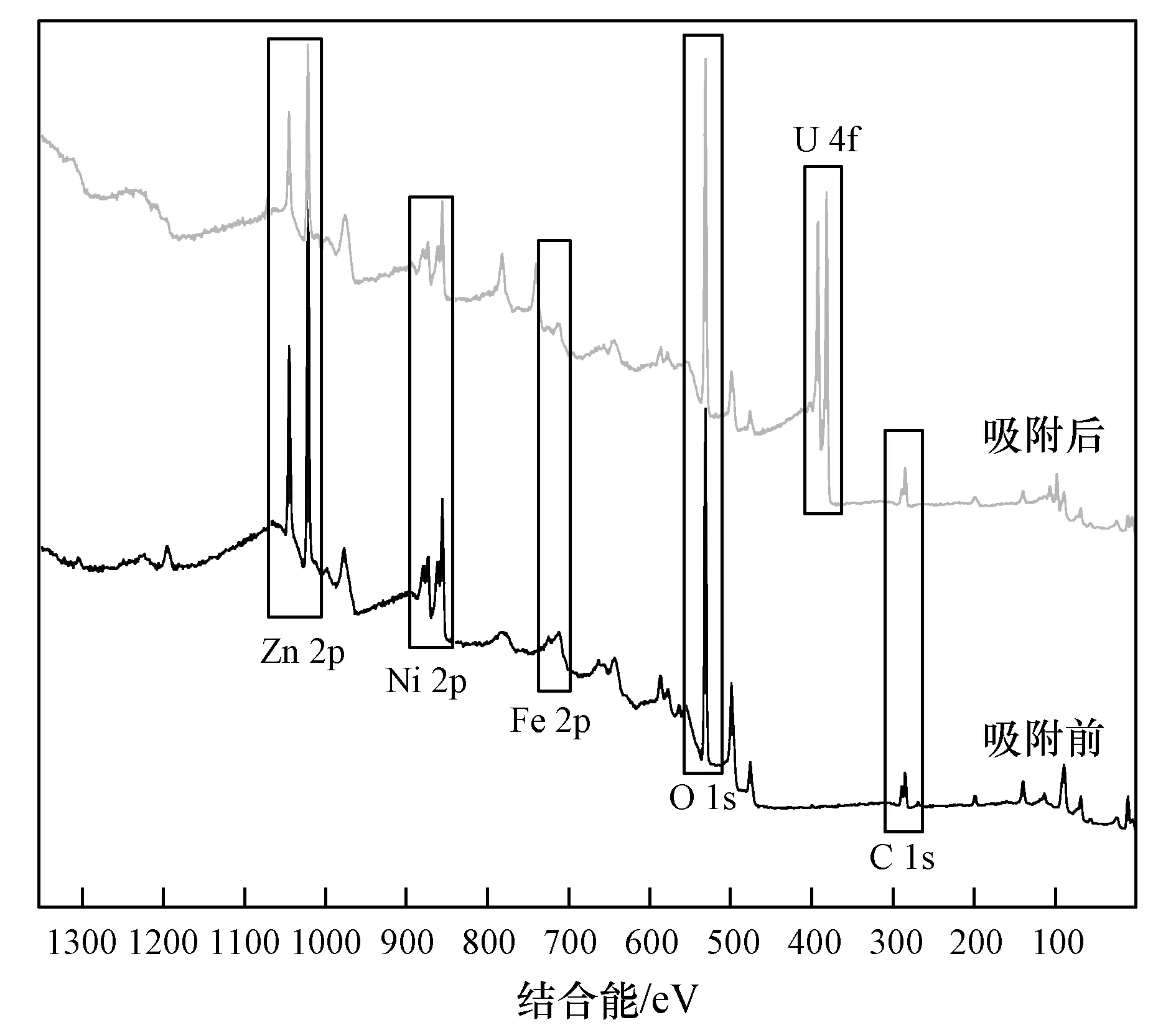
图13 吸附前后ZnNiFe-LDH的XPS总谱Fig.13 XPS total spectrum of ZnNiFe-LDH before and after adsorption
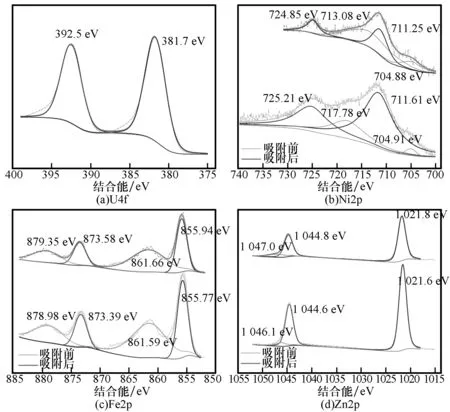
图14 ZnNiFe-LDH的XPS高分辨率图谱Fig.14 XPS high-resolution spectra of ZnNiFe-LDH
由图13和14(a)可知,制备的ZnNiFe-LDH成功吸附了含铀废水中的U(Ⅵ),由U4f的高分辨图谱可知,反应后出现了U(Ⅵ)的U4f7/2和U4f5/2特征峰,并没有出现U(Ⅳ)的特征峰,结合图14中的(b)~(d),Zn2p、Ni2p和Fe2p高分辨图谱中Zn2+、Ni2+和Fe3+价态均未发生变化,但是Zn2p、Ni2p和Fe2p特征峰均向高电子能级偏移,说明Zn、Ni和Fe三种元素的氧化物/氢氧化物参与了化学吸附反应[38],但是吸附过程中没有发生氧化还原,表明ZnNiFe-LDH对铀的吸附机理为表面络合作用。
3 结 论
采用水热法成功制备了具有三维立体蜂窝状的ZnNiFe-LDH用于吸附10 mg/L的U(Ⅵ)。单因素实验表明,ZnNiFe-LDH对U(Ⅵ)有高效的去除效率,在最佳pH=5,吸附剂的投加量为0.10 g/L的条件下,接触反应120 min,ZnNiFe-LDH对铀的去除率为97.57%。动力学和热力学实验表明,准二级动力学模型和Langmuir等温吸附模型的相关系数R2更接近于1,表明ZnNiFe-LDH对铀的吸附是以化学吸附为主的单分子层吸附,且该反应是一个容易进行的自发吸热反应。结合表征分析可知,ZnNiFe-LDH对铀的吸附机理主要是表面络合作用。在25 ℃时,ZnNiFe-LDH对铀的饱和吸附容量为689.66 mg/g,表明ZnNiFe-LDH的水滑石在处理低浓度含铀废水的方面有巨大的应用潜力。

